水貂阿留申病毒5个分离株的全基因测序及遗传变异分析
刘东旭,李健明,时 坤,曾范利,刘 菲,杜 锐
(吉林农业大学中药材学院,吉林长春 130118)
水貂是一种珍贵的毛皮动物,其皮毛是国际裘皮市场的三大支柱之一,素有“裘皮之王”的美誉。目前市场流通的水貂皮主要是依靠人工养殖水貂而得。水貂阿留申病(Aleutian disease of mink,AD)又名浆细胞增多症,是由细小病毒科(Parvoviridae)、阿留申貂病毒属(Amdovirus)的水貂阿留申病毒(Aleutian disease viruses,ADV)引起的一种慢性、病毒性传染病[1]。该病自发现以来,世界多地的水貂养殖场均发现阿留申病,给水貂养殖业造成了巨大的经济损失[2]。ADV感染水貂后,水貂体内不产生或只产生少量的中和抗体,而产生的多数抗体不仅不能具有中和病毒的毒力,反而通过介导抗体依赖性增强作用,进一步帮助ADV对靶细胞的侵染[3]。而且,由于病毒抗原与抗体形成的复合物(immune complex,IC)特有的理化特点可导致IC沉积并引发肾小球肾炎和动脉炎。这些都对基于病毒粒子构建疫苗带来了许多的困难[4]。对此,国外学者认为基于病毒衣壳构建疫苗应该是无效的,许多尝试也证明了这一点[5]。因为ADV特有的致病机理,研制开发针对ADV的疫苗,一直是动物医学界很棘手的问题[6-7]。
本试验根据GenBank上公布的不同ADV毒株基因序列,设计12对引物,对吉林农业大学经济动物疾病实验室分离和鉴定具有致病性的水貂阿留申病毒进行全基因扩增、测序,并对测序结果进行分析,为进一步研制有效防控水貂阿留申病弱毒疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 UNIQ-10柱式病毒基因组抽提试剂盒为上海生工生物工程技术服务有限公司产品;pMD18-T Vector、感受态细胞JM109、T4DNA连接酶、DNA Marker DL 2 000、ExTaqDNA 聚合酶、dNTP为TaKaRa公司产品;DNA凝胶回收试剂盒、溴化乙锭(EB)、琼脂糖、琼脂粉为维特杰公司产品。
1.1.2 病毒 由吉林农业大学经济动物疾病实验室所分离和保存的5株具有致病性的水貂阿留申病病毒分离株 ,分别命名为 ADV-DL124、ADVDL125、ADV-Z3、ADV-Q2、ADV-Q3。
1.2 方法
1.2.1 引物的设计 根据GenBank上公布的不同ADV全基因序列(ADV-G登录号:M20036、NC001662;ADV-Utah登录号:Z18276;ADV-SL3登录号:X97629),设计12对引物进行全基因扩增。各个引物序列及相对于ADV-G毒株全序列的位置如表1所示。
1.2.2 目的片段的克隆及测序 使用UNIQ-10柱式病毒基因组抽提试剂盒,按照说明书,提取病毒的DNA。以提取的病毒DNA为模板,用12对引物进行全基因组分段扩增,扩增的退火温度分别为:55.6、52.6、51.1、54、51.5、57、54.9、54.2、52.6、56、58.7和55.7℃。将PCR产物纯化后,与pMD18-T载体连接,转化到JM109感受态细胞中,进行蓝白斑筛选。挑取白色单菌落摇菌、提质粒,经鉴定后的重组质粒送至上海生物工程股份有限公司测序。
1.2.3 序列分析 利用DNA Star将5株病毒的全基因序列,与GenBank中ADV参考序列,进行核苷酸序列分析及同源性比较,并构建系统发育进化树,分析我国毒株与其他国家和地区流行毒株的关系。同样利用DNA Star将本实验室分离的毒株、ADV参考毒株以及细小病毒亚科各属代表种的全基因序列推导核苷酸序列并进行分析及同源性比较,构建相应的系统发育进化树,分析ADV与其他各属成员的进化关系。
2 结果
2.1 PCR扩增结果
应用设计的引物对ADV分离株的全基因进行分段PCR扩增,获得目的片段均与预期结果相符(表1),扩增结果如图1所示。

表1 分段扩增所用的引物序列及对应Table 1 Primer sequences used in fragment amplification
2.2 ADV分离株与参考毒株的序列分析
用DNA Star软件中的seqMan程序对测序结果进行拼接,得到分离株的全基因序列。用DNA Star软件MegAlign程序中的Clustal W Method将分离株核苷酸序列和病毒参考株的对应全序列进行同源性比较和构建进化树。本研究使用的参考毒株序列来源于GenBank,病毒归属、名称和登录号见表2,同源性分析结果见图2。
ADV分离株序列分析结果表明,在232-255、408-442、3 105-3 138bp等处与参考株差异比较大。ADV-Q2在1 569-1 574bp处有5个基因的插入,除了ADV-Z3分离株外,其他分离株在1 977bp处均有基因缺失。ADV-DL124、ADV-DL125与参考毒株ADV-LN1相同,在2 493-2 523bp处有30bp左右的基因缺失。ADV-Q3在4 365-4 373bp处有基因插入。本试验用到的5个毒株之间,同源性最低的ADV-DL124和ADV-Z3之间为93.1%,且部分实验室分离毒株与致病毒株间同源率较低,这与国外学者的研究结果一致[8]。

图1 全基因各分段PCR结果Fig.1 PCR results of different segments of the whole genome of ADV
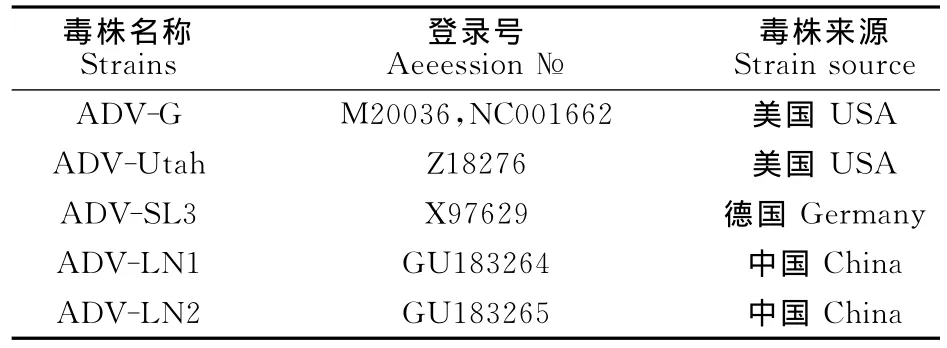
表2 所引用的ADV毒株一览表Table 2 List of ADV strains used as references in this study
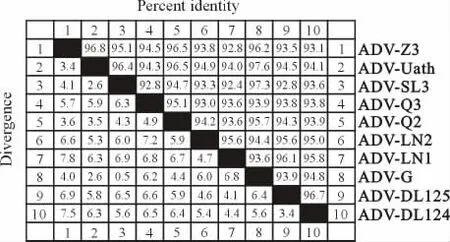
图2 试验株与参考株的同源性分析Fig.2 Homology analysis of ADV isolates with the reference strains
2.3 ADV毒株与细小病毒亚科其他属代表毒株的序列比较
用DNA Star软件MegAlign程序中的Clustal W method将分离毒株核苷酸序列与ADV参考株序列以及细小病毒其他4个属的代表毒株全序列进行同源性比较和进化树分析。其他属的毒株序列均来源于GenBank,病毒名称、缩写和登录号见表3,根据序列比对的结果构建的进化树(图3)。由图3可知,17株病毒可划归为3个相对独立的进化分支,虽然ADV与MEV、CMV、MVM分支相对亲缘关系较近,但在进化关系上明显属于不同的分支。根据ICTV8新的分类标准,ADV被划归为新的病毒属,与其他4个属并列,本试验的进化树分析结果与新分类标准吻合。

表3 细小病毒参考株列表Table 3 Lists of reference parvovirus strains used in this study
2.4 ADV毒株VP2蛋白氨基酸序列分析
通过DNA Star软件对5株ADV的VP2核苷酸推导的氨基酸序列进行对比分析(图4)可知,所分离的5株毒株中,61个氨基酸发生突变。在这61个氨基酸中,有2个突变位点仅存在于此次分离的毒株中,即115位亮氨酸和362位谷氨酸。
3 讨论
虽然ADV发现较早,但我国对于完整编码区基因的报道较少,因此对我国貂场ADV流行株的基因背景尚不清楚。对本实验室分离的5株阿留申病毒进行全基因测序,获得5个分离株的全基因序列。与GenBank中其他ADV毒株核苷酸序列比较分析,5个ADV分离株与欧美毒株ADV-G、ADVUtahl、ADV-SL3的核苷酸同源性最低的为92.8%,最高的为97.6%,差距较大,这与其他学者的报道一致[9-10]。通过DNA Star软件对5个 ADV的 VP2核苷酸推导的氨基酸序列分析可知,所分离的5个毒株中,61个氨基酸发生突变。在这61个氨基酸中,有2个突变位点仅存在于此次分离的毒株中,即115位亮氨酸和362位谷氨酸。特殊位点位于G/U-8上的翻译核衣壳VP2蛋白的352位氨基酸[11]与534位点的组氨酸[12],5个分离毒株均与AD VUtah 1株相同,分别为苏氨酸和天冬氨酸。ADVDL124和ADV-DL125与ADV-G株相同,在26-35氨基酸处缺失9个氨基酸,且在36氨基酸处缺失一个氨基酸-甘氨酸。ADV-Q2在541-636位的氨基酸与其他毒株差异较大,但动物回归试验可知,该毒株同样可以引起水貂发病,是致病毒株。这些特殊位点的氨基酸的突变和缺失对貂阿留申病毒功能的影响还有待进一步研究。

图3 ADV病毒与细小病毒亚科其他属代表毒株的进化树分析Fig.3 Phylogenetic tree of ADV isolates in this study and the representative strains of other genera in subfamily Parvovirinae.

图4 试验株VP2蛋白与参考株的氨基酸序列分析部分结果Fig 4.The comparison of the amino acid sequences of VP2of ADV isolates and the reference strains
从本试验所构建的ADV分离毒株全长基因系统发育进化树中可知,分离株ADV-DL124和ADVDL125与国外参考株ADV-G、ADV-Utah和ADVSL3位于不同的进化分支,亲缘关系上相对较远,分析可能原因为国内分离株为本试验选取的参考株以外的其他国外毒株进化而来或者相对于国外参考株来说发生了基因的变异。无论是出于哪种原因,本研究中用到的ADV分离株具有高度的遗传多样性,这与国外学者得到的ADV具有高度遗传多样性的研究结论相一致[8]。在研究中,无论是基于VP2基因序列的研究,还是基于对NS-1基因序列的研究,ADV存在高度遗传多样性的现象均得到了证明。
病毒通过变异产生的遗传多样性及对变化莫测的环境的惊人适应能力构成了病毒的生存和进化的基础。高度遗传多样性的存在,在某种程度上也意味着遗传、变异趋势的不稳定性。因此,积极应对病毒的进化,密切关注ADV遗传进化的规律和趋势,为进一步进行诊断和预防阿留申病毒的研究积累基础资料显得尤为必要。本试验通过对实验室所分离的具有致病性的5株水貂阿留申病毒全基因测序分析,可以发现,分离株之间存在着诸多的差异,这些差异对病毒的功能和本身致病性的影响,还需进一步研究。同时,这些位点的差异,为研制水貂阿留申病基因疫苗提供了理论依据,为基因改造水貂阿留申病疫苗提供了探索和尝试的方向。
[1]杨 莘,易 立,王建科,等.水貂阿留申病毒结构蛋白与非结构蛋白在疾病诊断与疫苗研发中的应用[J].动物医学进展,2011,32(1):69-72.
[2]Prieto A,Diaz-cao J M,Fernandez-Antonio R,et al.Application of real-time PCR to detect aleutian mink disease Virus on environmental farm sources[J].Vet Microbiol,2014,173:355-359.
[3]朱洪伟,邢秀梅,温永俊.水貂阿留申病毒抗体依赖性感染增强作用的可能机制探讨[J].病毒学报.2014,30(4):450-453.
[4]张秀丽,于慧娟,徐 超,等.水貂阿留申病毒荧光定量PCR检测方法的建立及初步应用[J].中国畜牧兽医,2014,41(9):1-5.
[5]Bloom M E,Best S M,Hayes S F,et al.Identification of A-leutian mink disease parvovirus capsid sequences mediating antibody dependent enhancement of infection,virus neutralization,and immune comylex formation[J].J Virol,2001,11:11116-11127.
[6]王振军,吴 威,闫喜军,等.水貂阿留申病病毒VP2蛋白基因在昆虫杆状病毒表达系统中的表达[J].中国兽医科学,2013,43(12):1246-1251.
[7]甘 露,刘立兵,时 坤,等.水貂阿留申病毒结构蛋白与非结构蛋白的研究进展[J].经济动物学报,2012,16(3):181-184.
[8]Murakami M,Matsuba C,Une Y,et al.Nucleotide sequence and polymerase chain reaction/restriction fragment length polymorphism analyses of Aleutian disease virus in ferrets in Japan[J].J Vet Diagn Invest,2001,13(4):337-340.
[9]Wang Zhenjun,Wu Wei,Hu Bo,et al.Molecular epidemiology of Aleutian mink disease virus in China[J].Virus Res,2014,184:14-19.
[10]Yang Hongyan,Fu Jing,Ning Fang-yong,et al.Genetic diversity analysis among populations of mink from China by inter-simple sequence repeat (ISSR)Markers[J].J Northeast Agri Univ,2014,20(3):47-54.
[11]Stevenson M A,Fox J M,Wolfinbarger J B,et al.Effect of a valine residue at codon 352of the VP2capsid protein oninvivoreplication and pathogenesis of Aleutian disease parvovirus in mink[J].Am J Vet Res,2001,62(10):1658-1663.
[12]Huang Qinfeng,Luo Yong,Cheng Fang,et al.Molecular characterization of the small nonstructural proteins of parvovirus Aleutian mink disease virus(AMDV)during infection[J].Virology,2014,28:452-453.

