α-硫辛酸对Marc-145细胞感染高致病性猪繁殖与呼吸综合征病毒后氧化应激的影响
张 浩,胡莲美,邱先帅,肖熹玉,任常宝,唐兆新,*
(1.华南农业大学兽医学院,广东广州 510642;2.肇庆大华农生物药品有限公司,广东肇庆 526238)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)又称猪蓝耳病,是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种急性接触性传染病。2006年6月起,“猪高热综合症”在我国南方部分省份暴发,并在全国大范围流行,经过流行病学调查、病毒分离、基因分析和动物试验等,确定为PRRSV变异株造成,并将变异株命名为高致病性猪繁殖与呼吸综合征病毒(HPPRRSV)[1]。许多学者进行了病毒对细胞作用机制的深入研究。研究表明,病毒感染可以引起机体内细胞活性氧簇(reactive oxygen species,ROS)的释放,ROS可以使细胞膜磷脂层发生脂质过氧化,导致线粒体功能紊乱,ROS被认为是病毒性疾病病理过程中引起细胞损伤的元凶[2-3]。
α-硫辛酸(alpha-lipoic acid,LA)是一类维生素,有很强的抗氧化活性,被誉为“万能抗氧化剂”[4]。LA具有很强的清除自由基和活性氧能力[5],0.05mmol/L~1mmol/L浓度的 LA 可以清除羟基自由基、次氯酸[6]。同时LA可以通过增强细胞内半胱氨酸的有效性来提高谷胱甘肽(L-glutathione,GSH)的浓度。本研究以HP-PRRSV感染Marc-145细胞为模型,通过测定过氧化氢(H2O2)和丙二醛(MDA)的含量及超氧化物歧化酶(super-oxide dismutase,SOD)和过氧化氢酶 (catalase,CAT)两种抗氧化酶的活力,研究α-硫辛酸对Marc-145细胞感染高致病性猪繁殖与呼吸综合征病毒后细胞内抗氧化功能的影响,探讨HP-PRRSV对Marc-145细胞抗氧化功能的损伤机制和α-硫辛酸对HP-PRRSV的抑制机制,为HP-PRRSV临床病理研究提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 细胞和病毒 Marc-145细胞和高致病性猪繁殖与呼吸综合征病毒(NVDC-JXA1株)由肇庆大华农生物药品有限公司重点实验室提供,病毒TCID50为107.5/0.1mL。
1.1.2 主要试剂和仪器 DMEM高糖培养基、标准胎牛血清为Gibico公司产品;过氧化氢、SOD、CAT、MDA检测试剂盒为南京建成生物工程研究所产品;MTT为Sigma公司产品;CO2培养箱为Revco公司产品;6孔培养板为Costar公司产品;倒置相差显微镜为Nikon公司产品。
1.2 方法
1.2.1 细胞培养与病毒增殖 Marc-145细胞用含100mL/L胎牛血清的DMEM培养基培养,置于37℃体积分数为5%CO2培养箱中。待细胞长成单层,接种 HP-PRRSV,37℃孵育1h,加入含有20mL/L的胎牛血清的DMEM维持液,待细胞病变达到80%时收获病毒,反复冻融3次,待细胞完全脱落,离心收集上清,分装,置-80℃保存。
1.2.2 细胞分组处理 将生长状况良好的Marc-145细胞以2mL/孔(约1.8×106个)接种到六孔培养板。待细胞形成单层,将细胞分为4组,即正常细胞对照组NC组(细胞维持液)、病毒组D组(含10-3×TCID50病毒液的维持液)、α-硫辛酸干预病毒组DLA组(10-3×TCID50病毒液和250μmol/Lα-硫辛酸的维持液)、α-硫辛酸干预组 LA 组(含250μmol/Lα-硫辛酸的维持液)。
1.2.3 细胞氧化应激检测试验 将4组细胞分别接种在六孔板后,每个时间段各设置2个重复组,分别在2、12、24、36、48h收集细胞,置低温冰箱反复冻融,取上清液,按试剂盒说明书测定H2O2含量、MDA含量、SOD活力和CAT活力,每孔复测3次。
1.2.4 统计学处理 试验数据用SPSS统计软件单因素分析程序分析各组之间的差异显著性。
2 结果
2.1 Marc-145细胞内H2O2含量的变化
结果见表1。由表1可知,试验进行12h时,D组和DLA组细胞内H2O2含量显著高于NC组和LA组(P<0.05)。24h时,D组和DLA组细胞内H2O2含量迅速增加,显著高于NC组和LA组(P<0.05)。LA组细胞内 H2O2含量显著低于其他3组(P<0.05)。36h和48h时,D组细胞内H2O2含量显著高于其他3组(P<0.05),DLA组细胞内H2O2含量显著低于D组,而显著高于NC组和LA组(P<0.05)。
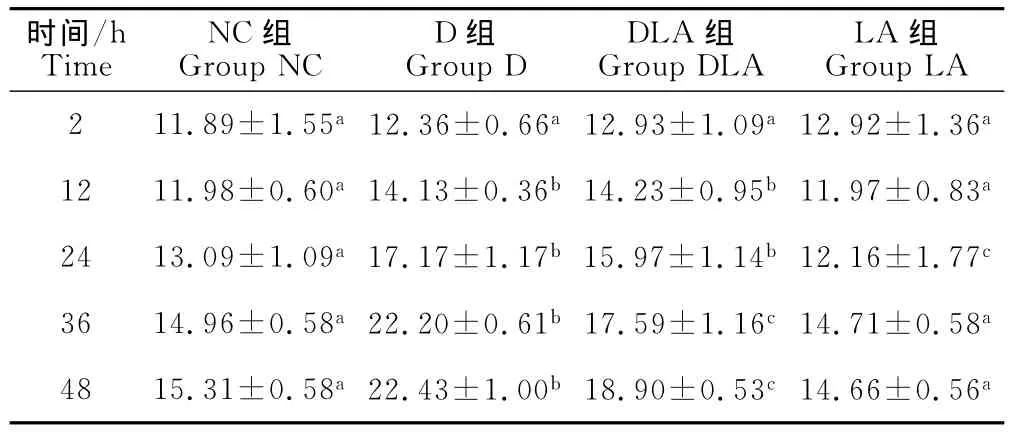
表1 Marc-145细胞内H2O2含量检测结果Table 1 The detection of H2O2in Marc-145cells mmol/L
2.2 Marc-145细胞内MDA含量的变化
结果见表2。由表2可知,在试验进行24h时,D组和DLA组细胞内MDA含量显著高于NC组和LA组细胞(P<0.05),LA组细胞内 MDA含量显著低于其他3组(P<0.05)。试验进行36h时,D组细胞内MDA含量显著高于其他3组(P<0.05);DLA组细胞内MDA含量显著低于D组,同时显著高于LA组(P<0.05);LA组细胞内 MDA含量显著低于其他3组(P<0.05)。试验进行48h时,D组细胞内MDA含量显著高于其他3组(P<0.05)。
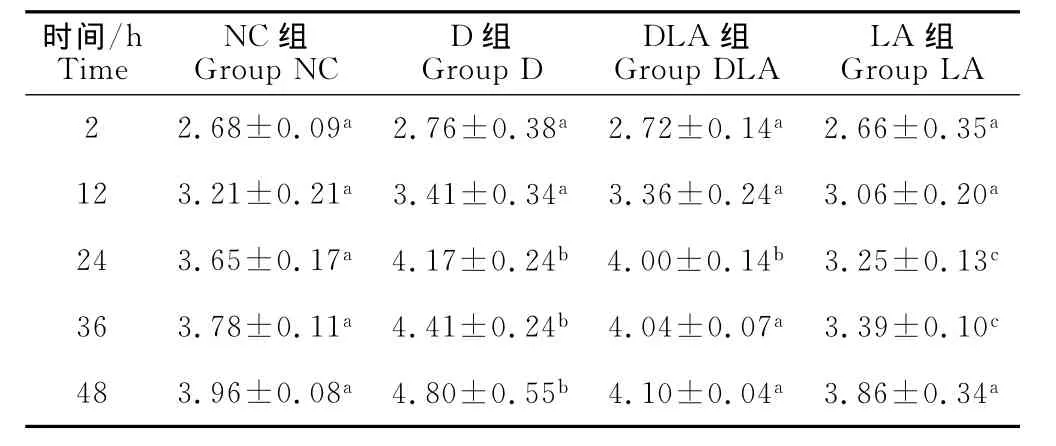
表2 Marc-145细胞内MDA含量检测结果Table 2 The detection of MDA in Marc-145cells mmol/L
2.3 Marc-145细胞内SOD活力的变化
结果见表3。由表3可知,试验12h和24h时,D组和DLA组细胞内SOD活力显著低于NC组和LA组(P<0.05)。在试验36h时,LA组细胞内SOD活力显著高于其他3组(P<0.05),D组细胞内SOD活力显著低于其他3组(P<0.05)。试验在48h时,D组细胞内SOD活力显著低于其他3组(P<0.05),DLA组细胞内SOD活力显著高于D组(P<0.05),同时显著低于其他2组(P<0.05)。

表3 Marc-145细胞内SOD活力检测结果Table 3 The detection of SOD in Marc-145cells mmol/L
2.4 Marc-145细胞内CAT活力的变化
由表4可知,在试验进行到24h时,D组细胞内CAT活力显著低于其他3组(P<0.05),LA组细胞内CAT活力显著高于其他3组(P<0.05)。试验进行到36h和48h时,D组细胞内CAT活力显著低于其他3组(P<0.05),LA组细胞内CAT活力显著高于其他3组(P<0.05),DLA组细胞内CAT活力显著低于NC组和LA组(P<0.05),同时显著高于D组(P<0.05)。

表4 Marc-145细胞内CAT活力检测结果Table 4 The detection of CAT in Marc-145cells mmol/L
3 讨论
3.1 HP-PRRSV对 Marc-145细胞抗氧化功能的影响
研究表明,病毒可以通过改变宿主细胞的氧化平衡状态,改变机体功能状态。SOD和CAT是细胞内清除自由基的重要抗氧化酶,它们能有效清除生物氧化产生的超氧阴离子自由基,并能终止自由基连锁反应,保护细胞免受损伤。H2O2作为机体内活性氧族的主要成分之一,其含量变化通常可以反映机体的氧化水平状态[7],MDA是脂质过氧化降解的主要产物,反映了体内脂质过氧化的氧化程度及细胞受自由基攻击的程度。本试验采用HPPRRSV感染Marc-145细胞,结果表明,在试验12h时,病毒组Marc-145细胞内H2O2的含量显著高于细胞对照组,SOD的活力显著低于对照组,说明HP-PRRSV感染Marc-145细胞在造成ROS积累的同时,抑制细胞抗氧化酶的活性。在试验24、36、48h时,病毒组细胞内H2O2的含量和MDA含量显著高于对照组,SOD和CAT活性显著低于对照组,说明HP-PRRSV感染Marc-145细胞后,细胞内抗氧化系统的平衡被打破,细胞内抗氧化程度超出了氧化物的清除浓度,导致细胞氧化损伤。
3.2 α-硫辛酸对 HP-PRRSV接种 Marc-145细胞后细胞氧化功能的影响
LA是一种具有很强抗氧化活性的含硫抗氧化剂。研究表明,LA能够清除出O2-、ROO·以外其他自由基和活性氧;同时LA也能够再生还原细胞内的一些抗氧化剂,如维生素E、维生素C和谷胱甘肽等,将这些抗氧化剂由氧化型转变为还原型[8]。同时LA也可以作为氧化还原反应链的阻断剂参与抗氧化过程,如与自由基中间体反应,使得活性基团无法从周围脂质中获得H,从而阻断氧化过程[9,11]。通过药物毒性试验,确定LA对Marc-145细胞的最大无毒剂量(TC0)为340μmol/L,所以本试验在此范围内向Marc-145细胞加入LA,研究其对感染HP-PRRSV的Marc-145细胞抗氧化功能的影响。结果表明,在试验24h时,DLA组细胞的CAT活性显著高于D组;同时LA组细胞CAT活性显著高于NC组,LA组细胞内H2O2和MDA含量显著少于NC组,说明LA能够显著抑制HP-PRRSV对Marc-145细胞CAT的活性的影响,同时能够显著提高Marc-145细胞CAT的活性,显著减少H2O2和MDA的生成,同时。在试验36h和48h时,DLA组细胞内H2O2和MDA含量显著低于D组,SOD和CAT活性显著高于D组;LA组细胞内CAT活性显著高于NC组,说明LA能够显著抑制HP-PRRSV对Marc-145细胞CAT、SOD的活性和H2O2和MDA生成的影响;同时能够提高 Marc-145细胞内CAT活性。由此可以看出,活性氧自由基为LA对HP-PRRSV的抑制提供了依据,LA通过提高细胞的抗氧化能力,清除细胞内ROS,减少病毒对细胞的氧化损伤。
综上所述,HP-PRRSV能够引起Marc-145细胞氧化损伤;在LA的作用下,Marc-145细胞抗氧化能力提升,ROS含量减少,脂质过氧化减弱,能够抑制HP-PRRSV对细胞的损伤。
[1]梅建国,王玉茂,王文秀,等.应用生物反应器生产高致病性猪繁殖与呼吸综合征病毒抗原[J].动物医学进展,2012,33(11):80-84.
[2]Beck M A,Handy J,Levander O A,et al.The role of oxidative stress in viral infections[J].Ann N Y Acad Sci,2000,917:906-912.
[3]杨 峰,王旭荣,田永刚,等.牛源金黄色葡萄球菌感染小鼠后药物敏感性变化及其诱导的氧化应激[J].动物医学进展,2013,34(12):46-50.
[4]Anoa Y,Sakudo A,kimataa T,et al.Oxidative damage to neurons caused by the induction of microglial NADPH oxidase in encephalomyocarditis virus infection[J].Neurosci Lett,2010,469(1):39-43.
[5]张金彦,吉绍长.药物硫辛酸的研究进展[J].现代化工,2012(5):32-34,36.
[6]Shi X L,Shi Z H,Huang H,et al.Therapeutic effect of recombinant human catalase on H1N1influenza-induced pneumonia in mince[J].Inflammation,201033(3):166-172.
[7]Moini H,Packer L,Saris N L,et al.Antioxidant and prooxidant activities ofα-lipoic acid and dihydrolipoic acid[J].Toxicology and Applied Pharmacology,2002,182(1):84-90.
[8]韩 飞,周孟良.过氧化氢诱导HepG2细胞产生氧化应激细胞模型的建立[J].食品科学,2011,32(5):55-57.
[9]张康保,高 倩,张雅静,等.镉对PC12细胞的氧化损伤及α-硫辛酸的保护效应[J].中国兽医学报,2014,34(8):1349-1352,1357.
[10]田 芳,仲伟鉴.α-硫辛酸的抗氧化和促氧化双向作用[J].环境与职业医学,2008,25(1):90-93.
[11]宋建波.α-硫辛酸、绿原酸拮抗体内氧化应激的分子机制研究[D].广东广州:西南大学,2013.

