区域性动脉灌注新辅助化疗对进展期胃癌治疗的研究
孙鑫荣等

[摘要] 目的 探讨区域性动脉灌注新辅助化疗治疗进展期胃癌的疗效。 方法 回顾性分析82例临床Ⅲ、Ⅳ期胃癌患者接受区域性动脉灌注新辅助化疗(动脉灌注化疗组,42例)和静脉新辅助化疗(静脉化疗组,40例)的疗效, 术前共2次,间隔28 d。两组均在第2次化疗后10~15 d接受手术。术后接受6个疗程的化疗。比较两组化疗毒副反应及生存率。 结果 两组化疗毒副反应无明显差异,两组中位生存期(动脉组25.3个月vs 静脉组19.1个月)、3年生存率(动脉组36.4% vs静脉组21.0%)比较差异存在统计学意义(P<0.05)。 结论 区域性动脉灌注新辅助化疗耐受性良好,有助于提高进展期胃癌患者的生存率。
[关键词] 胃癌;新辅助化疗;动脉灌注
[中图分类号] R735.2 [文献标识码] B [文章编号] 1673-9701(2015)13-0081-04
[Abstract] Objective To evaluate the effects of preoperative regional intra-arterial infusion chemotherapy for patients with advanced gastric cancer (AGC). Methods A total of 82 patients with clinical stage Ⅲ, Ⅳ gastric cancer received two cycles of neoadjuvant regional intra-arterial infusion chemotherapy (arterial infusion group, n=42) or neoadjuvant systemic chemotherapy (systemic chemotherapy group, n=40). The operation was administrated in 10 to 15 days before chemotherapy. All patients received 6 course of systemic chemotherapy after surgery. Chemotherapy toxicity and survival rate were retrospectively analyzed. Results No significant difference was found in chemotherapy toxicity between two groups. The median survival period was 25.3 months in arterial infusion group and 19.1 months in systemic chemotherapy group. 3-year survival rate was 36.4% in arterial infusion group and 21.0% in systemic chemotherapy group respectively, there were significant differences (P<0.05). Conclusion Preoperative regional intra-arterial infusion chemotherapy is well tolerated in advanced gastric cancer patients and could improve short-term survival.
[Key words] Gastric carcinoma; Neoadjuvant chemotherapy; Arterial infusion
在我国超过80%的胃癌患者就诊时即为进展期,根治性切除率低,而后续化疗等抗肿瘤治疗敏感性较差[1,2]。提高Ⅲ、Ⅳ期患者的手术切除率并延长其生存期是目前临床亟需解决的难题。随着胃癌多学科治疗模式的演变,从以往单一的手术切除进入以围手术期辅助治疗加规范化手术的新模式,新辅助化疗已成为进展期胃癌治疗的重要组成部分,但局限于化疗药物的敏感性,治疗效果仍不尽如人意。为探索给药途径对新辅助化疗疗效的影响,我院2003年1月~2007年12月对82例Ⅲ、Ⅳ期胃癌患者通过术前区域性动脉灌注化疗、新辅助静脉化疗后再手术治疗,现对比分析两组的治疗效果,报道如下。
1 资料与方法
1.1 临床资料
回顾性研究本院2003年1月~2007年12月间82例经胃镜活检病理证实为胃腺癌,且增强CT检查判断临床分期[3-5]为Ⅲ、Ⅳ期的患者,其中男60例、女22例,年龄29~77岁。所有患者术前均排除化疗禁忌证。按新辅助化疗给药途径分为:新辅助动脉灌注化疗组(动脉灌注组)42例、新辅助静脉化疗组(静脉化疗组)40例,患者不能接受新辅助化疗的退出。患者的临床资料见表1,各因素无显著差异(P>0.05)。
1.2方法
动脉灌注组:动脉灌注组选用经股动脉插管区域冲击化疗,患者术前禁食12 h,采用Seldinger法经右侧股动脉插管,导管置入腹腔动脉起始部后,用自动高压注射泵注入造影剂显示肿瘤部位及其主要供血动脉,进一步超选择插管。根据肿瘤位置选择灌注化疗的靶动脉:肿瘤位于胃窦小弯侧者选用肝总动脉和胃左动脉、位于胃体胃窦区大弯侧者选用胃十二指肠动脉、位于胃底贲门部或胃体小弯侧者选择插管至胃左动脉。静脉化疗经深静脉置管化疗。两组化疗方案均选择顺铂(江苏豪森药业股份有限公司,国药准字H20040813, 规格:6 mL:30 mg) 60 mg/m2+5-氟尿嘧啶(上海旭东海普药业有限公司,国药准字H31020593,规格:10 mL:0.25 g) 1000 mg/m2+亚叶酸钙(江苏恒瑞医药股份有限公司,国药准字H20000584,规格:10 mL:0.1g)0.2 g/m2,术前共2次,间隔28 d。化疗3 d内给予水化和利尿措施以减少毒性反应。监测血常规和肝肾功能变化。新辅助化疗2个周期后进行疗效评估,对于评估为病情进展的患者予以更改化疗方案;对于临床判断为有效的患者,化疗结束3周后行外科手术治疗。
1.3疗效及不良反应评定
所有患者完成2个周期的化疗后,予以再次增强多层螺旋CT和超声双重造影检查,并与化疗前进行对比,根据原发病灶的实体瘤疗效RECIST1.1评价标准判定疗效[6],即将新辅助化疗疗效分为:完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)、病情进展(progressive disease,PD)。临床总有效率(RR)%=(CR+PR)/可测量病例数×100%,肿瘤控制率=(CR+PR+SD)/可测量病例数×100%。化疗期间观察两组患者的不良反应,化疗毒性反应按照WHO的抗癌药物常见毒副反应分级标准分以0、Ⅰ、Ⅱ、Ⅲ 、Ⅳ度进行评估。
1.4随访
术后对所有患者进行随访,术后均接受6个周期静脉化疗。方案:顺铂60 mg/m2+5-氟尿嘧啶1000 mg/m2+亚叶酸钙0.2 g/m2,1年内者每月进行随访,1年以上者每3个月随访1次。除随访中死亡病例外所有患者均随访满3年。
1.5统计学分析
采用SPSS 18.0软件包进行统计分析,计量资料用均数±标准差(x±s)表示,采用t检验;计数资料采用χ2检验,毒副反应的等级资料(有序分类变量)采用Ridit分析,Kaplan-Meier 法分析生存曲线,P<0.05为差异有统计学意义。
2 结果
2.1 新辅助化疗不良反应
两组患者均接受2个周期的新辅助化疗,在第2次化疗后10~15 d接受胃癌根治手术。新辅助化疗不良反应均在Ⅰ~Ⅱ级,无Ⅲ级以上毒副反应,主要包括胃肠道反应、肝肾功能一过性受损、骨髓抑制等,两组差异无统计学意义(P>0.05),见表2。经对症治疗后均于手术前恢复正常。
2.2 两组患者的近期临床疗效比较
动脉灌注组42例中,临床总有效率为59.52%(25/42),肿瘤控制率为88.10%(37/42);静脉化疗组40例患者中,临床总有效率为55.00%(22/40),肿瘤控制率为67.50%(27/40)。动脉灌注组临床总有效率与静脉化疗组无明显差异(P=0.6789),动脉灌注肿瘤控制率明显高于静脉化疗组(P=0.0243),见表3。
2.3 两组患者手术疗效的比较
动脉灌注组42例中25例获得手术机会,其中22例实行D2淋巴清扫术,3例因肿瘤扩散,未行R0切除,仅行姑息切除术,D2淋巴清扫率88.00%(22/25)。静脉化疗组40例中22例获得手术机会,其中19例实行D2淋巴清扫术,3例因肿瘤扩散,未行R0切除,仅行姑息切除术,D2淋巴清扫率86.36%(19/22)。手术后组织学类型和病理学分期见表4。
2.4术后并发症
动脉灌注组并发症发生率为9.1%(2/22),分别为十二指肠残端漏和肺炎各1例,静脉化疗组并发症发生率为10.5%(2/19),分别为吻合口漏和肺部感染各1例,两组患者均无手术或住院死亡。
2.5随访结果
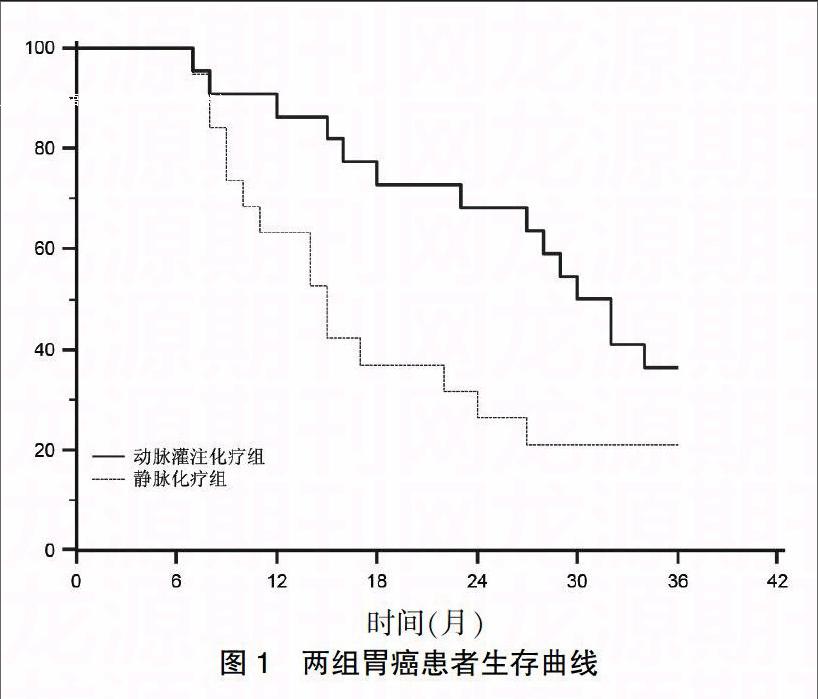
动脉灌注化疗组的中位生存期25.3个月,3年生存率为36.4%(8/22);静脉化疗组的中位生存期为19.1个月,3年生存率为21.0%(4/19)。两组患者3年生存曲线见图1,两组差异存在统计学意义(P<0.05)。
3 讨论
继1989年Wilke等首次报道新辅助化疗在进展期胃癌的应用后,有多项研究显示进展期胃癌患者接受新辅助化疗后,根治性切除率有所提高、5年生存率亦得到有效改善[7-9]。2006年MAGIC试验首次报道使用ECF方案化疗能使可切除胃癌患者降期,并增加约10%的根治性切除率,同时将5年生存率提高了13%,并相应使死亡风险降低25%,这是第一个验证新辅助化疗疗效的三期临床随机对照研究[10]。目前胃癌的外科治疗已达成共识:单纯外科手术无法达到生物学意义上的根治,新辅助化疗的目的就是控制原发灶,使肿瘤降期从而提高手术切除率,同时亦能早期治疗微转移和亚临床病灶,而对没有出现远处转移的进展期胃癌患者,即使姑息切除也能一定程度上使患者受益[11]。因此美国Sloan Kettering癌症中心认为,术前新辅助化疗已逐渐成为一种标准疗法[12]。
经动脉插管行肿瘤供血动脉灌注化疗,通过超选择插管进入胃左动脉、肝总动脉或胃十二指肠动脉等肿瘤主要供血动脉,灌注大剂量化疗药物,可在短时间内提高化疗的靶向性和肿瘤控制的效果,因此能有效克服新辅助静脉化疗药物剂量受限,但存在化疗毒副反应较大、可能影响术后的恢复等不足之处。选择性经动脉插管化疗可使肿瘤所在的局部药物浓度提高5~10倍,约2/3的药量留在靶器官内,而1/3的药量进入体循环,对全身也起一定的治疗作用[13]。本研究中所有患者均耐受2次新辅助化疗,并且在第2次化疗后10~15 d接受手术,两组的毒副反应均在可控范围的Ⅰ~Ⅱ级。在新辅助化疗毒副作用方面,动脉灌注组主要是肝功能损害的比率较静脉化疗组高,其余均较后者低,但两组差异均无统计学意义。因此,胃癌患者术前区域性动脉灌注化疗是安全可行的。
区域动脉灌注化疗具有以下优点:①局部用药减少了非靶向器官药物接触,明显减轻全身毒性反应;②大剂量联合冲击化疗,肿瘤区域药物浓度高,作用于靶向组织的时间延长,药物利用率提高,从而增强对肿瘤细胞的直接杀伤作用;③高浓度化疗药物产生血管炎性反应,影响肿瘤血供,导致肿瘤组织缺血性坏死改变,并能减少术中血运性播散;④造影剂和化疗药物经门静脉回流入肝脏,不但可以发现肝内微小转移灶并给予同期栓塞治疗,也能提高肿瘤分期的精确性,避免不必要的探查手术;⑤动脉灌注化疗后肿瘤内坏死病灶主要位于肿瘤中央的实质,围绕在血管周围,坏死率高达80%;而静脉化疗给药后肿瘤的坏死灶多位于肿瘤浅层,坏死率40%[14,15]。本组资料显示动脉灌注组的中位生存期优于静脉化疗组,动脉灌注组的1年、3年生存率亦较静脉化疗组明显提高,生存曲线显示其近期生存率优于静脉化疗组。
综上,影像学的进步使胃癌患者的术前精确分期成为可能。对Ⅲ、Ⅳ期胃癌患者行术前区域性动脉灌注化疗有助于提高近期疗效、改善患者预后;同时可以更清晰地显示肝脏等器官的转移情况,避免不必要的手术探查。
[参考文献]
[1] 邹小农,孙喜斌,陈万青,等. 2003~2007年中国胃癌发病与死亡情况分析[J]. 肿瘤,2012,32(2):109-114.
[2] Layke JC,Lopez PP. 胃癌:诊断和治疗方案的选择[J]. 中国全科医学,2015,(3): 248-249.
[3] 李国立. CT分组定位诊断法在胃癌淋巴结转移中的临床应用[J]. 消化肿瘤杂志(电子版),2009,1(1):18-20.
[4] 葛梅英,尹化斌,葛菁芳,等. 小网膜受胃癌侵犯的 CT 表现及其对病变扩散蔓延的影响研究[J]. 实用放射学杂志,2014,(5):786-789,807.
[5] 曹雷,单秀红,王亚非,等. 不同分期及部位胃癌64层螺旋 CT诊断价值比较[J]. 实用放射学杂志,2014,(5):799-803.
[6] Duffaud F,Therasse P. New guidelines to evaluate the response to treatment in solid tumors[J]. Bulletin du Cancer,2000,87(12):881-886.
[7] 宁涛,白铁成,刘文娜,等. 新辅助化疗在进展期胃癌中的研究进展[J]. 中华临床医师杂志(电子版),2013,(21): 9674-9676.
[8] Guo M,Zheng Q,zhong Di J,et al. Histological complete response to a combined docetaxel/cisplatin/fluorouracil neoadjuvant chemotherapy for T4 stage gastric adenocarcinoma[J]. World Journal of Surgical Oncology,2014,12:150.
[9] 田园,赵群. 进展期胃癌新辅助化疗的研究进展[J]. 中国处方药,2013,(4): 42-44.
[10] Cunningham D,Allum WH,Stenning SP,et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J]. The New England Journal of Medicine,2006,355(1):11-20.
[11] 季加孚,武爱文. 进展期胃癌新辅助化疗的研究进展[J].中华胃肠外科杂志,2007,10(4):394-395.
[12] Kachnic LA. Adjuvant chemoradiation for localized rectal cancer:Current trends and future directions[J]. Gastrointestinal Cancer Research,2007,1(4 Suppl 2):S64-S72.
[13] 敖劲,张跃伟. 原发性肝癌介入治疗的药代动力学研究现状[J]. 介入放射学杂志,2011,20(9):749-752.
[14] 吴晓宇,姚学权,李为苏,等. 术前区域性动脉灌注联合化疗治疗进展期胃癌的初步报告[J]. 中国普通外科杂志,2009,18(10):1022-1026.
[15] Tao HQ,Zou SC. Effect of preoperative regional artery chemotherapy on proliferation and apoptosis of gastric carcinoma cells[J]. World Journal of Gastroenterology,2002,8(3):451-454.
(收稿日期:2015-01-15)

