HPLC法测定黄牡丹不同部位中没食子酸和丹皮酚的含量*
王琳,周浓,代亨英
(大理学院药学院,大理 671000)
·药物制剂与药品质量控制·
HPLC法测定黄牡丹不同部位中没食子酸和丹皮酚的含量*
王琳,周浓,代亨英
(大理学院药学院,大理 671000)
目的 建立黄牡丹中活性成分没食子酸和丹皮酚的含量测定方法,并考察黄牡丹不同部位中没食子酸和丹皮酚的含量差异。方法 采用高效液相色谱(HPLC)法,Agilent TC-C18柱(4.6 mm×150 mm,5 μm);流动相为乙腈-0.1%磷酸溶液,梯度洗脱:0 min→25 min→45 min,乙腈0%→24%→36%,流速为0.8 mL·min-1;检测波长为274 nm;柱温为30 ℃。结果 没食子酸、丹皮酚线性范围分别为0.10~2.00 μg(r=0.999 8,n=6)、0.005 2~0.104 0 μg(r=1.000 0,n=6),平均回收率(n=9)分别为102.16%(RSD=2.51%)、97.61%(RSD=1.34%)。没食子酸在不同部位的含量分布为果实>叶>皮部> 栓皮>木部>茎;丹皮酚在不同部位的含量分布为栓皮>皮部>木部>茎,果实、叶中未检出。结论 该方法准确、简捷,为黄牡丹药材提供更合理、可靠的质量控制方法。
黄牡丹;没食子酸;丹皮酚;色谱法,高效液相
黄牡丹为毛茛科植物黄牡丹[PaeoniadelavayiFranch.var.lutea(Delavay ex Franch.) Finet et Gagnep.],其干燥根和根皮在云南省常作为中药赤芍和赤丹皮使用,具有清热凉血、活血化瘀等功效[1]。黄牡丹特产于我国云南、四川西南部及西藏东南部,是国家三级重点保护的珍稀植物[2]。黄牡丹的根皮、根、花等均有入药使用的习惯[1-4]。黄牡丹含芍药苷、丹皮酚、没食子酸、挥发油及植物甾醇等多种化学成分[4-5],其主要有效成分丹皮酚具有抗心律失常、抗缺血-再灌注性损伤、抗动脉粥样硬化、抗肿瘤、增强免疫功能、抗菌、镇痛等作用[6];没食子酸具有抗肿瘤、抗炎、抗菌、抗氧化、抗肝损伤、抗病毒等作用[7]。国内外有关黄牡丹的研究较少且不系统,仅对其系统分类、染色体、孢粉学、种子萌发、栽培与育种等方面有少量文献报道[8-9]。目前尚无特有指标成分的含量测定方法控制黄牡丹药材质量,而且各个部位有效成分的含量高低尚不明确。因此,本实验拟采用高效液相色谱(high performance liquid chromatography,HPLC)法对黄牡丹各部位中丹皮酚、没食子酸的含量测定及分析,以期为黄牡丹的内在质量评价及其开发利用提供科学依据。
1 仪器与试药
1.1 仪器 1100 LC型高效液相色谱仪(美国 Agilent 公司);KQ-250B型超声波清洗器(昆山市超声仪器有限公司);RE-2000型旋转蒸发仪(上海亚荣生化仪器厂);SHZ-Ⅲ循环水式真空泵(巩义市予华仪器有限责任公司);AE240电子分析天平[梅特勒-托利多仪器(上海)有限公司];FZ102型微型植物试样粉碎机(北京中兴伟业仪器有限公司)。
1.2 试药 丹皮酚、没食子酸对照品(中国食品药品检定研究院,批号分别为:110708-200506,110831-200803,供含量测定用);乙腈(色谱纯,德国默克试剂公司),水为娃哈哈牌纯净水,其他试剂均为国产分析纯。黄牡丹样品于2010年6月采集于云南省大理市花甸坝,并经大理学院药学院生药学教研室周浓副教授鉴定为毛茛科植物黄牡丹(Paeoniadelavayivar.lutea)的全株。
2 方法与结果
2.1 色谱条件 色谱柱:Agilent TC-C18柱(4.6 mm×150 mm,5 μm);流动相:乙腈-0.1%磷酸溶液,梯度洗脱:0 min→25 min→45 min,乙腈0%→24%→36%;检测波长:274 nm;流速:0.8 mL·min-1;柱温:30 ℃;进样量:10 μL。对照品和黄牡丹样品(1号样品)分离的色谱图见图1。
2.2 溶液的制备
2.2.1 对照品溶液的制备 取没食子酸对照品、丹皮酚对照品适量,精密称定,加甲醇制成每毫升含没食子酸100.00 μg、丹皮酚5.20 μg的混合溶液,即得。
2.2.2 供试品溶液的制备 取本品粗粉约0.20 g,精密称定,置250 mL圆底烧瓶中,加纯化水40 mL,回流提取1 h后,取出,放冷,过滤,将滤液加纯化水并定容至50 mL量瓶中,摇匀,取上清液,即得。
2.3 线性关系考察 分别精密吸取对照品溶液1,2,5,10,15,20 μL,注入液相色谱仪,得进样量C(μg)与峰面积(A)的线性方程。结果表明,没食子酸和丹皮酚进样量分别在0.10~2.00,0.005 2~0.104 0 μg与峰面积呈良好的线性关系,回归方程分别为:A=4 256.6C+3.008,r=0.999 8(n=6);A=9 687.6C+2.847 9,r=1.000 0(n=6)。
2.4 精密度实验 以混合对照品溶液连续进样6次,测定峰面积,计算没食子酸、丹皮酚的RSD分别为0.29%,0.69%,表明仪器精密度良好。
2.5 重复性实验 取同一份样品(1号样品的皮部)粉末6份,按“2.2.2”项供试品溶液的制备方法制备及“2.1”项色谱条件测定,测得没食子酸、丹皮酚的平均含量分别为10.124 8 ,0.563 2 mg·g-1,RSD分别为1.91%,2.31%(n=6),表明本方法重复性良好。
2.6 稳定性实验 取同一供试品溶液(1号样品的皮部),室温密闭放置,分别在制备后0,5,10,15,20,25 h进样,测定没食子酸、丹皮酚峰面积,RSD分别为0.24%,0.99%(n=6),表明样品溶液在25 h内稳定。
2.7 加样回收率实验 精密称取已知含量的黄牡丹药材(1号样品的皮部)约0.10 g,共9份,分别精密加入一定量的没食子酸、丹皮酚对照品,按“2.2.2”项下供试品溶液的制备方法制备及“2.1”项色谱条件测定,结果见表1。结果表明,没食子酸、丹皮酚平均回收率分别为102.16%,97.61%,RSD分别为2.51%,1.34%,符合分析要求。
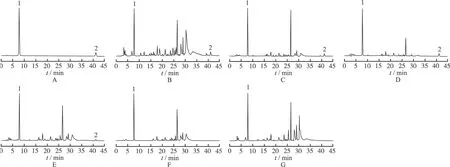
A.对照品;B.栓皮;C.皮部;D.木部;E.茎;F.叶;G.果实;1.没食子酸;2.丹皮酚
A.reference substance;B.cork periderm;C.cortex and phloem;D.xylem and pith;E.stem;F.leave;G.fruit;1.gallic acid;2.paeonol
Fig.1 HPLC chromatograms of reference substance and samples
表1 没食子酸和丹皮酚加样回收实验结果
Tab.1 Result of recovery experiment of gallic acid and paeonol

测定成分称样量/g原有量加入量测得量mg回收率/%没食子酸0.10061.01860.80001.8475103.610.10111.02360.80001.8658105.280.10011.01350.80001.8639106.300.10241.03681.00002.0634102.660.10131.02561.00002.0407101.510.10201.03271.00002.031699.890.10201.03271.20002.216998.680.10031.01551.20002.2336101.510.10151.02771.20002.227399.97丹皮酚0.10060.05670.04800.104699.790.10110.05690.04800.103897.710.10010.05640.04800.103698.330.10240.05770.06000.115496.170.10130.05710.06000.116298.500.10200.05740.06000.114795.500.10200.05740.07200.127397.080.10030.05650.07200.127398.330.10150.05720.07200.127197.08
2.8 样品含量测定 分别按“2.2.2”项下供试品溶液制备方法制备,平行3份,按“2.1”项下色谱条件测定,以峰面积分别代入回归方程中计算没食子酸、丹皮酚的含量,结果见表2。
3 讨论
供试品溶液制备方法的选择:实验中分别考察了超声提取、加热回流、索氏提取等方法的提取效果,其中,回流提取法的提取效率最高[10-12]。而回流提取法中,又分别比较不同的溶剂(重蒸水、甲醇、乙醇)、不同提取时间等提取效果,实验表明以重蒸水为提取溶剂,提取1 h可将黄牡丹中的没食子酸、丹皮酚基本提取完全。
流动相的选择:在流动相系统的选择中,实验比较甲醇-水、乙腈-水等流动相系统[11-13],从分离情况和出峰时间等综合分析选择乙腈-0.1%磷酸溶液梯度洗脱为佳,峰形对称且分离度较好,保留值适宜,柱后处理简便、省时。
检测波长的选择:用二极管阵列检测器在本实验溶剂体系条件下,分析没食子酸、丹皮酚对照品色谱峰和12个样品中目标组分相应色谱峰的紫外光谱,结果保留值相同处紫外光谱基本一致,没食子酸、丹皮酚两成分在274 nm处有最大吸收[10,13-14]。待测组分与相邻峰基本能基线分离,检测灵敏度高,因此,确定没食子酸、丹皮酚检测波长为274 nm。
本研究以没食子酸、丹皮酚为考察指标,对不同部位黄牡丹中没食子酸、丹皮酚含量的比较,没食子酸在各部位的平均含量分布状态为果实>叶>皮部> 栓皮>木部>茎,丹皮酚在各部位的平均含量分布状态为栓皮>皮部>木部>茎,果实、叶中未检出。而黄牡丹地上部分(叶、果实)的没食子酸含量远远超过传统入药部位的根,提示这些部位均可作为提取物的制备原料。黄牡丹不同部位在功用方面的差别,除受没食子酸含量的影响外,还与其他活性成分有关,值得深入研究。
黄牡丹的根皮为1996年版《云南省药品标准》收载的滇产赤丹皮[1],但丹皮酚的含量远低于正品牡丹皮的含量限度(≥12 mg·g-1)[15],所得的结论与文献[16]报道基本一致,这些滇产赤丹皮品种是否能作为“正品”牡丹皮使用,需结合药理、药效和临床应用来对其进一步的研究。
本实验采用HPLC法测定黄牡丹中没食子酸、丹皮酚的含量,具有用量少、方法快速、结果准确的特点,为黄牡丹的深入研究与开发提供参考,也为黄牡丹的质量控制研究提供理论依据。

表2 黄牡丹不同部位中没食子酸和丹皮酚的含量
不同部位没食子酸含量比较,F=131.447,P<0.01;不同部位丹皮酚含量比较,F=2 193,P<0.01;“…”表示未检出;与栓皮比较,*1P<0.01
Comparion of gallic acid among different parts,F=131.447,P<0.01;Comparion of paeonol among different parts,F=2 193,P<0.01;“…” means “undetected”;Compared with cork and periderm,*1P<0.01
[1] 云南省卫生厅.云南省药品标准(1996年版)[M].昆明: 云南大学出版社,1998: 55-56.
[2] 潘开玉.中国植物志(第27卷)[M].北京: 科学出版社,1979: 47-48.
[3] 江苏新医学院.中药大辞典(上册)[M].上海: 上海科学技术出版社,1977: 1127-1130.
[4] 王志芳,王雁,岳桦.珍稀资源——黄牡丹[J].中国城市林业,2007,5(2): 59-60.
[5] 吴少华,吴大刚,陈有为,等.紫牡丹的化学成分研究[J].中草药,2005,36(5): 648-651.
[6] 刘本臣.丹皮酚的研究进展[J].中草药,2007,38(11): 附4-6.
[7] 贾淑平,曾睿,但卫华,等.植物多酚药理作用的研究及应用[J].中国药房,2009,20(12): 953-955.
[8] 王志芳.黄牡丹种子萌发及其营养物质和内源激素的动态变化研究[D].东北林业大学,2007:1-40.
[9] 娄方芳,赵林森,李宗艳.昆明西山野生黄牡丹种子休眠与萌发特性初步研究[J].西南林学院学报,2007,27(5): 34-37.
[10] 温华珍,梁琼麟,罗国安,等.双波长HPLC法同时测定丹皮药材中的3个指标成分[J].药物分析杂志,2006,26(9): 1266-1269.
[11] 简在友,俞敬波,王文全.芍药不同部位和不同采收期6个化学活性成分含量的比较[J].药学学报,2010,45(4): 489-493.
[12] 张颖,张立木,高允升,等.高效液相色谱法测定翻白草中没食子酸含量[J].中国医院药学杂志,2006,26(3): 355-356.
[13] 王玉文,虞科,程翼宇.RP-HPLC测定牡丹皮饮片中3种活性成分的含量[J].中国中药杂志,2006,31(20): 1699-1701.
[14] 田元子,王琰,刘建祯,等.反相高效液相色谱法测定牡丹皮中2种活性成分[J].中国中药杂志,2005,30(16): 1265-1268.
[15] 国家药典委员会.中华人民共和国药典(一部)[M].北京: 中国医药科技出版社,2010: 160-161.
[16] 许舜军,李鹏,杨柳,等.牡丹皮高效液相色谱指纹图谱研究[J].中国中药杂志,2006,31(20): 1677-1680.
Determination of Gallic Acid and Paeonol in Different Medicinal Parts ofPaeoniadelavayivar.lutea by HPLC
WANG Lin, ZHOU Nong, DAI Hengying
(CollegeofPharmacy,DaliUniversity,Dali671000,China)
Objective To establish a method to assay the content and distribution of two active ingredients, gallic acid and paeonol inPaeoniadelavayivar.lutea. Methods HPLC was adopted.The chromatograph column was Agilent TC-C18 spin column (4.6 mm×150 mm, 5 μm), mobile phase was acetonitrile-0.1% phosphoric acid, and gradient elution was used.Elution condition was 0 min→25 min→45 min, the content of acetonitrile was 0%→24%→36%, the flow rate was 0.8 mL·min-1, detection wavelength was 274 nm, and column temperature was 30 ℃. Results The linear range of gallic acid and paeonol was 0.10-2.00 μg (r=0.999 8,n=6) and 0.005 2-0.104 0 μg (r=1.000 0,n=6), the average recovery was 102.16% (RSD=2.51%) and 97.61% (RSD=1.34%), respectively.The content order of gallic acid in different parts was fruit>leaf>epidermis> phelloderm>wood>stem.The content order of paeonol in different parts was phellodem>epidermis>wood>stem, but paeonol was not detected in fruits and leaves. Conclusion This method is accurate and simple, and can serve as a more reasonable and reliable quality control method for extraction ofPaeoniadelavayivar.lutea.
Paeoniadelavayivar.lutea; Gallic acid; Paeonol; Chromatography, high performance liquid
2014-01-11
2014-02-13
*国家自然科学基金资助项目(81260622)
王琳(1977-),女,回族,云南大理人,讲师,主要从事药物化学研究。电话:0872-2257420,E-mail:wanglin1025wdx@163.com。
R282.71;R927.2
B
1004-0781(2015)02-0228-04
DOI 10.3870/yydb.2015.02.024

