罗布麻叶总多酚纯化工艺及抗氧化活性研究*
石丽娟,阿布力米提·伊力,阿吉艾克拜尔·艾萨,贺飞,3,李寅庆,黄景凤
罗布麻叶总多酚纯化工艺及抗氧化活性研究*
石丽娟1,2,阿布力米提·伊力1,阿吉艾克拜尔·艾萨1,贺飞1,3,李寅庆1,2,黄景凤4
(1.中国科学院干旱区植物资源化学重点实验室、新疆特有药用资源利用省部共建国家重点实验室培育基地,乌鲁木齐 830011;2.中国科学院大学,北京 100049;3.新疆艾比湖戈宝麻有限公司,精河 833307;4.新疆阿勒泰戈宝麻有限公司,阿勒泰 836500)
目的 建立并优化罗布麻叶总多酚的纯化工艺及其抗氧化活性研究。方法 以吸附量和解吸率为指标,通过静态吸附实验,确定罗布麻叶总多酚纯化的最佳树脂;并通过动态吸附和解吸实验,对最佳吸附树脂工艺条件进行考察。结果 最佳纯化工艺条件:上样浓度6.0 mg·mL-1,吸附速率2 BV·h-1,最大上样量8 BV,除杂用水量5 BV,洗脱液为50%乙醇,洗脱流速2 BV·h-1,洗脱体积为3 BV。结论 经HPD-300大孔树脂分离纯化后,罗布麻叶总多酚纯度提高,纯化后抗氧化活性明显增加。
罗布麻;总多酚;纯化;抗氧化活性;大孔吸附树脂
罗布麻(ApocynumvenetumL.)为夹竹桃科罗布麻属多年生宿根草本植物[1],罗布麻叶作为中国传统中药,主要用于治疗肝阳眩晕、高血压、心悸失眠、神经衰弱、水肿尿少、肾炎水肿等症[2]。罗布麻叶的药用价值与其高含量的多酚类成分密切相关[3-4],罗布麻叶中的多酚类物质包括鞣质类、黄酮类、儿茶素类等含多个酚羟基的成分[5-6]。笔者参考文献报道的罗布麻叶总多酚提取工艺[7-8],采用大孔吸附树脂的方法对其总多酚成分进行纯化,并通过2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)法和1,1-二苯基-2-三硝基苯肼(DPPH)法测定其抗氧化活性,为罗布麻叶相关产品的研究开发提供一定的理论指导。
1 仪器与试药
1.1 仪器 TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);R-210型旋转蒸发仪(瑞士Buchi公司);DZF-6050B型真空干燥箱(上海齐欣科学仪器有限公司);HZQ-F160全温振荡培养箱(上海安亭科学仪器厂);ESJ180-4电子天平(沈阳龙腾电子有限公司);DZTW调温电热套(北京市永光明医疗仪器厂);艾柯超纯水机(成都康宁实验专用纯水设备厂)。
1.2 试药 罗布麻叶2012年8月采自新疆维吾尔自治区精河县,自然晾干,由南京野生植物综合利用研究院肖正春研究员鉴定为罗布麻属植物罗布麻(ApocynumvenetumL.)干燥叶;没食子酸对照品(批号:110831-200302),中国食品药品检定研究院;ABTS、DPPH、维生素C(美国Sigma公司);AB-8、HPD-100、HPD-300、HPD-450、HPD-600、HPD-750树脂(沧州宝恩吸附材料科技有限公司),X-5树脂(天津市光复精细化工研究所),D141树脂(中蓝晨光化工研究院),D101树脂(江苏苏青水处理工程集团有限公司),NKA-9树脂(南开大学化工厂);食用乙醇;钨酸钠、钼酸钠、盐酸、磷酸、硫酸锂、溴、碳酸钠,天津市河东区红岩试剂厂生产,均为分析纯。
2 方法与结果
2.1 罗布麻叶粗提液的制备 称取罗布麻干燥叶,置于圆底烧瓶中,加入50%乙醇溶液作为提取溶剂,在70 ℃条件下提取3 h,提取2次,料液比分别为1:15、1:10,过滤,合并两次滤液,45 ℃减压浓缩,回收乙醇,即得罗布麻叶粗提液,经测定粗提物总多酚纯度为19%,纯度(%)=总多酚含量/粗提物质量×100%[6-7]。
2.2 总多酚含量测定
2.2.1 最大吸收波长的选择 量取对照品溶液和供试品溶液各2.0 mL,显色后,在400~800 nm波长范围内扫描,结果对照品溶液在763 nm波长处有最大吸收,供试品溶液在760 nm波长处有最大吸收,结果见图1,选择没食子酸对照品的最大吸收波长760 nm为测定波长。
2.2.2 标准曲线制备 精密称取没食子酸对照品12.5 mg,置于50 mL 量瓶中,加水溶解并稀释至刻度,再取10 mL置于50 mL量瓶中,加水定容,摇匀,即得对照品溶液(每毫升中含没食子酸0.05 mg)。精密量取对照品溶液1,2,3,4,5 mL分别置于25 mL棕色量瓶中,各加磷钼钨酸试液1 mL,分别加水11,10,9,8,7 mL,并用饱和碳酸钠溶液稀释至刻度,摇匀,放置30 min。以相应的试剂为空白,在760 nm波长处测定吸光度,以吸光度(A)为纵坐标,浓度(C,μg·mL-1)为横坐标,得到没食子酸吸光度与质量浓度之间的回归直线方程:A=0.109 75C+0.072 82,r=0.999 4,没食子酸浓度在2.000~10.000 μg·mL-1范围呈良好线性关系。
2.2.3 供试品含量测定 精密吸取供试溶液适量置于50 mL量瓶,加水稀释至刻度。精密量取2 mL置于25 mL棕色量瓶中,加入磷钼钨酸试液1 mL,加水10 mL,饱和碳酸钠溶液定容至刻度,摇匀,放置30 min,在760 nm处测定吸光度,从标准曲线中读出供试品中没食子酸的浓度(C,μg·mL-1),计算供试液中总多酚含量。
2.2.4 精密度实验 精密量取同一供试品溶液2.0 mL,按照“2.2.3”项方法连续测定吸光度5次,RSD为1.0%。
2.2.5 稳定性实验 精密量取同一供试品溶液各2.0 mL,按照“2.2.3”项方法显色后,分别在70 min内每隔10 min在760 nm波长处测定吸光度。吸光度值随时间的变化而变化,到30 min后基本趋于稳定,结果见表1。
2.2.6 重复性实验 取同一批罗布麻叶提取物6份,按上述方法制备供试品溶液及测定吸光度,结果总多酚含量的RSD为1.2%。
2.2.7 加样回收率实验 精密称取罗布麻提取物样品9份,按照样品中没食子酸含量与没食子酸对照品加入量的比列1:0.5,1:1,1:1.5,加入没食子酸对照品,加水适量,超声(200 W,频率40 kHz)处理20 min,放冷,定容至刻度,摇匀。精密量取3 mL至25 mL量瓶中,照标准曲线制备项下的方法,依法操作,以相应试剂为空白,依法测定吸光度,计算回收率及RSD,结果平均回收率98.90%,RSD=1.50%。见表2。
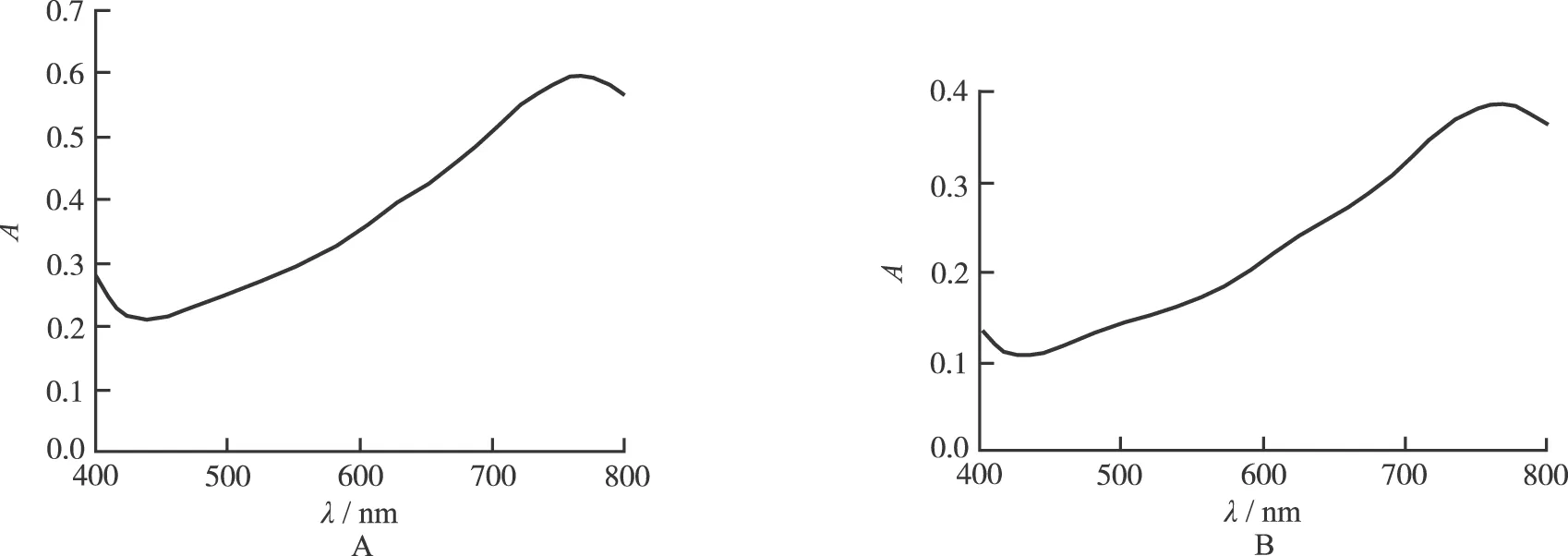
图1 样品(A)与对照品(B)的全波长扫描图
表1 不同显色时间测定吸光度值
Tab.1 Absorbance at different chromogenic time

显色时间/minA显色时间/minA100.606500.635200.629600.642300.635700.647400.633

表2 没食子酸加样回收率实验结果
2.3 大孔树脂预处理 称取一定量的大孔树脂,装于250 mL锥形瓶中,加无水乙醇浸泡20 h,使树脂充分溶胀,用乙醇淋洗至流出液与纯化水混合为无色浑浊,再用纯化水洗至无醇味,备用。
2.4 静态吸附实验
2.4.1 10种大孔树脂含水量的测定 准确称取一定量的大孔树脂,45 ℃烘箱干燥,恒重3次,计算树脂的含水量。见表3。
2.4.2 树脂吸附量与解吸率的测定 根据10种树脂的含水量,分别称取相当于干树脂1.00 g的树脂,按照“2.3”方法进行预处理。取10份8.74 mg·mL-1(C0)罗布麻叶粗提液40 mL(V1),分别加入装有不同树脂的锥形瓶中,置于摇床25 ℃、90 r·min-1振摇12 h,将树脂抽滤,得滤液Ⅰ,测其浓度(C1)。将上述吸附饱和的树脂,加50%乙醇30 mL(V2),相同条件下振摇2.5 h,抽滤,得到滤液Ⅱ,测其总多酚浓度(C2)。以吸附量和解析率为指标,考察各树脂的吸附性能。吸附量(mg·g-1)=(C0-C1) ×V1/m,解吸量(mg·g-1)=C2×V2/m,解吸率(%)=解吸量/吸附量×100%。式中:C0为粗提原液浓度(mg·mL-1),C1为吸附后剩余溶液浓度(mg·mL-1),C2洗脱液浓度(mg·mL-1),V1为粗提原液体积(mL),V2为洗脱液体积(mL),m为干树脂的质量(g)。结果见表3,综合考虑,HPD-300大孔树脂对罗布麻叶总多酚的吸附与解吸较好。
表3 10种大孔树脂的静态吸附-解吸表
Tab.3 Static adsorption and desorption rates of total polyphenols on macroporous resin
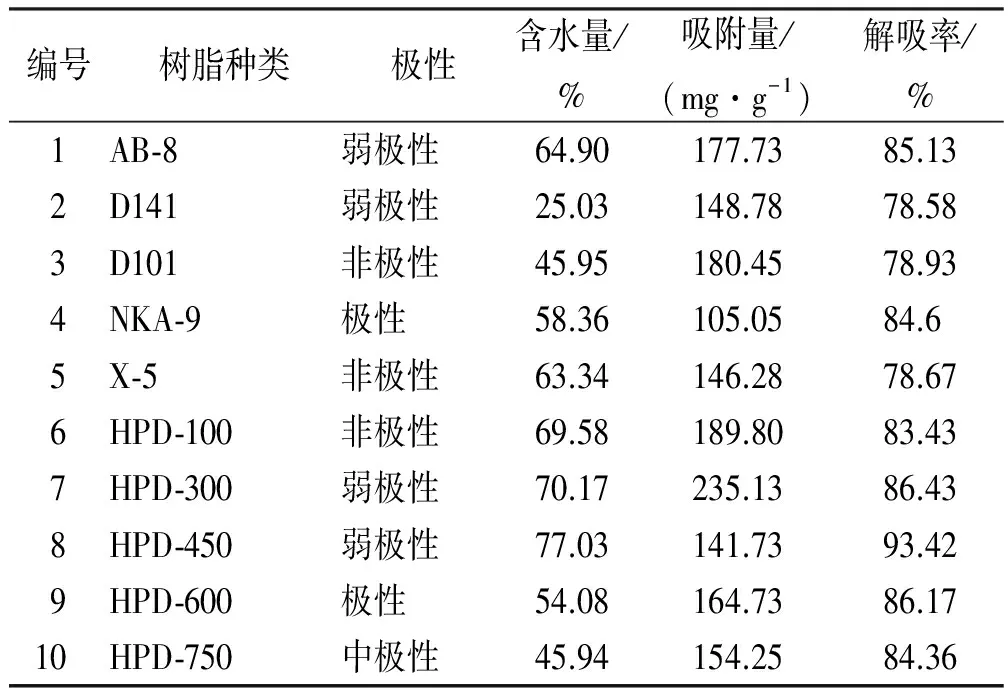
编号树脂种类极性含水量/%吸附量/(mg·g-1)解吸率/%1AB⁃8弱极性64.90177.7385.132D141弱极性25.03148.7878.583D101非极性45.95180.4578.934NKA⁃9极性58.36105.0584.65X⁃5非极性63.34146.2878.676HPD⁃100非极性69.58189.8083.437HPD⁃300弱极性70.17235.1386.438HPD⁃450弱极性77.03141.7393.429HPD⁃600极性54.08164.7386.1710HPD⁃750中极性45.94154.2584.36
2.4.3 HPD-300大孔树脂静态吸附动力学研究 准确称取HPD-300大孔树脂3.35 g(相当于干树脂1.00 g),按照“2.3”方法进行预处理。取罗布麻叶粗提液(8.74 mg·mL-1)40 mL置于锥形瓶中,置于摇床25 ℃、90 r·min-1振摇,按照20 min,40 min,1 h,2 h,3 h,4 h,6 h,9 h取样,分别测浓度,计算吸附量。由图2可知,随着时间的延长,吸附量增加,2 h后吸附量增加很少,趋于平衡,达到饱和。

图2 HPD-300大孔树脂静态吸附动力学研究
Fig.2 Kinetics of static adsorption by macroporous resin HPD-300
2.5 动态吸附和解吸实验 每次准确称HPD-300大孔树脂13.40 g(相当于干树脂4.00 g),按照“2.3”方法进行预处理,湿法装柱(柱直径为2 cm,树脂床高4 cm,柱体积BV=3.14×12×4=12.56 cm3)。动态吸附和解吸实验对上样液浓度、吸附速率、最佳上样量、水洗体积、洗脱剂、洗脱剂用量分别进行考察。
2.5.1 上样液浓度的考察 分别取4份罗布麻叶粗提液(12.43 mg·mL-1)90 mL于锥形瓶中,分别加水0,40,90,180 mL稀释,根据“2.2”法分别测定含量,计算浓度为12.43,8.62,6.04,4.06 mg·mL-1,上柱,以2 BV·h-1流速进行吸附,静置2 h,7 BV水洗,速率为5 BV·h-1,收集流出液,测定其含量,计算总多酚吸附量依次为206.06,206.77,217.17,208.51 mg·g-1。上样液浓度为6.04 mg·mL-1吸附量较高。
2.5.2 吸附速率的考察 分别取6.0 mg·mL-1罗布麻叶粗提液140 mL ,共4份,分别以1,2,3,4 BV·h-1的流速上样,静置2 h,7 BV水洗,流速为5 BV·h-1,收集流出液,测定其含量,计算总多酚吸附量依次为185.46,174.98,167.39,162.37 mg·g-1,总多酚吸附量随着上样液流速的增加而减小,吸附速率为1 BV·h-1时,总多酚吸附量最大,但考虑到1 BV·h-1可控性差,工作效率较低,而选择2 BV·h-1。
2.5.3 泄露曲线考察 分别取6.0 mg·mL-1罗布麻叶粗提液,上样流速为2 BV·h-1进行吸附,按照每次0.5 BV收集流出液,分别测定其总多酚含量,绘制泄露曲线。从图3可知,总多酚上样量从8 BV开始,泄露量明显增加,所以上样量不应超过8 BV。
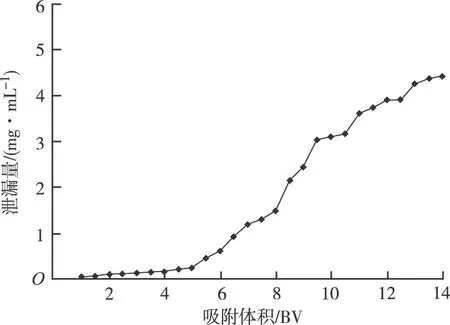
图3 总多酚泄露曲线图
2.5.4 洗脱剂的考察 分别取6.0 mg·mL-1罗布麻叶粗提液140 mL ,共5份,分别上样,上样流速为2 BV·h-1进行吸附。以流速为5 BV·h-1水洗7 BV,分别用浓度为10%,30%,50%,70%,90%乙醇洗脱,流速2 BV·h-1洗脱7 BV,收集洗脱液,分别测定其含量,计算解吸率。由表4可见,70%乙醇与50%乙醇洗脱,解吸率相差较小,从成本考虑选择50%乙醇为洗脱剂。

表4 不同浓度洗脱剂的影响
2.5.5 除杂用水量的选择 将吸附饱和的树脂柱用纯化水以5 BV·h-1的流速洗脱树脂之间未被吸附的粗提液及杂质,按照树脂柱体积的整数倍收集流出液,分别测定总多酚含量。当用水量达到5 BV时,流出液中总多酚的含量明显减少,且流出液接近无色。
2.5.6 洗脱剂用量的影响 将吸附饱和的树脂用5 BV柱体积纯化水除杂,流速为5 BV·h-1,再以50%乙醇以2 BV·h-1流速洗脱,按照树脂床体积的0.5 BV收集洗脱液,测定其含量。由图4可知,洗脱剂用量达到3 BV时,洗脱下来的总多酚含量已经很少,继续增加洗脱剂的用量,趋势基本上稳定。

图4 洗脱剂的用量的影响
2.6 抗氧化活性研究 ①ABTS法测定罗布麻叶总多酚有效部位抗氧化活性实验:将样品用纯化水溶解成10.00,8.00,6.00,4.00,2.00,1.00,0.50,0.25,0.12,0.06 mg·mL-1的溶液,各取样液16 μL于96孔板,并加入ABTS自由基溶液184 μL为样品组(At),并设3组平行;水16 μL加入ABTS自由基溶液184 μL为空白对照组(A0);16 μL样液加入184 μL水为样品对照组(Bt),200 μL水为调零组(B0),避光反应5 min后,于734 nm波长测定吸光度,用维生素C做阳性对照。根据下式计算清除率,清除率(%)=[1-(At-Bt)/(A0-B0)]×100%,并计算半数抑制浓度(IC50)值[9-10],见表5。②DPPH法测定罗布麻叶总多酚有效部位抗氧化活性实验:将样品用水溶解成1.00,0.80,0.60,0.40,0.2,0.1,0.05,0.02,0.01 mg·mL-1不同浓度的溶液,各取样液100 μL于96孔板,并加入DPPH自由基溶液100 μL为样品组(At),并设3组平行;水100 μL加入DPPH自由基溶液100 μL为空白对照组(A0);100 μL样液加入100 μL水为样品对照组(Bt),200 μL水为调零组(B0),室温避光反应30 min后,于515 nm波长测定吸光度,用维生素C做阳性对照。根据下式计算清除率,清除率(%)=[1-(At-Bt)/(A0-B0)]×100%,并计算IC50值。
结果见表5,经大孔树脂纯化后的总多酚抗氧化作用明显高于纯化前粗提物的活性,通过本研究所述方法获得的罗布麻叶总多酚有效部位具有较好的抗氧化能力。

表5 ABTS法和DPPH法测定提取物及纯化物抗氧化活性结果(IC50)
2.4 工艺验证 取等量罗布麻叶粗提液3份,按照上述优化条件实验,精制后的样液减压浓缩,45 ℃真空干燥,得到深褐色粉末,总多酚含量分别为45.93%,47.15%,46.91%,平均值为46.66%,RSD=1.38%,重复性较好,该纯化方法简单可行,可用于罗布麻叶总多酚的制备。
3 讨论
笔者通过10种大孔吸附树脂对罗布麻叶粗提液进行静态吸附实验筛选,以吸附量和解吸率为指标,确定HPD-300大孔吸附树脂对罗布麻叶总多酚具有良好的吸附与解吸性能。通过动态吸附实验确定罗布麻叶总多酚的最佳纯化工艺参数:上样浓度6.0 mg·mL-1,吸附速率2 BV·h-1,树脂最大上样量8 BV ,除杂用水量5 BV,以50%乙醇溶液作为洗脱剂,洗脱剂用量3 BV,洗脱速率2 BV·h-1,所得样品通过Folin-Ciocalteu比色法测定总多酚含量为47%,且纯化后的样品抗氧化能力明显增加。
通过对罗布麻叶总多酚纯化工艺的优化及其总多酚抗氧化活性评价,为其药理作用和保健功效更好的发挥提供了基础研究。该方法简单、可行,便于工业生产。
[1] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1977:157-158.
[2] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:196.
[3] 侯晋军,韩利文,杨官娥,等.罗布麻叶化学成分和药理活性研究进展[J].中草药,2006,37(10):1603-1605.
[4] 赵扬帆,郑宝东.植物多酚类物质及其功能学研究进展[J].福建轻纺,2006(11):107-110.
[5] 樊珍珍,热娜·卡斯木,王晓梅,等.正交实验优选罗布麻叶中总鞣质提取工艺[J].中国实验方剂学杂志,2013,19(7):13-16.
[6] 张格.罗布麻叶药理作用的研究综述[J].中国中医药咨讯,2011,3(1):44-45.
[7] 王伟,訾王贝,樊海燕,等.微波辅助提取罗布麻茶茶多酚的工艺研究[J].中国食品添加剂,2012(6):151-154.
[8] 尤努斯江·吐拉洪,吐尔洪·买买提.罗布麻叶中多酚的提取工艺和抗氧化活性的研究[J].时珍国医国药,2012,23(4):818-820.
[9] 陈奕,谢明勇,弓晓峰.黑灵芝提取物清除DPPH自由基的作用[J].天然产物研究与开发,2006,18(6):917-921.
[10] 杨少辉,宋英今,王洁华,等.雪莲果体外抗氧化和自由基清除能力[J].食品科学,2010,31(17):166-169.
Purification Process of Total Polyphenols fromApocynumVenetumL.Leaves and Its Antioxidant Activity
SHI Lijuan1,2, YILI Abulimiti1, AISA Hajiakber1, HE Fei1,3, LI Yinqing1,2, HUANG Jingfeng4
(1.KeyLaboratoryofPlantResourcesandChemistryofAridZone,StateKeyLaboratoryBasisofXinjiangIndigenousMedicinalPlantsResourceUtilization,XinjiangTechnicalInstituteofPhysicsandChemistry,ChineseAcademyofSciences,Urumqi830011,China; 2.UniversityofChineseAcademyofSciences,Beijing100049,China; 3.EbinurGaubauKender(Xinjiang)Ltd,Jinghe833307,China; 4.AletaiGaubauKender(Xinjiang)Ltd,Aletai836500,China)
Objective To investigate the purification technology and antioxidant activity of the total polyphenols from the leaves ofApocynumvenetumL.. Methods The adsorption rate and desorption rate served as detection indicators.Optimum HPD-300 resin for purification of total polyphenols was determined by static adsorption experiments.The conditions of the optimum macroporous resin were investigated through the experiment of dynamic adsorption and desorption experiment. Results The optimum conditions of purification were as follows: sample concentration was 6.0 mg·mL-1, flow rate was 2 BV·h-1and maximum solution treatment capacity was 8 BV.The eluting agent was 5 BV purified water, with the total polyphenols being desorbed by 3 BV of 50% alcohol at the flow rate 2 BV·h-1. Conclusion Under the optimum conditions mentioned above, the purity of total polyphenols shows better antioxidant effect after purification.
ApocynumvenetumL.; Total polyphenols; Purification; Antioxidant activity; Macroporous resin
2014-01-01
2014-02-25
*新疆高技术研究发展计划(201315108);中国博士后基金(2013M540785)
石丽娟(1988-),女,苗族,重庆酉阳人,硕士,从事中药及天然药物的研究与开发。电话:0991-3836733,E-mail:shiada901927@163.com。
阿吉艾克拜尔·艾萨,研究员,博士,研究方向:有机化学。电话:(0)13899892388,E-mail:haji@ms.xjb.ac.cn。
R284.2;R927.1
B
1004-0781(2015)02-0235-05
DOI 10.3870/yydb.2015.02.026

