半枝莲黄酮对β-淀粉样蛋白所致星形胶质细胞损伤的影响*
范悦,吴晓光,缪红,程建军,商亚珍
(河北省中医药抗痴呆重点研究室/承德医学院中药研究所,承德 067000)
·药物研究·
半枝莲黄酮对β-淀粉样蛋白所致星形胶质细胞损伤的影响*
范悦,吴晓光,缪红,程建军,商亚珍
(河北省中医药抗痴呆重点研究室/承德医学院中药研究所,承德 067000)
目的 探讨半枝莲黄酮(SBF)对β-淀粉样蛋白25-35(Aβ25-35)损伤星形胶质细胞的干预作用。方法 培养第3代星形胶质细胞分为空白对照组,模型对照组和半枝莲黄酮小、中、大剂量组。半枝莲黄酮小、中、大剂量组细胞分别给予17.5,35.0和70.0 μg·mL-1半枝莲黄酮作用24 h后,模型对照组和半枝莲黄酮小、中、大剂量组细胞再分别加入终浓度Aβ25-35100 μmol·L-1继续作用24 h。噻唑蓝(MTT)比色法测定细胞存活率,分光光度法测定培养液中乳酸脱氢酶(LDH)的含量,免疫组织化学方法测定细胞内LDH的合成量,酶联免疫吸附测定(ELISA)法测定培养液中细胞因子白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)的水平。结果 与空白对照组比较,模型对照组细胞存活率降低49.94%(P<0.01)。与模型对照组比较,半枝莲黄酮小、中和大剂量组细胞存活率分别提高12.50%(P<0.05),16.67%(P<0.01)和2.08%(P>0.05)。与空白对照组比较,模型对照组细胞培养上清液中LDH减少36.65%(P<0.01)。与模型对照组比较,半枝莲黄酮小、中和大剂量组LDH分别增加11.35%(P>0.05),26.40%(P<0.01)和32.44%(P<0.01)。与空白对照组比较,模型对照组星形胶质细胞LDH蛋白表达的阳性面积比例降低24.92%(P<0.05)。与模型对照组比较,半枝莲黄酮中和大剂量组LDH蛋白表达的阳性面积比例分别提高31.20%和53.60%。与空白对照组比较,模型对照组细胞培养液中IL-1β和IL-6水平分别降低23.60%和15.47%(P<0.01)。与模型对照组比较,半枝莲黄酮小、中和大剂量组IL-1β释放量分别增加5.74%(P>0.05),24.82%(P<0.01)和6.86%(P>0.05);IL-6释放量分别增加11.30%(P<0.05),17.39%(P<0.01)和3.87%(P>0.05)。结论 半枝莲黄酮对Aβ25-35引起的星形胶质细胞损伤具有保护作用,这可能有利于阐述半枝莲黄酮治疗阿尔茨海默病的作用机制。
半枝莲黄酮;阿尔茨海默病;星形胶质细胞;β-淀粉样蛋白
老年痴呆分为阿尔茨海默病(Alzheimer’s disease,AD)、血管性痴呆和混合性痴呆等,其中AD是知晓最多,也是较为普遍的一种老年痴呆症。研究发现,脑内出现β-淀粉样蛋白(β-amyloid protein,Aβ)聚集而形成的老年斑(senile plaque,SP)和tau蛋白过度磷酸化而产生的神经原纤维缠结(neurofibrillary tangles,NFT)是AD的特征性病理改变,而神经胶质细胞结构和功能的异常变化也与AD病理过程密切相关。神经胶质细胞是神经组织中除神经元以外的另一大类细胞,其中星形胶质细胞数量最多,在神经退行性疾病中承担重要角色。研究发现,Aβ由39~43个氨基酸残基组成,Aβ25-35是其主要毒性片段,对体外培养细胞及体内神经细胞均具有毒性作用[1]。而对胶质细胞的影响则随着研究进展越来越受到重视。因此,任何抑制星形胶质细胞异常变化都有利于神经退行性疾病的治疗。半枝莲(ScutellariabarbataD.Don) 为唇形科黄芩属植物,具有清热解毒、散瘀止血、利尿消肿、镇痛等功效。半枝莲黄酮(Scutellariabarbataflavonoids,SBF)是从半枝莲中提取分离的黄酮类化合物,现代药理发现其具有抗肿瘤、抗氧化和改善记忆障碍等多种药理作用[2-5]。其主要成分是野黄芩苷属黄酮类化合物,其多羟基结构具有较强还原性,对神经有保护作用,但对胶质细胞的影响笔者未见报道,笔者在本研究利用Aβ25-35损伤星形胶质细胞体外模型,探讨半枝莲黄酮通过对胶质细胞的影响发挥抗痴呆作用。
1 材料与方法
1.1 动物 新生1~3 d的斯泼累格·多雷(Sprague Dawley,SD)大鼠(合格证编号:90912),雌雄不限,河北医科大学实验动物中心提供,动物生产许可证号:SCXK(冀)2009-0111。
1.2 试剂 DMEM-F12培养液(Gibco公司,批号:8112389),胎牛血清(PAA公司,批号:715396),胰蛋白酶、噻唑蓝(Methyl thiazolyl diphenyl-tetrazolium bromide,MTT,华美生物工程有限公司,批号:BS0887),二抗试剂盒(批号:120516)、DAB显色试剂盒(批号:12196A08)购自武汉博士德生物工程有限公司,Aβ25-35(上海强耀生物科技有限公司,批号:20121205),乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(中生北控科技股份有限公司,批号:120441),白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒均购自上海索宝生物试剂公司,批号:201206,半枝莲黄酮由承德医学院中药研究所提供,紫外分光光度法测定,纯度为93.1%。
1.3 星形胶质细胞的培养 取SD大鼠双侧大脑皮质,剔除脑膜及血管,剪碎呈糊状,加入0.125%胰蛋白酶置于37 ℃、二氧化碳(CO2)培养箱中消化30 min,20%胎牛血清的培养液终止消化。离心,以5×104个·(cm2)-1接种于用0.1%多聚赖氨酸包被的培养瓶中。30 min后轻轻翻转培养瓶,吸出未贴壁的细胞悬液,重新接种于多聚赖氨酸包被的培养瓶中。培养3 d换液一次,培养约10 d细胞长满瓶底进行传代。传代第3代细胞利用免疫组化法对星形胶质细胞内特异性蛋白——星形胶质细胞酸性蛋白(glial fibrillary acidic protein,GFAP)进行细胞鉴定,结果发现传代第3代 95%细胞为星形胶质细胞。
1.4 Aβ25-35和半枝莲黄酮的配制 将Aβ25-35溶于三蒸水中过滤除菌,再与培养液混合配成200 μmol·L-1贮备液,分装-20 ℃保存,使用前需置37 ℃温箱孵育5~7 d以形成有神经毒性的聚集性Aβ25-35。半枝莲黄酮溶于培养液中,配成100 μg·mL-1贮备液,滤过除菌,分装,4 ℃保存。
1.5 Aβ25-35和半枝莲黄酮的作用 3代以上的细胞接种于96孔板内,每孔5×104个,每孔200 μL,37 ℃、CO2培养箱培养48 h后,分为空白对照组,模型对照组,半枝莲小、中、大剂量组,每组8孔,每孔均设置复孔。3个浓度药物组细胞培养液加药物终浓度为17.5,35.0和70.0 μg·mL-1,空白对照组和模型对照组细胞给予无血清培养液,培养24 h。随后除空白对照组加无血清培养液外,其余各组再加Aβ25-35使其终浓度为100 μmol·L-1,再培养24 h。
1.6 细胞存活率的测定 接种于96孔板的星形胶质细胞经半枝莲黄酮和Aβ25-35处理后,每孔加入MTT溶液200 μL,终浓度为0.5 mg·mL-1,培养4 h,弃去上清液,加入二甲亚砜(dimethyl sulfoxide,DMSO)溶液,每孔100 μL,待蓝紫色甲瓒结晶溶解后,酶标仪测定570 nm波长处的吸光度值(A)。
1.7 LDH测定
1.7.1 分光光度法测定培养液中LDH释放量 接种于96孔板的星形胶质细胞经半枝莲黄酮和Aβ25-35处理后,每孔加无血清培养液100 μL,培养24 h,吸出,分光光度法测定培养液中LDH释放量。
1.7.2 免疫组化法测定星形胶质细胞中LDH的蛋白表达 培养第3代的星形胶质细胞制作爬片细胞,48 h后半枝莲黄酮和Aβ25-35处理后,进行LDH蛋白表达的免疫组化测定,同时用磷酸盐缓冲液(phosphate buffered solution,PBS)代替一抗作阴性对照。
1.8 IL-1β和IL-6的测定 接种于96孔板的星形胶质细胞经半枝莲黄酮和Aβ25-35处理后,每孔加无血清培养液100 μL,培养24 h,吸出,4 ℃离心,小心吸取上清液,按照ELISA试剂盒说明书进行操作。
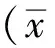
2 结果
2.1 半枝莲黄酮对细胞存活率的影响 与空白对照组比较,模型对照组细胞存活率降低49.94%(P<0.01)。与模型对照组比较,半枝莲黄酮3个浓度组细胞存活率不同程度提高,半枝莲黄酮小、中和大剂量组细胞存活率分别提高12.50%(P<0.05),16.67%(P<0.01)和2.08%(P>0.05)(表1) 。

表1 5组Aβ25-35损伤星形胶质细胞存活率
F=190.039,与空白对照组比较,*1P<0.01;与模型对照组比较,*2P<0.05,*3P<0.01
F=190.039,Compared with blank control group,*1P<0.01; compared with model control group,*2P<0.05,*3P<0.01
2.2 半枝莲黄酮对星形胶质细胞LDH的影响
2.2.1 半枝莲黄酮对星形胶质细胞培养上清液中LDH的影响 空白对照组LDH释放量为(67.99±5.19),模型对照组为(43.07±7.23),半枝莲黄酮小、中和大剂量组分别为(47.96±5.46),(54.44±5.91),(57.04±4.05),与空白对照组比较,模型对照组细胞培养上清液中LDH明显减少36.65%(P<0.01)。与模型对照组比较,半枝莲黄酮小、中和大剂量组培养上清液中LDH的量分别增加11.35%(P>0.05),26.40%(P<0.01)和32.44%(P<0.01)。
2.2.2 半枝莲黄酮对星形胶质细胞内LDH蛋白表达的影响 免疫组化结果显示,与空白对照组比较,模型对照组星形胶质细胞内棕色颗粒数量明显减少,颜色变浅,特别是纤维型星形胶质细胞表现更为明显,阳性细胞数量也明显减少。与模型对照组比较,半枝莲黄酮小剂量组没有明显改变,半枝莲黄酮中和大剂量组星形胶质细胞棕黄色颗粒变多变深,且阳性细胞数目明显增加(图1)。LDH蛋白表达的阳性面积比例测试也显示出同样的趋势。空白对照组LDH表达为(3.33±0.05),模型对照组为(2.50±0.15),半枝莲黄酮小、中和大剂量组分别为(2.51±0.20),(3.28±0.04),(3.84±0.76)。与空白对照组比较,模型对照组星形胶质细胞LDH蛋白表达的阳性面积比例降低24.92%(P<0.05)。与模型对照组比较,半枝莲黄酮小、中和大剂量组不同程度提高LDH蛋白阳性面积比例,其中半枝莲黄酮小剂量组没有明显改变,半枝莲黄酮中和大剂量组LDH蛋白表达的阳性面积比例分别提高31.20%和53.60%(P<0.05)。
2.3 半枝莲黄酮对星形胶质细胞IL-1β和IL-6释放的影响 与空白对照组比较,模型对照组细胞培养液中IL-1β和IL-6水平,分别降低了23.60%和15.47%(P<0.01)。与模型对照组比较,半枝莲黄酮小、中和大剂量组不同程度提高IL-1β和IL-6的含量,其中 IL-1β释放量分别增加5.74%(P>0.05),24.82%(P<0.01)和6.86%(P>0.05);IL-6释放量分别增加11.30%(P<0.05),17.39%(P<0.01)和3.87%(P>0.05)(表2)。
3 讨论
随着老龄化社会的到来,AD发病率呈上升趋势,严重危害人类健康,给社会和家庭都带来巨大的经济负担。一系列研究表明,Aβ25-35是诱发AD发生和发展的主要因素之一,Aβ25-35的出现早于NFT、轴索缺乏营养等病理变化以及临床表现。Aβ25-35的神经毒性涉及到复杂的分子机制,主要包括促进自由基的形成、破坏细胞内钙离子(Ca2+)稳态,降低钾离子(K+)通道功能,增强致炎因子等引起的炎症反应[6-7]。

A.空白对照组;B.模型对照组;C.半枝莲黄酮小剂量组;D.半枝莲黄酮中剂量组;E.半枝莲黄酮大剂量组
A.blank control group; B.model control group; C.low-dose SBF group; D.medium-dose SBF group;E.high-dose SBF group
Fig.1 Effect of SBF on LDH expression in Aβ25-35-injured astrocytes(DAB staining,×200)

表2 5组Aβ25-35损伤星形胶质细胞培养上清液中IL-1β、IL-6测定值
IL-1β,F=20.431;IL-6,F=7.281;与空白对照组比较,*1P<0.01;与模型对照组比较,*2P<0.05,*3P<0.01
IL-1β,F=20.431;IL-6,F=7.281;Compared with blank control group,*1P<0.01;compared with model control group,*2P<0.05,*3P<0.01
星形胶质细胞是神经胶质细胞中数量最多的一种,除了以往认识的在神经系统中有支持营养作用外,与神经元之间还存在复杂的相互作用,也与许多神经退行性疾病有密切联系。传统观点认为,Aβ主要是由神经元产生的,但新近研究表明,星形胶质细胞,特别是在激活状态下的星形胶质细胞也可以产生Aβ[8],同时星形胶质细胞可对细胞外Aβ进行内化和摄取[9],进而降解和清除细胞内外的Aβ[10],而产生的Aβ反过来又可以激活星形胶质细胞[11]。许多实验证实,不同Aβ衍生物,尤其在它们聚集状态时,对神经细胞具有毒性作用[12]。因此笔者在本实验使用经过老化处理的成为聚集状态的Aβ25-35,进行损伤星形胶质细胞。LDH 广泛存在于组织细胞内,正常细胞几乎不释放LDH,其释放量的多少可反映细胞膜的完整性,因此LDH 活性增加为细胞损伤的重要标志之一[13]。但本实验发现,与空白对照组相比,模型对照组细胞LDH释放量减少,与一般文献描述不同,故进行LDH免疫组化,结果证实100 μmol·L-1Aβ25-35能使星形胶质细胞内LDH合成量减少,这就解释释放量减少的原因,而细胞存活率降低就进一步导致培养上清液中LDH的量减少。半枝莲黄酮给药组不同程度地提高了细胞存活率,细胞内LDH的量也逐步增加,释放到细胞外的LDH也相应增多。
神经炎症是AD的特征表现之一,炎症是由星形胶质细胞和小胶质细胞释放的炎性因子介导的,这些因子参与免疫应答,诱导炎症的发生,而炎症因子在AD发病早期起着至关重要的作用[14-15]。研究发现,炎症反应对AD是一把双刃剑,首先它作为一种自身保护机制可以清除刺激物,修复组织,在精密调控下的炎症反应可以去除组织细胞碎片、有害蛋白质和受损神经元释放的毒性物质,还可杀灭入侵的病原体,阻止脑内感染和损伤的扩散[16-17],并通过分泌神经营养因子如胶质源性神经生长因子(glia-derived neurotrophic factor,GDNF)等以促进神经元的修复[18],这些作用均有利于受损神经元的存活及功能恢复,从而发挥神经保护作用。然而持续的炎症反应对机体有害,该过程中产生的炎性因子和抗炎因子会加剧Aβ25-35的产生,加速神经元的损伤,诱发AD[19]。IL-1 β可能是AD发展和演进早期病理因子,大量资料已经证实IL-1 β可以促使AD tau 蛋白病变的形成和发展,AD患者脑内 IL-1β表达水平和 tau 蛋白病变有着密切的相关性[20]。TAN等[21]用 Aβ25-35处理培养的海马神经元及人胎脑细胞,神经元最终死亡,胶质细胞增生,IL-1、 IL-6、 TNF-α等细胞因子释放增加。然而IL-1β和IL-6不仅是炎性因子,在神经系统更是作为细胞因子,由于本实验高浓度(100 μmol·L-1)Aβ25-35引起星形胶质细胞不是增生,而是数量减少,存活率降低,合成细胞因子减少,释放到胞外的量也减少,半枝莲黄酮组能不同程度地逆转这种减少趋势。本实验体外培养的为正常生理状态下的星形胶质细胞,并非在病理状态下异常活化增生的星形胶质细胞,故在Aβ25-35损伤情况下引起的是细胞数量减少而非增生,各项指标也出现了与某些报道不一致的情况。
半枝莲含有多种化学成分,主要有效成分为黄酮类化合物,其中含量最多的也是野黄芩苷,具有抗肿瘤、抗衰老和抗氧化等功效,但除了黄酮类成分,还含有生物碱、酚类和鞣质等,本实验半枝莲黄酮大剂量组的保护作用出现降低,推测为半枝莲中杂质的毒性作用,如鞣质等,这也正是中药成分多、药理作用复杂的体现。综上所述,本实验发现半枝莲黄酮在一定浓度范围内对Aβ25-35引起的损伤细胞具有保护作用。
[1] 张萌涛,钱亦华,杨杰,等.丹参酮ⅡA 对谷氨酸联合淀粉样蛋白诱导细胞损伤的保护作用[J].中国老年学杂志,2009,29(19):2465-2468.
[2] 郗玉玲,刘敏华,张晓峰,等.半枝莲黄酮对去卵巢大鼠记忆障碍的改善作用[J].中国老年学杂志,2011,31(1):242-245.
[3] 殷秀霞,张树峰,郗玉玲,等.去卵巢大鼠脑内凋亡基因蛋白表达及半枝莲黄酮的干预作用[J].中国新药杂志,2010,19(14):1255-1259.
[4] 董永彩,商亚珍.半枝莲的药理学研究进展[J].承德医学院学报,2009,26(1):98-100.
[5] 董永彩,董雅洁,龚玉芳,等.半枝莲黄酮对去卵巢大鼠血脂水平的影响[J].中国医院药学杂志,2010,30(15):1260-1263.
[6] SUTTON E T,THOMAS T,BRYANT M W,et al.Amyloid-beta peptide induced inflammatory reaction is mediated by the cytokines tumor necrosis factor and interleukin-1[J].J Submicrosc Cytol Pathol,1999,31(3):313-323.
[7] POPOVI M,CABALLERO-BLEDA M,PUELLES L,et al.Importance of immunological and inflammatory processes in the pathogenesis and therapy of Alzheimer's disease[J].Int J Neurosci,1998,95(3-4):203-236.
[8] LAIRD F M,CAI H,SAVONENKO A V,et al.BACE1,a major determinant of selective vulnerability of the brain to amyloid-beta amyloidogenesis,is essential for cognitive,emotional,and synaptic functions[J].J Neurosci,2005,25(50):11693-11709.
[9] JI B,MAEDA J,SAWADA M,et al.Imaging of peripheral benzodiazepine receptor expression as biomarkers of detrimental versus beneficial glial responses in mouse models of Alzheimer's and other CNS pathologies[J].J Neurosci,2008,28(47):12255-12267.
[10] NISHITSUJI K,HOSONO T,UCHIMURA K,et al.Lipopro-tein lipase is a novel amyloid beta(Abeta)-binding protein that promotes glycosaminoglycan-dependent cellular uptake of Abeta in astrocytes[J].J Biol Chem,2011,286(8):6393-6401.
[11] ZHAO J,O’CONNOR T,VASSAR R.The contribution of activated astrocytes to Aβ production: implications for Alzheimer's disease pathogenesis[J].J Neuroin-flammation,2011(8):150-166.
[12] PIKE C J,WALENCEWICZ-WASSERMAN A J,KOSMO-SKI J,et al.Structure-activity analyses of beta- amyloid peptides: contributions of the beta 25 region to aggregation and neurotoxicity[J].J Neurochem,1995,64(1):253-265.
[13] 蔡海瑞,刘海意,乔福元,等.缺氧对脐静脉内皮细胞损伤及可溶性血管内皮生长因子受体-1 mRNA表达的影响[J].中国妇幼保健,2009,24(11):1559-1561.
[14] LEE J W,LEE Y K,YUK D Y,et al.Neuro-inflammation induced by lipopolysaccharide causes cognitive impairment through enhancement of beta-amyloid generation[J].J Neuroinflammtion,2008,29(5):37-51.
[15] ZHOU J,FONSECA M I,PISALYAPUT K,et al.Comple-ment C3 and C4 expression in C1q sufficient and deficient mouse models of Alzheimer's disease[J].J Neurochem,2008,106(5):2080-2092.
[16] GLEZER I,SIMARD A R,RIVEST S.Neuroprotective role of the innate immune system by microglia[J].Neuroscience,2007,147(4):867-883.
[17] SIMARD A R,SOULET D,GOWING G,et al.Bone marrow-derived microglia play a critical role in restricting senile plaque formation in Alzheimer's disease[J].Neuron,2006,49(4):489-502.
[18] WYSS-CORAY T,MUCKE L.Inflammation in neurodegen-erative disease——a double-edged sword[J].Neuron,2002,35(3):419-432.
[19] HOOZEMANS J J,ROZEMULLER A J,VAN HAASTERT E S,et al.Neuroinflammation in Alzheimer’s disease wanes with age[J].J Neuroinflammation,2011(8):171-178.
[20] 蔡志友,吴芳,晏勇.星形胶质细胞与阿尔茨海默病[J].重庆医学,2009,38(6):733-735.
[21] TAN J,TOWN T,MORI T,et al.CD45 opposes beta-amy-loid peptide-induced microglial activation via inhibition of p44/42 mitogen-activated protein kinase[J].J Neurosci,2000,20(20):7587-7594.
Effect ofScutellariaBarbataFlavonoids on β-Amyloid Protein-induced Injury in Rats Astrocytes
FAN Yue, WU Xiaoguang, MIAO Hong, CHENG Jianjun, SHANG Yazhen
(HebeiProvincialKeyResearchOfficeofTraditionalChineseMedicineAgainstDementia,InstituteofTraditionalChineseMedicine,ChengdeMedicalCollege,Chengde067000,China)
Objective To study the effects of flavonoids fromScutellariaBarbataon β-amyloid protein 25-35 (Aβ25-35)-induced injury of rats’ astrocytes. Methods Rats’ astrocytes of passage 3 were divided into blank control group, model control group, small, middle and large doses (17.5, 35.0 and 70.0 μg·mL-1, respectively) ofScutellariaBarbataflavonoids groups.After treatment by 17.5, 35.0 and 70.0 μg·mL-1ofScutellariaBarbataflavonoids for 24 h, the cells of model control, small, middle and large dose groups were added with Aβ25-35(final concentration: 100 μmol·L-1) and cultured for another 24 h.MTT colorimetric method was used to measure cell viability, spectrophotometry to determine LDH content in cultured medium, immunohistochemistry to detect cellular LDH, ELISA to detect IL-1β and IL-6 levels in culture medium. Results As compared with blank control group, cell survival rate of model control group was significantly decreased by 49.94% (P<0.01).As compared with model control group, cell survival rate was increased by 12.50% (P<0.05), 16.67% (P<0.01) and 2.08% (P>0.05) in small, medium and large dose groups, respectively.As compared with blank control group, LDH of supernatant fluid was significantly decreased by 36.65% (P<0.01).As compared with model control group, LDH level was increased by 11.35% (P>0.05), 26.40% (P<0.01) and 32.44% (P<0.01) in the small, medium and large dose groups.As compared with blank control group, positive area proportion of LDH protein in astrocytes was decreased by 24.92% (P<0.05).As compared with model control group, positive area proportion of LDH protein was increased by 31.20% and 53.60% in medium and large dose groups, respectively.As compared with blank control group, IL-1β and IL-6 were significantly decreased in the model control group by 23.60% and 15.47% (P<0.01), respectively.As compared with model control group, IL-1β and IL-6 were increased in small, medium and large dose groups, and IL-1β was increased by 5.74% (P>0.05), 24.82% (P<0.01) and 6.86% (P>0.05), respectively; IL-6 was increased by 11.30% (P<0.05), 17.39% (P<0.01) and 3.87% (P>0.05), respectively. ConclusionScutellariaBarbatafalvonoids exert protective effect on Aβ25-35-induced astrocyte injury.ScutellariaBarbataflavonoids might treat Alzheimer’s disease through influencing astrocytes.
ScutellariaBarbataflavonoids; Alzheimer’s disease; Astrocytes; β-Amyloid protein
2014-01-20
2014-06-03
*河北省自然科学基金(C2009001007,H2014406048);河北省中医药管理局资助项目(05027);河北省高等学校重点学科资助项目。
范悦(1987-),女,河北邯郸人,硕士,研究方向:中药神经药理学。电话:(0)18810958701,E-mail: 616745565@qq.com。
商亚珍(1963-),女,满族,河北承德人,研究员,教授,博士,从事中药神经药理研究。电话:0314-2290616,E-mail:shangyz1018@sina.com。
R965
A
1004-0781(2015)02-0141-05

