鹅脾混合多肽对小鼠非特异性免疫功能的影响*
田强,冯香芝,杨丽敏,赵鹏伟,姚星宇
鹅脾混合多肽对小鼠非特异性免疫功能的影响*
田强1,冯香芝2,杨丽敏3,赵鹏伟3,姚星宇2
(内蒙古自治区满洲里南区医院1.检验科;2.内科,满洲里 021400;3.内蒙古医科大学基础医学院微生物与免疫教研室,呼和浩特 010059)
目的 检测从鹅脾脏提取出的相对分子质量<10 000混合多肽的含量及成分,并观察该混合多肽对小鼠体内淋巴细胞转化及腹腔巨噬细胞吞噬功能的影响。方法 采用冷冻离心透析法从鹅脾脏提取相对分子质量<10 000的混合多肽,紫外分光光度计检测多肽含量,氨基酸检测仪和原子吸收仪进行多肽成分鉴定;将上述鹅脾混合多肽分别以大、中、小剂量对昆明种小鼠进行肌内注射,并与空白对照组比较,连续给药14 d,观察小鼠淋巴细胞转化和巨噬细胞吞噬功能。结果 获得的鹅脾混合多肽提取物pH=6.1,小分子多肽含量为23.78 μg·mL-1,成分鉴定结果显示该混合物中含有10余种氨基酸及6种微量元素。混合多肽3个剂量组淋巴细胞转化率及巨噬细胞吞噬率均显著提高,与空白对照组比较差异有统计学意义(P<0.05)。毒性实验的半数致死浓度(LD50)>4 g·kg-1。结论 鹅脾混合多肽对小鼠免疫功能有明显的调节和增强作用。
鹅脾多肽;淋巴细胞;巨噬细胞;吞噬功能
研究表明,多种疾病的发生与机体免疫功能的调节有着密切关系。很多药物可以改善机体免疫抑制状态[1]。脾脏作为机体最大的外周免疫器官,与机体细胞免疫及体液免疫关系密切,是发生免疫应答和细胞免疫应答的主要场所[2-3]。笔者在本课题中利用内蒙古满洲里地区丰富的鹅废弃脾脏为研究原料,从中提取、纯化鹅脾多肽,确定多肽的成分,进行含量测定;并进行免疫药效学实验研究,探讨鹅脾多肽调节免疫功能的生物活性,以期为鹅脾多肽辅助治疗肿瘤、免疫缺陷和自身免疫性疾病奠定理论及实验基础。
1 材料与方法
1.1 动物 昆明种小鼠240只,清洁级,雌雄各半,体质量18~22 g,购自内蒙古大学动物中心,动物生产许可证号:SCXK(蒙)2005-0003。饲养于普通洁净环境,温度22~23 ℃,相对湿度40%~70%。
1.2 试药 无钙镁的Hank's(北京华迈科生物技术有限责任公司,批号:20120322)、阿氏液(天津百浩生物科技有限公司,批号:20121109)、吉姆萨染色液(上海士锋生物科技有限公司)、相对分子质量10 000的透析膜(USA-GE)、牛肉汤培养液(上海江莱生物科技有限公司)、可溶性淀粉/植物血凝素(合肥博美生物科技有限责任公司)、氨基酸标准液(日本日立公司,批号:20120126);磷酸盐缓冲液(phosphate buffered solution,PBS)、盐酸醋酸钠、醋酸、丙二醇、柠檬酸二钠等均购自天津化学试剂厂。
1.3 仪器 AUY120 电子分析天平(日本岛津公司),L-8900氨基酸自动分析仪(日立);RJ-TGL-16B台式高速离心机(常州诺基仪器有限公司);Leica-DM4000B显微镜(Olympus);TOMY-SX-700高压灭菌锅(上海科学仪器有限公司);210VGP型原子吸收光谱仪(美国BUCK公司)。
1.4 鹅脾混合多肽的提取及成分鉴定
1.4.1 鹅脾多肽的提取 把解冻的新鲜鹅脾脏用纯化水清洗干净,绞碎,用组织匀浆机破碎组织,收集匀浆,反复冻融3~5次。将脾脏匀浆1 kg加入0.9%氯化钠溶液1 000 mL,用冷冻离心机4 ℃,5 000 r·min-1(有效离心半径25 cm)离心30 min。取上清液装入相对分子质量为10 000的透析膜内,在4 ℃生化培养箱中透析24 h,收集透析膜外的透析液。该透析液即为本实验的终产物鹅脾混合多肽,经冷冻干燥后,即得多肽干粉。
1.4.2 鹅脾混合多肽中的成分鉴定
1.4.2.1 鹅脾混合多肽中的氨基酸成分鉴定 按照氨基酸分析仪设定的洗脱程序,用不同离子强度、pH的缓冲液依次将氨基酸按吸附力的不同洗脱(依次为酸性氨基酸、中性氨基酸、碱性氨基酸),被洗脱下来的氨基酸与茚三酮反应液在加热的条件下反应(135 ℃),生成可用紫外检测器在波长570,440 nm检测到的蓝紫色物质(仲氨生成浅黄色物质检测波长440 nm)外标法检测[4]。
1.4.2.2 鹅脾混合多肽中矿物元素的鉴定 采用原子吸收光谱法[5]对鹅脾多肽物混合物中矿物元素锌、钙、镁、铜、铁、钾含量进行测定。
1.5 1%鸡红细胞悬液的制备 无菌操作从鸡心脏采血,将血液加入到1:5倍阿氏液中,摇匀,4 ℃贮存。用时吸取红细胞悬液,1 500 r·min-1离心 5 min,弃去含有阿氏液的上清液;并加入5倍量灭菌PBS缓冲液pH7.0、 1 500 r·min-1离心5 min,洗涤2次,弃去上清液,然后用pH7.0的PBS缓冲液配制成浓度为1%压积红细胞悬液备用[6]。
1.6 淋巴细胞转化实验 取昆明种小鼠80只,雌雄各半,按随机数字表法将全部实验小鼠随机分为空白对照组,鹅脾混合多肽小剂量组、中剂量组和大剂量组,每组小鼠20只。鹅脾混合多肽小剂量组、中剂量组和大剂量组每天臀大肌肌内注射给药1次,0.2 mL(因本实验药物为多肽混合物,为避免口服给药后造成药物被胃蛋白酶消化而影响实验结果),分别给予鹅脾混合多肽1,10,100 mg·kg-1·d-1。空白对照组给予0.9%氯化钠溶液。连续给药16 d后,每只小鼠肌内注射植物血凝素0.4 mg·d-1,连续2 d;各组小鼠均自由进食;实验第18天分别取各组小鼠尾静脉取血,制备T淋巴细胞染色涂片,用瑞氏染色油镜下观察淋巴细胞200个,计算淋巴细胞转化率(%)[7]。
1.7 巨噬细胞吞噬实验 小鼠80只,按“1.6”项方法分组和给药。实验第16天,肌内注射后每只小鼠腹腔注射6%淀粉肉汤0.5 mL,24 h后腹腔注射1%鸡红细胞悬液1 mL,40 min后处死,并向腹腔注入无Ca2+、Mg2+的Hank's液3 mL,按摩腹腔1 min,吸取腹腔液于小试管内500 r·min-1离心5 min,取上清液涂片、晾干[7],瑞氏染色后,油镜观察,计数巨噬细胞100个,计算巨噬细胞吞噬百分率。巨噬细胞吞噬率(%)=吞噬鸡红细胞的巨噬细胞数/100个巨噬细胞×100%[6,8]。
1.8 急性毒性实验 昆明种小鼠80只,雌雄各半,按随机数字表法分为空白对照组、鹅脾混合多肽小剂量组、中剂量组和大剂量组,分别直接取鹅脾混合多肽2.0,3.0,4.0 g·kg-1经小鼠双侧后腿外侧肌内注射,每侧注射一半剂量,单次给药。给药容量25 mL·kg-1;空白对照组给予0.9%氯化钠溶液。14 d内观察死亡情况,计算半数致死量(LD50)值[6]。
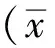
2 结果
2.1 鹅脾混合多肽的含量及成分检测 经冷冻离心透析法获得的鹅脾混合多肽提取物为澄清透明、微黄色,pH酸度计检测混合多肽pH 6.1,相对分子质量为10 000,经紫外分光光度计检测小分子多肽含量为23.78 μg·mL-1;该混合物中含有10余种氨基酸,即甘氨酸、酪氨酸、组氨酸、丙氨酸、胱氨酸、天门冬氨酸、脯氨酸、丝氨酸、精氨酸等。原子吸收仪检测到6种矿物元素,即锌、钙、镁、铜、铁、钾。
2.2 鹅脾混合多肽对小鼠淋巴细胞转化率及腹腔巨噬细胞吞噬功能的影响 鹅脾混合多肽小剂量、中剂量和大剂量组与空白对照组在小鼠淋巴细胞转化率及腹腔巨噬细胞吞噬功能的比较上差异均有统计学意义(P<0.05)。见图1。

图1 4组小鼠淋巴细胞转化率及腹腔巨噬细胞吞噬功能比较
Fig.1 Comparison of lymphocytes transformation rate and phagocytic function of peritoneal macrophages among four groups of mice
2.3 急性毒性实验结果 在观察期间内各组小鼠生长情况良好,未见消瘦、竖毛、呼吸急促、精神萎靡等中毒症状,也无死亡。实验结束处死动物,大体解剖观察未见异常。故小鼠最大耐受量(MTD)>4 g·kg-1,由此可以推测小鼠急性毒性实验的LD50>4 g·kg-1。根据急性毒性实验结果分级,鹅脾混合多肽属实际无毒物。
3 讨论
多肽类化合物广泛存在于自然界中,其中大多数具有一定的生物活性[9-10]。脾脏作为机体外周最大的免疫器官,与细胞免疫以及体液免疫均关系密切,20世纪七八十年代国内外许多实验室均开展有关动物脾脏来源的生物活性物质的理化性质及药物活性的研究[11-12]。
天然多肽的分离纯化方法要由所提取的组织材料及所要提取物质的性质决定。本实验所采用的冷冻离心透析法具有快速简便、采用相对分子质量控制质量等优点,是提取混合多肽的较理想方法。经上述方法获得的多肽混合物通过氨基酸检测仪及原子吸收仪进行成分鉴定,结果显示该混合物含有甘氨酸、酪氨酸、组氨酸等氨基酸10余种,同时含有锌、钙等矿物元素6种。
机体抵抗病原微生物感染的免疫机制主要包括非特异性免疫和特异性免疫,其中非特异性免疫(亦称固有免疫)是机体对抗病原微生物感染的第一道防线,其作用广泛,无专一性,不仅能够产生非特异抗感染免疫作用,而且在特异性免疫应答过程中也起重要作用[13]。小鼠体内淋巴细胞转化率及腹腔巨噬细胞吞噬功能则是最为常见的检测非特异性免疫功能的指标,常用于评价药物对细胞免疫功能的影响[6]。
在前期体外实验中,笔者已经采用可溶性淀粉/植物血凝素及刀豆素两种淋巴细胞激活剂进行比较,实验结果表明体外实验中两种激活剂结果差异无统计学意义[14]。体内实验中,刀豆素鼠淋巴细胞激活作用较强,从而影响关于鹅脾多肽对小鼠淋巴细胞转化作用结果的观察,故本次体内实验中只用可溶性淀粉/植物血凝素做为淋巴细胞激活剂。
本研究结果表明,鹅脾混合多肽各剂量组均可以显著提高小鼠体内淋巴细胞转化率,并且在一定浓度范围内其转化率与药物浓度呈正相关,但过高浓度的鹅脾混合多肽对小鼠淋巴细胞转化率则有抑制作用。巨噬细胞不仅参与机体的非特异性和特异性免疫反应,而且是上述两种免疫反应联系的“桥梁细胞”,在人体生理和病理过程中都发挥了重要作用[15]。
本实验结果也表明,鹅脾混合多肽能显著提高小鼠腹腔巨噬细胞的吞噬百分率。在一定限度内该鹅脾混合多肽低、中剂量能显著增强巨噬细胞吞噬鸡红细胞的能力,其吞噬能力随着多肽浓度的升高而升高,这表明鹅脾混合多肽复方能增加巨噬细胞的免疫反应,提高机体免疫力。
按照《中药药理实验方法学》中成人量换算成动物剂量的倍数简表换算[15],本实验所用最大药物剂量约为人临床拟用量的3 000倍,即直观等效剂量为人的3 000倍(小鼠对药物的耐受性为人的10倍)。本实验条件下鹅脾混合多肽的MTD>4 g·kg-1。
综上所述,本研究结果表明鹅脾混合多肽可以作为免疫调节剂,显著提高小鼠体内淋巴细胞转化率及腹腔巨噬细胞吞噬功能。其发生免疫调节作用的机制可能为本课题所采用的鹅脾混合多肽相对分子质量<10 000的混合多肽具有易与细胞膜受体结合,因此具有提高细胞免疫识别功能的作用有关;需要指出的是鹅脾混合多肽中,除检测到多种氨基酸外,同时含有锌、钙、镁等金属离子,因此该混合物也可能通过金属离子通道进入细胞内引起一系列免疫应答反应;鹅脾混合多肽还可能具有激活和增强机体非特异性免疫功能的作用,能够促进T淋巴细胞成熟并可使未致敏淋巴细胞激活成为致敏淋巴细胞,提高了淋巴细胞免疫功能,从而触发和增强机体对感染的抵抗力;还可能诱生干扰素,直接阻止病毒蛋白质的合成和复制,并能增强细胞表面抗原表达,促进自然杀伤细胞的细胞毒活性,调节淋巴细胞和巨噬细胞功能,可明显改善机体细胞免疫功能。对于其吞噬功能及增强免疫机能的机制还有待进一步研究。
[1] HUI Q,HUANG Q C,LIN T X ,et al.Lamivudine for the prevention of hepatitis B virus reactivation after high-dose chemotherapy and autologous hematopoietic stem cell transplantation for patients with advanced or relapsed non-Hodgkin's lymphoma single institution experience[J].Exp Opinion Pharma,2009,10(15):2399-2406.
[2] 郭彩霞,王志成,龚平生,等.N-乙酰半胱氨酸对糖尿病大鼠脾细胞凋亡及免疫相关因子的干预作用[J].吉林大学学报(医学版),2009,35(1):1-4.
[3] 姜洪池,乔海泉.脾脏外科学[M].沈阳:辽宁科学技术出版社,2007:3.
[4] 周文芳.血浆中氨基酸检测技术探讨[J].氨基酸和生物资源,2012,34(3):25-28.
[5] 张晓娟,江海,唐洁,等.原子吸收光谱法测定茯苓中微量元素的含量[J].光谱实验室,2010,27(2):637-638.
[6] 徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:934-935,945 -946.
[7] 柳忠辉,吕昌龙.免疫学常用实验技术[M].北京:人民卫生出版社,2007:109-122.
[8] 陈睿,姚素波,汪茜,等.风寒感冒流浸膏调节免疫功能与镇咳作用[J].医药导报,2012,31(11):1429-1431.
[9] NAVEEN K,DAKAPPAGAR I,DONNA B.et al.Prevention of mammary tumors with chimeric HER-2B-cell ePitope PePtide vaccine[J].Cancer Res,2000,60(14) : 3782-3789.
[10] FUJISAWA N,SAKAO Y,HAYASHI S,et al.Alpha-chemo-kine growth factors for adenocarcinomas ,a synthetic peptide inhibitor for alphachemokines inhibits the growth of adenocarcinoma cell lines[J].J Cancer Res Clin,2000,126(1):19.
[11] NYATI K K,PRASAD K N,RIZWAN A,et al.Lymphocyte transformation test detects a response toCampylobacterjejuniantigens in patients with Guillain-Barre syndrome[J].Med Microbiol Immunol,2010,199(2):109-116.
[12] IWASAKI A,MEDZHITOV R.Regulation of adaptive immu-nity by the innate immune system[J].Science ,2010,327(5963):291-296.
[13] 何维.医学免疫学[M].北京:人民卫生出版社,2005:333-342.
[14] 杨嗣冲,郑玲莉,叶天星.国产植物血凝素与刀豆蛋白诱生型干扰素的实验研究[J].第二军医大学学报,1983,4(1):52-54.
[15] 李仪奎.中药药理实验方法学[M].2版.上海:上海科学技术出版社,2006:721-730.
Influence of Lienal Polypeptide of Goose on Mouse Nonspecific Immunity
TIAN Qiang1,FENG Xiangzhi2, YANG Limin3, ZHAO Pengwei3, YAO Xingyu2
(1.DepartmentofClinicalLaboratory; 2.DepartmentofInternalMedicine,ManzhouliSouthernDistrictHospitalofInnerMongolia,Manzhouli021400,China; 3.DepartmentofMicrobiologyandImmunology,InnerMongoliaMedicalUniversity,Huhehot010059,China)
Objective To detect polypeptides with molecular weight less than 10 000 from the goose's spleen, and their influence on mouse lymphocyte transformation and phagocytosis of peritoneal macrophages. Methods The polypeptides with molecular weight less than 10 000 from the goose's spleen were obtained by refrigerated centrifugation dialysis method.The content of polypeptides was certified by ultraviolet spectrophotometer, amino acid detector and atomic absorption detector.The polypeptides were intramuscularly injected into Kunming mice at large, medium and small doses for 14 days.Mouse lymphocyte transformation and phagocytosis of peritoneal macrophages were observed. Results Polypeptides were obtained from the goose's spleen, pH=6.1, and content of micro-molecule polypeptide was 23.78 μg·mL-1.Component identification showed the polypeptides consisted of over 10 kinds of amino acids and 6 types of trace elements.In the three polypeptide dose groups, lymphocyte transformation and phagocytosis of peritoneal macrophages were significantly improved as compared with blank control group (P<0.05).In toxicity test, medium lethal concentration (LD50)was more than 4 g·kg-1. Conclusion Lienal polypeptides of goose can regulate and enhance mouse immunity obviously.
Lienal polypeptides of goose; Lymphocytes; Macrophages; Phagocytic function
2014-01-19
2014-06-03
*内蒙古自治区自然科学基金面上项目(2013MS11131);满洲里市科技项目(nmgmzl2013006)
田强(1969-),男,山东潍坊人,主管检验师,学士,主要从事病原微生物及免疫学检验研究。电话:(0)13514700681,E-mail:524339234@qq.com。
姚星宇(1973-),女,辽宁沈阳人,主任医师,硕士,主要从事脑血管的干细胞研究及神经免疫学研究。电话:(0)18604819979,E-mail:2412602429@qq.com。
R392.5
A
1004-0781(2015)02-0158-04

