炎症因子对心肌间质的影响及缺血后处理对其保护作用
宋 娟 李宝红 卢彦珍 宋晓亮 王 佳 冀菁荃
(长治医学院病理生理学教研室,山西 长治 046000)
炎症因子对心肌间质的影响及缺血后处理对其保护作用
宋 娟 李宝红 卢彦珍 宋晓亮1王 佳2冀菁荃
(长治医学院病理生理学教研室,山西 长治 046000)
目的 探讨缺血后处理对大鼠心脏缺血-再灌注损伤中肿瘤坏死因子(TNF)-α和白细胞介素(IL)-6的影响,及其对心肌间质和心脏功能的保护作用。方法 将24只雄性SD大鼠随机分为三组,假手术对照组(SC组,n=8)、缺血-再灌注组(I/R组,n=8)和缺血后处理组(IPTC组,n=8),结扎左冠状动脉前降支造成缺血-再灌注损伤动物模型。通过心室内插管、多导生理记录仪监测左室血流动力学变化,计算心肌组织中胶原含量变化,酶联免疫吸附试验(ELISA)试剂盒检测血浆中TNF-α和IL-6浓度改变,Western印迹检测基质金属蛋白酶(MMP)-2表达情况。结果 与SC组比较I/R组血浆TNF-α和IL-6浓度升高,同时心肌MMP-2蛋白明显升高,而心肌胶原含量下降并伴随左室心功能下降;IPTC组在血浆TNF-α和IL-6浓度明显降低的同时,心肌MMP-2蛋白也明显降低,而心肌胶原含量、左室舒缩功能明显高于I/R组。结论 IPTC对缺血-再灌注损伤心肌有保护作用,机制可能与其减少炎性介质TNF-α和IL-6的释放以抑制MMP-2的表达,从而减轻心肌间质的损伤有关。
缺血后处理;缺血-再灌注损伤;基质金属蛋白酶;白细胞介素-6;肿瘤坏死因子-α
缺血-再灌注(I/R)损伤不但损伤心肌细胞本身,同时严重损伤心肌间质,并引起组织的无菌性炎症反应〔1〕。I/R损伤的病理生理机制极为复杂,目前认为造成心肌I/R损伤的机制之一是炎症因子的过度表达〔2〕。细胞因子尤其是肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6作为重要的炎性介质在心肌I/R损伤的病理生理过程中起着重要的作用。因此防治心肌I/R损伤的有效办法除尽快恢复心肌血流的再灌注外,如何拮抗炎症因子的过度表达所造成的心肌损伤是目前研究的主要方向。有研究表明缺血后处理(IPTC)可通过抑制炎症因子释放发挥抗炎效应和心肌保护作用〔3〕,但目前的研究基本集中在对心肌细胞的保护上,前期研究结果显示,IPTC对心肌间质有保护作用〔4〕,具体是通过抑制基质金属蛋白酶(MMP)-2的活性和表达减少心肌间质的降解发挥保护作用的。但IPTC是否可通过抑制炎性反应影响心肌间质产生心肌保护作用研究较少。本实验探讨IPTC减轻炎性反应对心肌间质的影响并观察其与心肌间质和心功能的关系。
1 材料与方法
1.1 主要试剂、仪器 羊抗鼠MMP-2多克隆抗体、鼠抗小鼠β-action单克隆抗体、碱性磷酸酶标记的二抗IgG购自Santa Cruz公司, TNF-a、IL-6 ELISA试剂盒购自美国R&D公司。
1.2 动物分组 健康成年雄性SD大鼠24只,体重(250±30)g,20%的乌拉坦(1 g/kg ip)麻醉,随机分为三组:①假手术对照组(SC);②缺血-再灌注组(I/R);③缺血后处理组(IPTC),每组8只。
1.3 模型制备 动物仰卧位固定于手术台上。小动物人工呼吸机维持通气,行胸骨正中切开,以左冠状静脉主干为标志,在左心耳根部下方2 mm处进针结扎,以阻断左冠状动脉前降支,结扎20 min,然后恢复血液灌流40 min,假手术对照组除不结扎冠状动脉外,其余同I/R组。缺血后处理动物模型按Zhao等〔5〕的方法复制,即缺血完毕,灌注30 s、缺血30 s,连续3个循环,然后再灌注40 min结束实验。复制模型的可靠性用连续监视心电图Ⅱ导联的变化来判断,结扎后心电图ST段抬高,解除结扎血管复通后ST段下降1/2以上为模型成功。
1.4 方法
1.4.1 左室功能测定 20%乌拉坦(1 g/kg ip)麻醉动物,固定,颈正中切口,暴露气管及动脉,从右颈总动脉插入内充37℃肝素生理盐水PE-50软质塑料导管至左心室,接压力传感器,连接多导生理记录仪,稳定后计算机程序处理,输出左心室压力(LVP)信号,记录左心室峰压(LVSP)、左室内压上升及下降最大速率(±dp/dtmax)及Ⅱ导心电图。
1.4.2 心肌中胶原含量测定 按文献方法〔6〕,称取冻存左室心肌约100 mg,脱水、脱脂、烘干、称重,加入6 mol/L HCl 3 ml,105℃烘箱烤16 h。冷却后调pH为6,加去离子水至10 ml,5 600 r/min离心,取上清2 ml作检测。按要求配制标准管和空白管,用Beckman紫外分光光度计,波长550 nm,1 cm光径,水调零,测各管A值,计算出羟脯氨酸含量。由于羟脯氨酸在胶原中占13.4%,心肌胶原含量(mg/g干重心肌)=羟脯氨酸含量×7.46。
1.4.3 血浆血清TNF-α、IL-6测定 实验结束,处死动物前,经股动脉抽血4 ml左右,离心后收集血清贮存于-70℃冰箱内备用。严格按说明书应用双抗体夹心酶联免疫吸附试验(ELISA)法测定血清TNF-α、IL-6的浓度。
1.4.4 Western印迹测定MMP-2蛋白 取液氮冻存心肌组织匀浆、离心,分离上清得MMP-2 提取液,采用考马斯亮蓝法进行蛋白质定量,以20 μg蛋白/泳道上样于8%SDS 聚丙烯酰胺凝胶上电泳后,电转膜至PVDF膜上。室温封闭3 h,加一抗,室温孵育2 h,洗涤后,加二抗,室温孵育2 h,洗涤后,显色,待蛋白条带显色清晰时,拍摄照片,记录实验结果。
1.5 统计学方法 采用SPSS14.0软件包进行单因素方差分析及q检验。
2 结 果
2.1 IPTC对心肌I/R损伤时心脏动力学参数的影响 与SC组相比较,I/R组LVSP、±dp/dtmax均下降,两者相比有显著差异(P<0.01);IPTC组三项指标显著改善(P<0.05)。见表1。
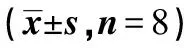
表1 IPTC对心肌I/R损伤大鼠心脏动力学参数的影响
与SC组比较:1)P<0.01;与I/R组比较:2)P<0.05,3)P<0.01
2.2 大鼠心肌胶原含量和血浆TNF-α、IL-6含量的变化 与SC组相比较,I/R组血浆TNF-α、IL-6含量显著升高,心肌胶原含量明显减少(P<0.01)。与I/R组相比,IPTC组心肌胶原含量明显升高,而血浆TNF-α、IL-6含量明显降低(P<0.01)。见表2。
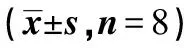
表2 各组心肌胶原含量和血浆TNF-α、IL-6含量的变化
与SC组比较:1)P<0.01;与I/R组比较:2)P<0.01
2.3 Western印迹测定MMP-2表达结果 如图1所示,在SC组,MMP-2有一定程度的表达,缺血20 min再灌注40 min后,心肌组织中MMP-2表达较SC组明显升高。而缺血后,灌注30 s、缺血30 s,连续3个循环,然后再灌注40 min的IPTC组MMP-2的表达较I/R组明显降低。
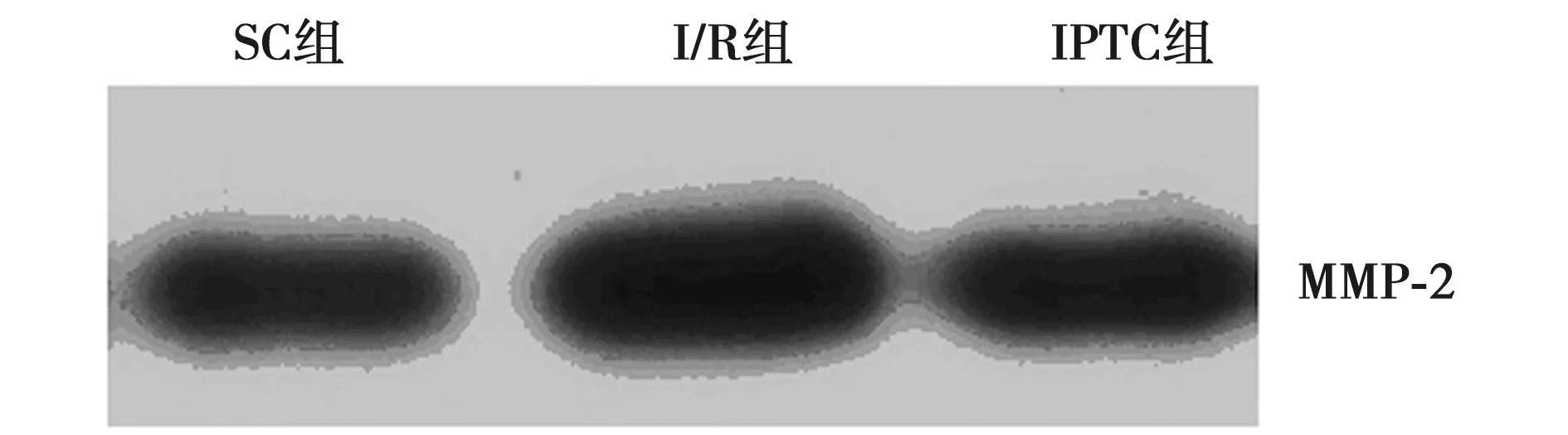
图1 Western印迹检测心肌MMP-2的表达
3 讨 论
心脏功能的正常运转不仅依赖于心肌细胞,很大程度上也取决于组成心脏的非心肌细胞结构、功能的正常与否。构成心脏的非心肌细胞占心脏细胞总数的60%以上,所以心脏功能障碍不仅表现为心肌细胞的坏死、凋亡、肥大等,也与细胞外间质的状态密切相关。近年来,IPTC对心肌I/R损伤的保护作用越来越多地受到大家的关注,IPTC即于完全再灌注之前给予组织多次短暂I/R的过程,以提高组织的适应性。但是对于IPTC保护心脏功能的机制研究多集中于心肌细胞本身,对细胞外基质的研究较少。本实验研究发现,缺血20 min再灌注40 min使心肌羟脯氨酸含量明显减少,而IPTC组心肌羟脯氨酸含量明显升高。由于羟脯氨酸在胶原中占13.4%,组织羟脯氨酸含量的测定是衡量机体胶原代谢的重要指标,从羟脯氨酸含量可推知胶原的含量。即IPTC组动物心肌胶原含量明显升高。与此同时I/R组LVSP、±dp/dtmax均明显低于SC组,而IPTC组三项指标明显改善,提示缺血后处理可能通过增加心肌间质胶原含量发挥保护心肌、提高心功能的作用。
MMPs是一组降解细胞外基质的钙离子和锌离子依赖的金属蛋白内切酶家族,对细胞外基质(ECM)有较高亲和力,是ECM降解的主要介质〔7〕。有研究表明, MMPs特别是MMP-2在I/R损伤导致的急性心功能障碍发生时能迅速影响心肌功能〔8〕, 在充血性心力衰竭患者血清中MMP-2浓度显著升高,且随着心衰程度的加重而升高〔9〕。正常心肌中,MMPs表达水平相对较低,在一些病理情况下,如炎症因子TNF-α、IL-1β、IL-6、IL-8的刺激下可诱导其基因转录活性增强,导致其表达增加〔10〕。在众多的炎性介质中, IL-6和TNF-α是较为公认的促进炎症发展的细胞因子。且有研究证实IL-6能够调节MMP-2和MMP-9的表达〔11〕。本实验中观察到,缺血20 min再灌注40 min后,血浆TNF-α、IL-6含量明显升高的同时Western印迹结果提示在I/R过程中,有炎症因子的大量释放,导致心肌MMPs激活,从而降解心肌胶原蛋白导致心功能下降。IPTC的心肌保护作用可能在于影响了炎症因子的释放,减弱了MMPs的活化,从而减少了心肌ECM的降解以发挥保护心脏的功能。
本研究表明,IPTC在发挥保护心肌保护作用时,不仅是在心肌细胞层面,而且对细胞外基质的保护也是其重要的机制之一。通过减少炎症因子的释放抑制MMP-2的活性,从而减轻心肌间质的损伤,是IPTC发挥心肌保护作用的重要途径之一。
1 Kawaguchi M,Takahashi M,Hata T,etal. Inflammasome activation of cardiac fibroblasts is essential for myocardial ischemia/reperfusion injury〔J〕.Circulation,2011;123(6):594-604.
2 Sleffens S,Montecucco F,Mach F.The inflammatory response as a target to reduce myocardial ischaemia and reperfusion injury〔J〕.Thromb Haemost,2009;102(2):240-7.
3 Xiong J,Wang Q,Xue FS,etal.Comparison of cardioprotective and anti-inflammatory effects of ischemia pre- and postconditioning in rats with myocardial ischemia-reperfusion injury〔J〕.Inflamm Res,2011;60(6):547-54.
4 卢彦珍,张翠英,王 佳,等.缺血后处理对缺血再灌注大鼠心肌间质的保护作用〔J〕.长治医学院学报,2011;25(3):164-7.
5 Zhao ZQ,Corvera JS,Halkos ME,etal.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning〔J〕.Am J Physiol Heart Circ Physiol,2003;285(2):579-88.
6 Chiariello M,Ambrosio G,Cappelli-Bigazzi M,etal.A biochemical method for the quantitation of myocardial scarring after experimental coronary artery occlusion〔J〕.J Mol Cell Cardiol,1986;18(3):283-90.
7 Lee RT,Lammerding J.Signaling pathways that influence extracellular remodeling〔J〕.J Card Fail,2002;8(6):S339-43.
8 Jacob-Ferreira AL,Schulz R. Activation of intracellular matrix metalloproteinase-2 by reactive oxygen-nitrogen species:consequences and therapeutic strategies in the heart〔J〕. Arch Biochem Biophys,2013;540(1-2):82-93.
9 董兆强,鹿庆华,郝 林,等.充血性心力衰竭患者血清基质金属蛋白酶-2浓度的变化及其临床意义〔J〕.中国老年学杂志,2007;27(6):548-50.
10 Liu XY,Zhang SM.After cerebral ischemia reperfusion in rats and the expression of MMP-9 and E—selectin synthetic intervention effect 〔J〕.Chin J Clin Neurosci,2010;18(2):119-25.
11 Sun W,Liu DB,Li WW,etal.Interleukin-6 promotes the migration and invasion of nasopharyngeal carcinoma cell lines and upregulates the expression of MMP-2 and MMP-9〔J〕.Int J Oncol,2014;44(5):1551-60.
〔2014-03-17修回〕
(编辑 安冉冉/曹梦园)
山西省自然科学基金资助项目(No.2009011055);山西省2013年国家级大学生创新创业训练计划资助项目(No.2013083)
卢彦珍(1957-),女,教授,主要从事心血管保护机制的研究。
宋 娟(1980-),女,硕士,讲师,主要从事心血管保护及炎症发病机制的研究。
R541
A
1005-9202(2015)12-3209-03;
10.3969/j.issn.1005-9202.2015.12.010
1 长治医学院药理学教研室 2 长治医学院免疫学教研室

