固相萃取超高效液相色谱荧光法检测植物油中苯并[a]芘
冯寅洁, 乔勇升, 陈伟, 冯成玉, 应铁进
(1.江苏省泰州市食品药品检验所,江苏 泰州 225300;2.江苏省海安县农业委员会,江苏 海安 226600; 3.浙江大学生物系统工程与食品科学学院食品科学与营养系,杭州 310058)

冯寅洁1, 乔勇升1, 陈伟1, 冯成玉2, 应铁进3
(1.江苏省泰州市食品药品检验所,江苏 泰州 225300;2.江苏省海安县农业委员会,江苏 海安 226600; 3.浙江大学生物系统工程与食品科学学院食品科学与营养系,杭州 310058)
为建立固相萃取-超高效液相色谱大体积流通池荧光法检测植物油中苯并[a]芘(benzo [a] pyrene, BaP)的方法,对4种商业化固相萃取柱净化油样和富集BaP的效果进行评价,同时比较了4种超高效液相色谱柱的分离效果。结果表明:借助商业化BaP专用固相萃取柱处理样品,洗脱液旋蒸至干后用乙腈-四氢呋喃(体积比为9∶1)溶解定容,经过BEH Shield RP18柱(50 mm×2.1 mm, 1.7 μm)分离,流动相为乙腈-水(体积比为70∶30),流速0.4 mL/min,BaP在0.101~10.1 μg/L范围内有良好的线性关系(r>0.999 993),检出限为0.2 μg/kg;商业化固相萃取柱能较好地除去样品中的油和吸附BaP,4种固相萃取柱的3个加标水平的回收率为91.0%~106.9%,相对标准偏差为1.4%~9.6% (n=6);用超高效液相色谱法分析样品,速度比高效液相色谱快3倍。与国标相比,该方法具有操作简便、重复性好、灵敏度高、节省溶剂等优越性,可快速、准确地对植物油中的BaP进行定性和定量检测。
植物油; 苯并[a]芘; 固相萃取柱; 超高效液相色谱; 色谱柱
Summary Benzo [a] pyrene (BaP) is a kind of polycyclic aromatic hydrocarbon, which is recognized as one of the three major carcinogens found in foods. The source of BaP detected in vegetable oil are as follows: BaP may occur when oilseeds are dried, smoked and stir-fried; organic solvents used in the leaching process may have polycyclic aromatic hydrocarbons; oil heated over temperature or overtime in the process of production and cooking may produce BaP. The recommended national method for BaP determination in animal and vegetable fats and oils (GB/T 22509—2008) requires high experimental skills and long test time, making it difficult to guarantee the accuracy and repeatability of results. Besides, another standard on determination of BaP in foods (GB/T 5009.27—2003) is also complicated in sample pretreatment.
In this study, a method for the determination of BaP in vegetable oil by solid phase extraction-ultra performance liquid chromatography-fluorescence detector (SPE-UPLC-FLD) with a large volume flow cell was established. Oil samples were purified by four kinds of commercial solid phase extraction cartridges to compare extraction effects. Besides, the four types of chromatographic columns used in UPLC were tested to analyze separation effects. Samples were cleaned and enriched by commercial solid phase extraction cartridges. Then, the elution was dried by rotary evaporation and then was dissolved with acetonitrile-tetrahydrofuran (volume ratio, 9∶1) to a constant volume. Sample solution was separated by BEH Shield RP18 column (50 mm×2.1 mm, 1.7 μm) with the mobile phase of acetonitrile-water (volume ratio, 70∶30) at the flow rate of 0.4 mL/min.
Results showed that under the optimized conditions, a good linear relationship (r>0.999 993) was obtained in the range of 0.101-10.1 μg/L Bap, with detection limit of 0.2 μg/kg. Recovery rates for four kinds of solid phase extraction cartridges were 91.0%-106.9% in three spike levels, and relative standard deviations (RSD) were 1.4%-9.6% (n=6). Sample analysis by UPLC was three times faster than HPLC.
In conclusion, this method has many advantages such as simple pretreatment, good repeatability, high sensitivity, less solvent and so on, thus can be applied on the rapid qualitative analysis and accurate quantitative detection of BaP in vegetable oil.
苯并[a]芘(benzo [a] pyrene, BaP)是一种多环芳烃,分子结构式如图1所示。其溶于非极性和弱极性溶剂如苯、正己烷、甲苯等,微溶于极性溶剂如甲醇、乙醇、乙腈,是世界上公认的可在食品中产生的三大致癌物之一,可通过呼吸、接触和摄入等方式进入人体,诱导基因突变,使细胞失去正常功能,容易导致皮肤癌、肺癌、上消化道肿瘤、动脉硬化等疾病[1]。
研究认为,BaP是由煤炭、石油、天然气、木材等不完全燃烧产生的[2],在工业“三废”中普遍存在。很多日常接触的食品中也含有BaP,如谷物等粮食制品在露天晾晒时可能受到沥青路面等外界环境引入的BaP污染,含油较多的食品在熏制、碳烤、煎炸过程中均有可能产生BaP。植物油中含BaP的主要原因包括:油料在晒干、烟熏、炒制过程中可产生BaP;用溶剂浸出法制油时,所用溶剂中含有多环芳烃;油受热温度过高和时间较长时可生成BaP。GB 2762—2012规定了谷物及其制品、熏烤水产品及肉制品、油脂及其制品中BaP的限量[3],其中,油脂及其制品BaP限量值为10 μg/kg,其余为5.0 μg/kg。
现有检测BaP的方法有荧光分光光度法[4]、气相色谱-质谱法[5]、高效液相色谱-质谱法[6]等,其中高效液相色谱-荧光法为常用检测方法。参考GB/T 22509—2008检测动植物油脂中BaP的方法[7],需要先自行处理中性氧化铝至相应活度,再填装层析柱,对操作者的实验技能要求较高、步骤复杂、试验时间长、难以保证结果的准确性和重现性,使得BaP这种强制性检测项目难以在广大实验室推广。本试验在前处理过程中改用商业化BaP专用固相萃取柱,省去了制备固相萃取柱的过程,整个操作过程简单,既能保证处理效果的准确性和再现性,又能满足批量同步处理的要求;同时,借助超高效液相色谱法(ultra performance liquid chromatography, UPLC)进行分析,配套色谱柱粒径仅为1.7 μm,比高效液相色谱(high performance liquid chromatography, HPLC)常用的色谱柱粒径(5 μm)更小、填充更紧实,具有出峰快、灵敏度高、分离度好等优点,可从基质复杂的食品中分离出目标峰,并大大缩短样品运行时间;荧光检测器采用大体积流通池(13 μL),有助于对食品中含量甚微的BaP进行更准确的定量。
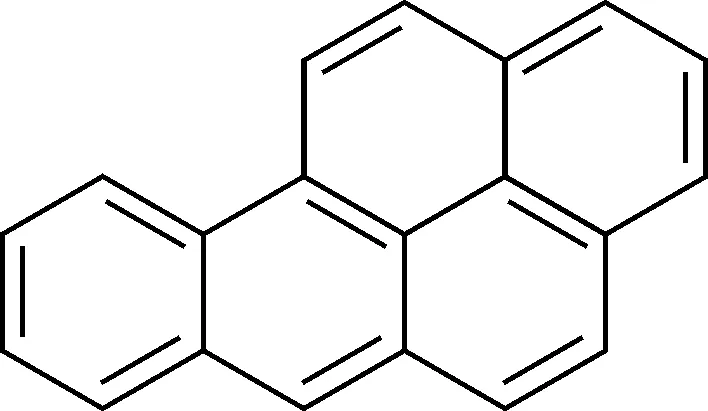
图1 苯并[a]芘结构式
1 材料与方法
1.1 仪器与试剂
超高效液相色谱仪:美国Waters公司ACQUITY超高效液相色谱仪配大体积流通池荧光检测器;液相色谱柱:美国Waters公司BEH苯基柱(50 mm×2.1 mm,1.7 μm)、HSS T3柱(50 mm×2.1 mm,1.7 μm)、BEH C18柱(100 mm×2.1 mm,1.7 μm)、BEH Shield RP18柱(50 mm×2.1 mm,1.7 μm);AL 204电子天平(上海梅特勒-托利多仪器有限公司);Milli-Q Advantage A10超纯水机(美国Millipore公司);IKA VORTEX 3旋涡混匀器(上海莱贝科学仪器有限公司);R201BL旋转蒸发器(上海申生科技有限公司);A柱:CNW苯并芘专用柱(500 mg/6 mL,上海安谱科学仪器有限公司);B柱:Cleanert BaP-3 固相萃取柱(500 mg/6 mL,天津博纳艾杰尔科技有限公司);C柱:HiCapt-Benzo苯并芘专用柱(500 mg/3 mL,武汉维泰克科技有限公司);D柱:ProElut BaP 植物油苯并芘专用固相萃取柱(22 g/60 mL,美国Dikma公司)。
大豆油(某粮油企业提供);苯并(a)芘标准溶液(5.05 μg/mL,GBW(E)080476,甲醇介质,中国计量科学研究院提供);乙腈,正己烷,异丙醇(色谱纯,美国Dikma公司);二氯甲烷,丙酮,四氢呋喃(分析纯,购自国药集团化学试剂有限公司)。
1.2 样品前处理
称取大豆油0.3 g,参考各固相萃取柱的操作方法进行净化处理,收集洗脱液,在40 ℃水浴中旋蒸至干,立即准确加入1 mL乙腈-四氢呋喃(体积比为9∶1)溶液溶解,样液过0.22 μm微孔滤膜,待测。
1.3 苯并(a)芘标准液配制
标准曲线:用乙腈稀释苯并(a)芘标准溶液,配成质量浓度分别为0.101、0.505、1.01、5.05和10.1 μg/L的标准使用液系列。
固相萃取(solid phase extraction, SPE)加标溶液:用正己烷稀释苯并(a)芘标准溶液至10.1 μg/L。
1.4 液相色谱条件
色谱柱:BEH Shield RP18柱(50 mm×2.1 mm,1.7 μm);柱温:30 ℃;流动相:乙腈-水(体积比为70∶30);流速:0.4 mL/min;进样量:5 μL;荧光检测器:λex=384 nm,λem=406 nm。
2 结果与分析
2.1 色谱柱分离效果比较
大豆油经过A柱净化等前处理后,分别用BEH苯基、HSS T3、BEH C18和BEH Shield RP18等4种色谱柱分离,调节流动相乙腈和水的比例,流速均设为0.4 mL/min,使BaP色谱峰与前后杂质峰分开。各色谱柱分离样品所得色谱图和对应流动相条件如图2~5所示,BaP峰面积依次为141 604 μV·s、147 674 μV·s、137 480 μV·s、145 323 μV·s。与其他3种色谱柱相比,BEH苯基柱分离0.505 μg/L BaP,色谱峰不对称且峰顶出现分叉,表明该柱保留效果不理想。不断调节流动相比例,T3柱分离的BaP在色谱峰前始终有小杂峰干扰,影响了积分的准确性。
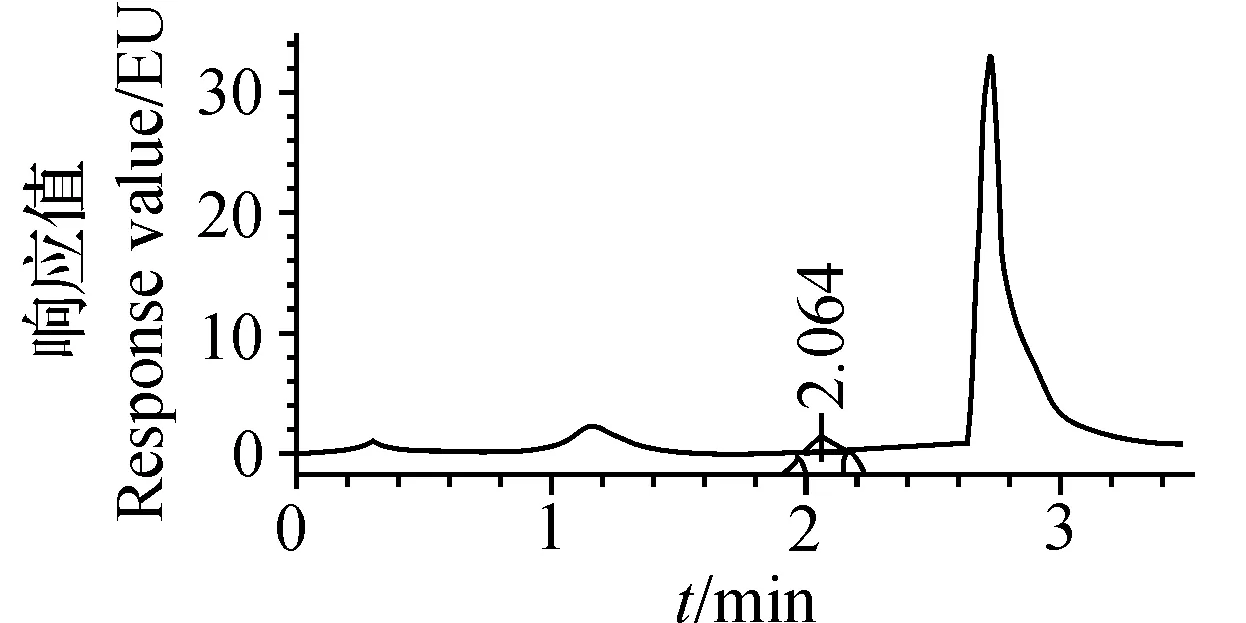
V(乙腈)∶V(水)=60∶40. V(acetonitrile)∶V(water)=60∶40。
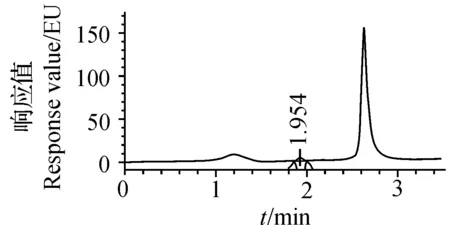
V(乙腈)∶V(水)=70∶30. V(acetonitrile)∶V(water)=70∶30.

V(乙腈)∶V(水)=88∶12. V(acetonitrile)∶V(water)=88∶12.

V(乙腈)∶V(水)=70∶30.V(acetonitrile)∶V(water)=70∶30.
2.2 进样重复性
选择C18柱和RP18柱分别重复进0.505 μg/L BaP标准溶液6次。结果表明:二者的保留时间平均为2.106和3.218 min,相对标准偏差(relative standard deviation, RSD)为0.1%和0.2%;峰面积的平均值分别为482 861 μV·s和300 678 μV·s,RSD为1.1%和1.3%。定性和定量的重复性均较理想。
2.3 线性关系和检出限
从低到高依次进标准液0.101、0.505、1.01、5.05和10.1 μg/L,分别用C18柱和RP18柱分离,以BaP峰面积为纵坐标Y,质量浓度为横坐标X,得线性回归方程。C18柱为Y=562 000X+98 100,r=0.999 955;RP18柱为Y=576 000X+18 400,r=0.999 993。RP18柱对应的线性更好,尤其在0.101~1.01 μg/L的低质量浓度范围内,峰面积与浓度呈良好的线性关系,说明该色谱柱更适用于微量BaP的检测。借助RP18柱分离样品溶液,根据3倍信噪比,得方法检出限为0.2 μg/kg,比GB/T 22509—2008规定的最低检出限(0.1 μg/kg)稍高。
2.4 固相萃取柱处理效果比较
称取大豆油0.3 g,分别添加BaP溶液至2、5和10 μg/kg 3个水平,用A、B、C、D柱对大豆油样品和加标样品进行前处理,每个处理6个平行。各处理样品和加标样品色谱图如图6~9所示。从中可以看出,在A、B、C柱的处理样品色谱图中,BaP峰后均有大峰出现,可能样品溶液中还含有某些物质,在与BaP相同的荧光条件下有强响应,通过调节流动相比例,可以将目标峰与杂峰分开。其中C处理色谱图中杂峰较多,难以准确积分和定量。加标回收率和精密度检测结果(表1)表明,A、B、C、D柱的平均回收率为91.0%~106.9%,RSD为1.4%~9.6%。比较BaP测定值,C柱处理明显高于其他处理,并且回收率的RSD值较高,表明C柱处理所得检测结果的可靠性和平行性欠佳。
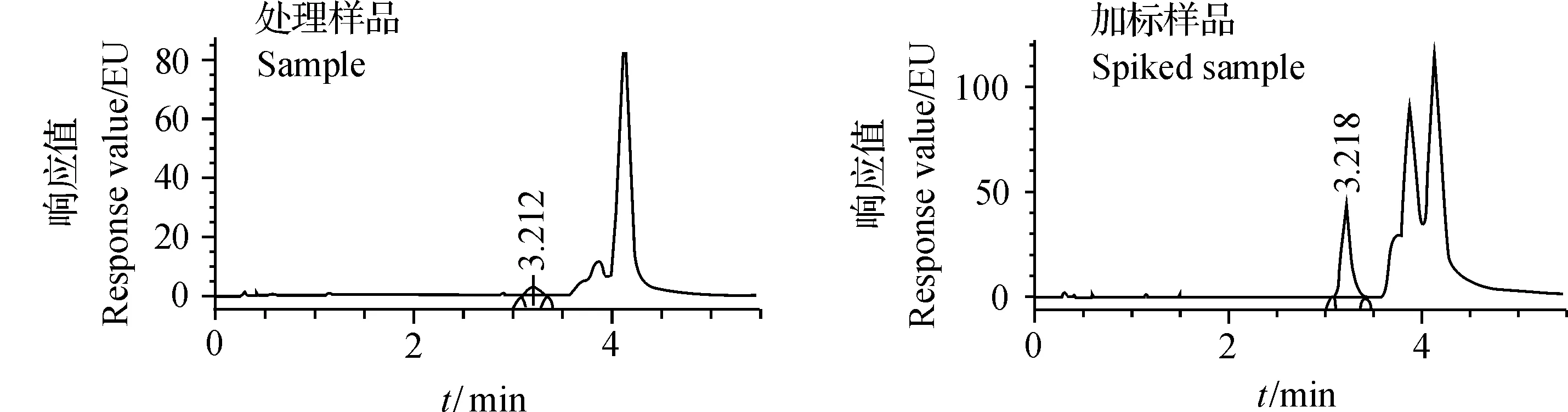
图6 A柱处理样品和加标样品色谱图

图7 B柱处理样品和加标样品色谱图

图8 C柱处理样品和加标样品色谱图

图9 D柱处理样品和加标样品色谱图
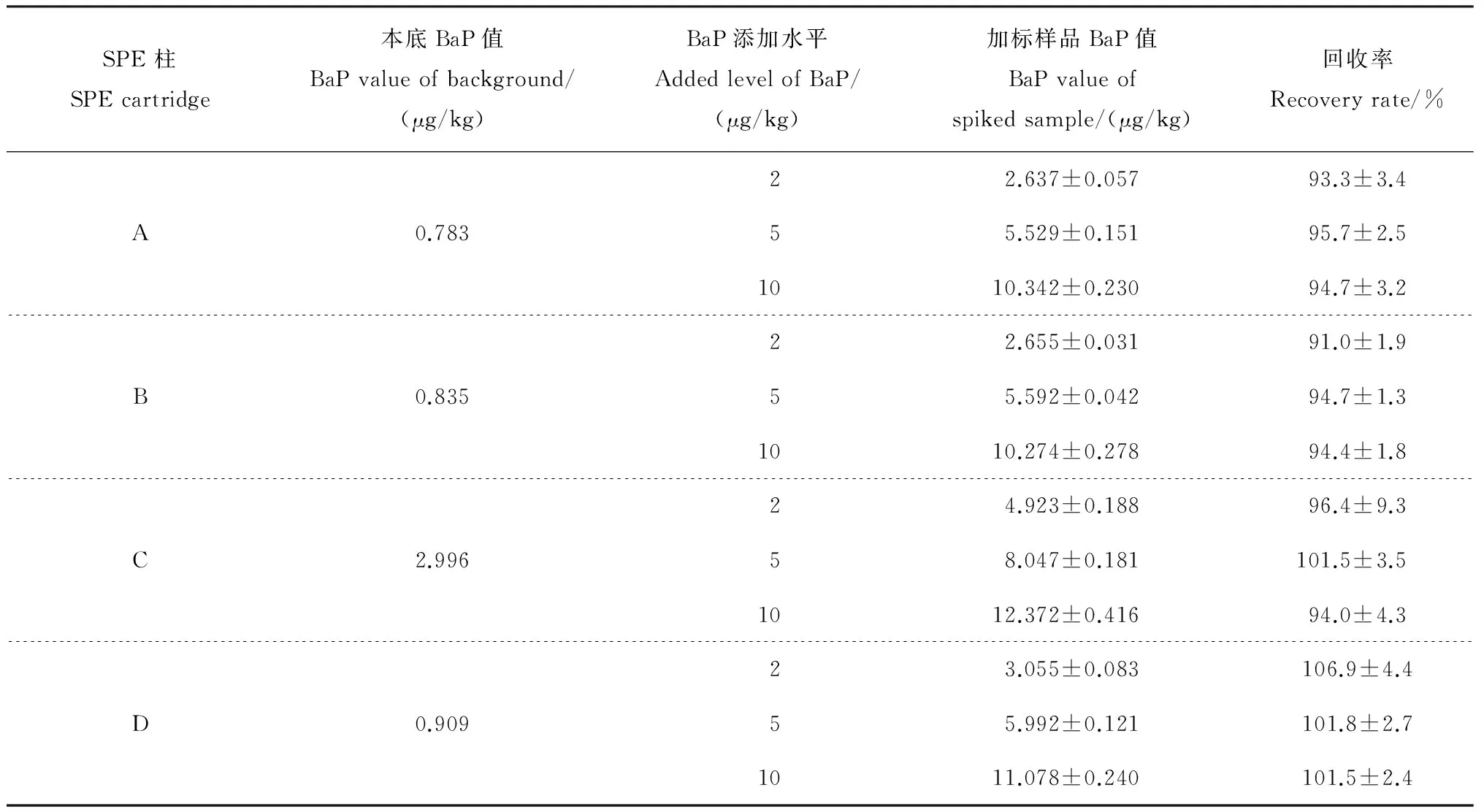
表1 BaP加标回收率和精密度测定结果
2.5 样品检测
对本实验室同一时间接收的某企业送检油样分别用A、B、D柱处理并检测,每处理3个平行,检测结果的平均值见表2,其RSD在0.3%~5.5%之间。根据GB 2762—2012规定的限量要求(≤10 μg/kg),检测结果报告值保留到整数位,对于BaP含量较低的植物油和基质更复杂的调和油,不同SPE柱处理组的报告值有差异。从表2可以看出,该批次样品的BaP含量均在限量以下,为合格样品。
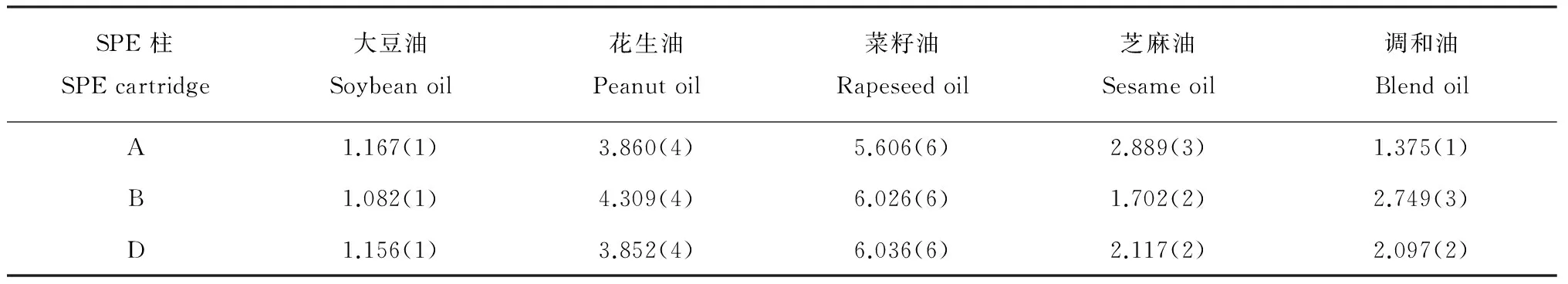
表2 食用油中苯并[a]芘测定值
括号中的数值为报告值。
Values in brackets are report values.
3 讨论
本文数据由工作站软件自动积分所得,因UPLC的灵敏度远高于HPLC,极小的响应都可以被检测到并自动积分,尤其当BaP含量较低时,杂质可能会影响定量的准确性。
试验选用的A柱和B柱均采用聚合物填料,通过分子印迹技术特异性吸附BaP,操作步骤相同,先依次用二氯甲烷、正己烷活化,上样后用正己烷淋洗,再用二氯甲烷洗脱,优点是除油效果好,耗费溶剂少,经济环保;但A柱处理在淋洗和洗脱过程中,液体流速较慢,有时需加压才能流出,前处理用时比B柱处理长。C柱为改性活性炭填料,可萃取出样品中的BaP并使其吸附,处理时因用到丙酮、正己烷、异丙醇等,操作过程相对复杂。D柱采用与国标相同的Brockmann IV级活度的中性氧化铝为填料,柱体积大,流速快,需要加装点胶针头控制流速以防止油被洗脱出,因只用到正己烷,步骤最简单,尤其适合多个样品的同步处理,缺点是需耗费较多的溶剂。
尽管样品经过除油处理,但仍可能残留油溶性杂质,特别是批量进样后,色谱柱受污染更重,致使UPLC系统压力明显升高,很容易超过警戒最高压力。因本实验使用的流动相极性较强,无法彻底清洗极性较弱的油溶性杂质,可在进样间或进样结束后用低流速的异丙醇清洗色谱系统。
4 结论
本研究使用商业化BaP专用固相萃取柱净化样品和富集目标物,操作简便、节省试剂、净化效果理想。采用UPLC检测BaP,分析速度是HPLC的3倍,并且节省了流动相,检测结果准确可靠,尤其适用于食品批量检测。
[1] 贾鸿宁,戴红.多环芳烃的致癌性及其机制研究进展.大连医科大学学报,2009,31(5):604-607,620.
Jia H N, Dai H. Carcinogenicity of polycyclic aromatic hydrocarbons and research progress of the mechanisms.JournalofDalianMedicalUniversity, 2009,31(5):604-607,620. (in Chinese with English abstract)
[2] 李永和.3-4苯并芘(BaP)对粮食及食品的污染.粮食科技与经济,1997(4):37-38.
Li Y H. 3-4 benzo [a] pyrene (BaP) pollution on grain and food.GrainScienceandTechnologyandEconomy, 1997(4):37-38. (in Chinese)
[3] 中华人民共和国卫生部.GB 2762—2012 食品中污染物限量.北京:中国标准出版社,2012:8-9.
Ministry of Health of the People’s Republic of China.GB2762—2012MaximumLimitsofContaminantsinFood. Beijing: Chinese Standard Press, 2012:8-9. (in Chinese)
[4] 中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.27—2003 食品中苯并(a)芘的测定.北京:中国标准出版社,2004:1-4.
Ministry of Health of the People’s Republic of China, Standardization Administration of the People’s Republic of China.GB/T5009.27—2003DeterminationofBenzo[a]PyreneinFoods. Beijing: Chinese Standard Press, 2004:1-4. (in Chinese)
[5] 张莉,张永涛.固相萃取-气相色谱-质谱联用快速检测地下水中13种有机氯农药及苯并[a]芘.分析实验室,2008,27(增刊):400-402.
Zhang L, Zhang Y T. Rapid detection of 13 kinds of organochlorine pesticides and benzo [a] pyrene in groundwater by SPE-GC-MS.ChineseJournalofAnalysisLaboratory, 2008,27(Suppl.):400-402. (in Chinese)
[6] 刘玉兰,张小涛,赵欢欢.液相色谱-串联质谱法检测食用油脂中苯并芘.农业机械,2010(10):45-48.
Liu Y L, Zhang X T, Zhao H H. Determination of benzo [a] pyrene in edible oil by LC-MS.FarmMachinery, 2010(10):45-48. (in Chinese)
[7] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22509—2008 动植物油脂苯并(a)芘的测定:反相高效液相色谱法.北京:中国标准出版社,2008:1-8.
General Administration of Quality Supervision Inspection and Quarantine of the People’s Republic of China, Standardization Administration of the People’s Republic of China.GB/T22509—2008AnimalandVegetableFatandOilDeterminationofBenzo(a)pyrene:Reverse-phaseHighPerformanceLiquidChromatographyMethod. Beijing: Chinese Standard Press, 2008:1-8. (in Chinese)
Determination of benzo [a] pyrene in vegetable oil by solid phase extraction-ultra performance liquid chromatography-fluorescence detector. Journal of Zhejiang University (Agric. & Life Sci.), 2015,41(2):189-194
Feng Yinjie1, Qiao Yongsheng1, Chen Wei1, Feng Chengyu2, Ying Tiejin3
(1.TaizhouInstituteforFoodandDrugControl,Taizhou225300,Jiangsu,China; 2.AgriculturalCommissionofHai’anCounty,Hai’an226600,Jiangsu,China; 3.DepartmentofFoodScience&Nutrition,SchoolofBiosystemsEngineeringandFoodScience,ZhejiangUniversity,Hangzhou310058,China)
vegetable oil; benzo [a] pyrene; solid phase extraction cartridge; ultra performance liquid chromatography; chromatographic column
联系方式:冯寅洁,E-mail:fengyj0126@163.com
2014-09-09;接受日期(Accepted):2014-12-17;网络出版日期(Published online):2015-03-20
TS 227
A
URL:http://www.cnki.net/kcms/detail/33.1247.S.20150320.1837.001.html

