丁酸钠对饮食诱导肥胖大鼠的作用
朱涵, 谭莎莎, 杨虹, 王凌*
(1.华中农业大学食品科学技术学院,环境食品学教育部重点实验室,武汉 430070;2.武汉市普爱医院,武汉 430030)
丁酸钠对饮食诱导肥胖大鼠的作用
朱涵1, 谭莎莎1, 杨虹2, 王凌1*
(1.华中农业大学食品科学技术学院,环境食品学教育部重点实验室,武汉 430070;2.武汉市普爱医院,武汉 430030)
为建立由高脂饲料诱导的肥胖易感(obesity-susceptible, OS)和肥胖抵抗(obesity-resistant, OR)大鼠模型,并探讨在高脂饲料中添加丁酸钠对二者的作用,给予SD(Sprague-Dawley)大鼠高脂饲料饲喂3周后依据其体质量增加量排序并再分组,上1/3作为OS组,下1/3作为OR组,继续给予高脂饲料喂养12周,OS大鼠体质量增加明显,体质指数、皮下脂肪、内脏脂肪和体脂肪含量以及血清总胆固醇、甘油三酯、低密度脂蛋白、瘦素与对照组比较显著增高,差异有统计学意义(P<0.05),OR组各项指标与对照组比较在统计学上无显著差异(P>0.05)。按照此造模方法从饲喂高脂饲料第4周起,丁酸钠干预(obesity intervention with sodium butyrate, OI)组增加8 mmol/L丁酸钠生理盐水(0.9%氯化钠)溶液1 mL 灌胃,1次/日;肥胖对照(obesity control, OC)组则用1 mL 0.9%氯化钠溶液灌胃,1次/日,共干预16周。结果表明:添加丁酸钠后,OI组大鼠体质量增加、体质指数、皮下脂肪、内脏脂肪和体脂肪含量以及血清总胆固醇、甘油三酯、低密度脂蛋白、瘦素与OC组比较均显著改善,差异有统计学意义(P<0.05)。说明SD大鼠对于高脂饲料具有不同的应答能力,可获得肥胖敏感及肥胖抵抗模型;对于高脂饮食敏感的SD大鼠,在其高脂饲料中添加丁酸盐能够改善其体质量增加与体质指数,减少体脂肪含量,降低血脂与血清瘦素水平。
丁酸钠; 高脂饲料; 肥胖
Summary Obesity has been reported as an increasingly prevalent and highly heritable health problem leading to increased risks for several common diseases. Human obesity can be induced by genetic factors such as loss-of-function mutations in individual genes. The products of these genes are essential for normal body mass regulation in both laboratory animals and humans. Nevertheless, the role of gene-environment interactions in the etiology of obesity cannot be ignored. Diet is a major factor of our current obesogenic environment, and the interests have been aroused in rodent models of diet-induced obesity (DIO). The SD (Sprague-Dawley) rat model of DIO was been reported to exhibit a clear segregation into susceptible and resistant subpopulations shortly after being transferred to a high energy diet.
We established the obesity-susceptible (OS) and obesity-resistant (OR) rat model and examined the effect of butyric acid, a short chain fatty acid formed by fermentation in the large intestine, in the regulation of obesity in mice fed a high-fat diet. Male SD rats were divided into OS rats and OR rats after being fed with high fat diet for three weeks. Then both of them were fed with high fat diet for another 12 weeks. Measurements of body mass, body length, Lee’s index, and body mass index (BMI) were performed. After the rats were sacrificed, body fat content, serum total cholesterol (TC), triglyceride (TG), high density lipoprotein (HDL), low density lipoprotein (LDL) and serum leptin were measured.
The results showed that there were significant differences in body mass, BMI, body fat content, TC, TG, LDL and serum leptin between OS rats and control rats. But there were no significant differences between OR rats and control rats. In the OS rats, sodium butyrate was administrated in the high-fat diet at the concentration of 8 mmol/L for 16 weeks. Body mass, body length, Lee’s index, BMI, body fat content, TC, TG, HDL, LDL and serum leptin were investigated both in obesity intervention with sodium butyrate (OI) group and obesity control (OC) group. The values of body mass, BMI, body fat content, TC, TG, LDL and serum leptin for OI rats were significantly lower than OC rats. But there were no significant differences between OC rats and normal control rats.
In conclusion, the supplementation of sodium butyrate in the high-fat diet prevents the development of obesity in the obesity-susceptible SD rat.
人群中肥胖的发生具有异质性,因而在研究时建立由饮食诱导的肥胖易感与肥胖抵抗动物模型已成为必要。Mercer等[1]发现给予高脂饲料后,部分SD(Sprague-Dawley)大鼠体质量明显增加,而部分未出现显著增长,甚至与饲喂基础饲料的对照组大鼠体质量接近。SD大鼠对高脂饲料具有不同应答能力的特性,可用来建立更类似人类由饮食诱导的肥胖发生的动物模型。
高纤维饮食人群肥胖以及与肥胖相关疾病的发病率较低纤维饮食人群低。而短链脂肪酸作为膳食纤维在结肠内发酵的产物,在生理和病理过程中具有重要的临床意义,其中丁酸是结肠上皮细胞最主要的能量来源,并且在肿瘤发生、炎性和免疫应答等过程中发挥作用[2-3]。丁酸钠同时具有亲水性和亲脂性,可用于丁酸对机体作用的实验研究。本研究拟建立由高脂饮食诱导的肥胖易感及肥胖抵抗大鼠模型,探讨丁酸钠对它们的作用。
1 材料与方法
1.1 材料
雄性SD大鼠120只(21日龄),无特定病原体动物(specific pathogen free animals, SPF)级,以及基础饲料由武汉大学人民医院动物实验中心提供。丁酸钠购自Sigma公司(美国)。
1.2 方法
1.2.1 高脂饲料配方 基础饲料71.8%,蛋黄粉8%,猪油18%,胆固醇2%,胆酸钠0.2%。
1.2.2 肥胖大鼠模型的建立 雄性SD大鼠60只(21日龄),SPF级,适应环境1周后,将其随机分为2组:实验组(50只),给予高脂饲料;对照组(10只),给予基础饲料。自由饮水,摄食。3周后,实验动物组根据体质量增加量排序并再分组,上1/3(18只)作为肥胖易感(obesity-susceptible, OS)组,下1/3(18只)作为肥胖抵抗(obesity-resistant, OR)组,中间1/3留取靠近中位数的8只加入对照组,其余剔除。OS组和OR组继续给予高脂饲料,对照组给予基础饲料,继续喂养12周。每周测量1次大鼠体质量和体长,计算Lee指数和体质指数(body mass index, BMI)。Lee指数=(体质量/g)1/3×1 000/(体长/cm)。BMI=(体质量/kg)/(体长/m)2。实验结束后处死动物,取血,并留取内脏脂肪组织(肾周、睾周和网膜)和皮下脂肪组织(肩胛、腋下和腹股沟),称质量、留样,计算体脂肪质量分数。w(体脂肪)/%=(内脏脂肪+皮下脂肪)/体质量×100[4]。血样采集后室温放置1 h,3 000 r/min、4 ℃离心20 min,收集血清,置于-20 ℃冰箱保存;血脂采用酶法测定,血清瘦素采用大鼠专用试剂盒以酶联免疫法测定。
1.2.3 丁酸钠对肥胖大鼠模型的干预 雄性SD大鼠60只(21日龄),SPF级,适应环境1周后,依照建模步骤在饲喂3周后筛选出肥胖易感组(18只)及正常对照组。将肥胖易感组再随机分为2组:丁酸钠干预(obesity intervention with sodium butyrate, OI)组(9只),继续给予高脂饲料,并用8 mmol/L丁酸钠生理盐水(0.9%氯化钠)溶液1 mL灌胃,1次/日;肥胖对照(obesity control, OC)组(9只),继续给予高脂饲料,并用0.9%氯化钠溶液1 mL灌胃,1次/日。在正常对照组中随机选取9只作为正常对照(normal control, NC),给予基础饲料。3组动物均自由饮水,摄食。喂养16周。每周测量1次大鼠体质量和体长,计算Lee指数和BMI。在实验结束后处死动物,取血,并留取内脏脂肪组织(肾周、睾周和网膜)和皮下脂肪组织(肩胛、腋下和腹股沟),称质量、留样;计算体脂肪含量,测定血脂、血清和瘦素,方法同1.2.2节。
2 结果与分析
2.1 高脂饮食诱导肥胖易感及肥胖抵抗大鼠模型
实验初始选择的大鼠体质量均在60 g左右,造模进行到第15周时,OS大鼠体质量增加明显,与对照组相比在统计学上有显著差异(P<0.05),Lee指数、BMI的变化趋势与体质量相一致,但Lee指数与对照组相比差异无统计学意义(P>0.05);OR组各项指标与对照组相比差异无统计学意义(P>0.05)(表1)。OS组大鼠皮下脂肪、内脏脂肪和体脂肪含量与对照组相比显著增高,差异有统计学意义(P<0.05);OR组各项指标与对照组相比差异均无统计学意义(P>0.05)(表2)。OS组大鼠血清总胆固醇、甘油三酯、低密度脂蛋白、血清瘦素与对照组相比显著增高,差异有统计学意义(P<0.05);OR组各项指标与对照组相比差异均无统计学意义(P>0.05)(表3)。
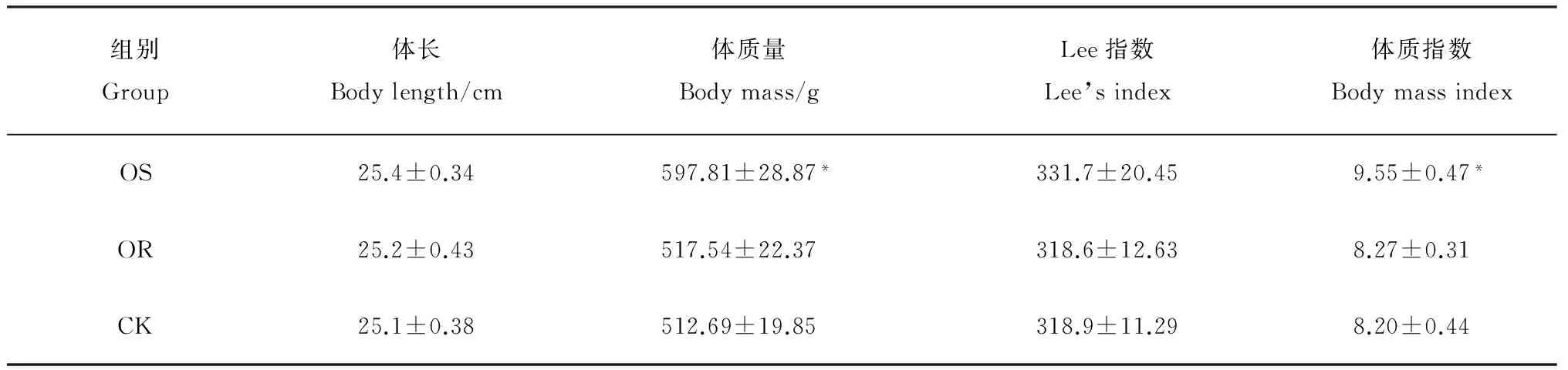
表1 OS、OR及对照组大鼠体长、体质量、Lee指数和体质指数比较
表中数据为平均值±标准差,n=18。OS:肥胖易感;OR:肥胖抵抗;CK:对照。*表示与对照组相比在P<0.05水平差异有统计学意义。
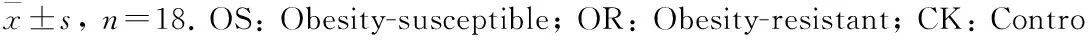

表2 OS、OR及对照组大鼠体脂肪含量比较
表中数据为平均值±标准差,n=18。OS:肥胖易感;OR:肥胖抵抗;CK:对照。*表示与对照组相比在P<0.05水平差异有统计学意义。
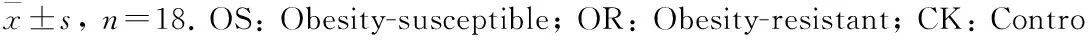

表3 OS、OR及对照组大鼠血脂和血清瘦素比较
表中数据为平均值±标准差,n=18。OS:肥胖易感;OR:肥胖抵抗;CK:对照;TC:血清总胆固醇;TG:甘油三酯;HDL:高密度脂蛋白;LDL:低密度脂蛋白。*表示与对照组相比在P<0.05水平差异有统计学意义。
2.2 丁酸钠对高脂饮食诱导肥胖的干预作用
经丁酸钠干预后,OI组肥胖大鼠体质量下降明显,与OC组相比在统计学上有显著差异(P<0.05),与NC组比较差异无统计学意义(P>0.05);Lee指数、BMI的变化趋势与体质量相一致,但Lee指数与对照组比较差异无统计学意义(P>0.05)(表4)。OI组大鼠皮下脂肪、内脏脂肪和体脂肪含量与OC组比较显著降低,差异有统计学意义(P<0.05),与对照组比较差异无统计学意义(P>0.05)(表5)。OI组大鼠血清总胆固醇、甘油三酯、低密度脂蛋白、血清瘦素与OC组比较显著降低,差异有统计学意义(P<0.05),与对照组比较差异无统计学意义(P>0.05)(表6)。
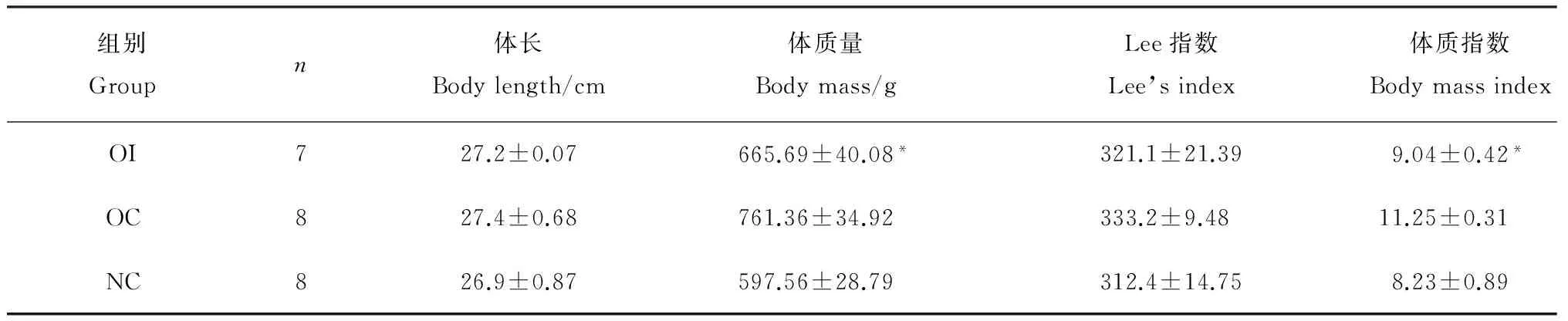
表4 OI、OC及NC组大鼠体长、体质量、Lee指数和体质指数比较
表中数据为平均值±标准差。OI:丁酸钠干预;OC:肥胖对照;NC:正常对照。*表示与肥胖对照组相比在P<0.05水平差异有统计学意义。
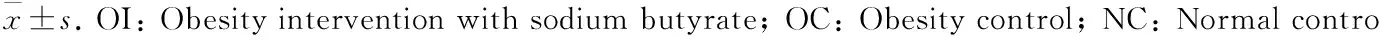

表5 OI、OC及NC组大鼠体脂肪含量比较
表中数据为平均值±标准差。OI:丁酸钠干预;OC:肥胖对照;NC:正常对照。*表示与肥胖对照组相比在P<0.05水平差异有统计学意义。
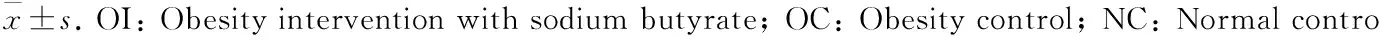
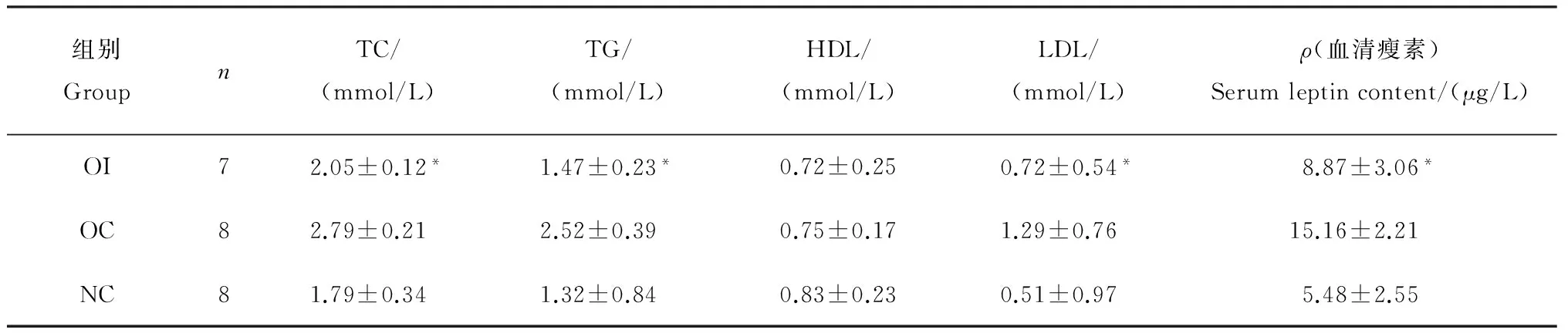
表6 OI、OC及NC组大鼠血脂和血清瘦素比较
表中数据为平均值±标准差。OI:丁酸钠干预;OC:肥胖对照;NC:正常对照;TC:血清总胆固醇;TG:甘油三酯;HDL:高密度脂蛋白;LDL:低密度脂蛋白。*表示与肥胖对照组相比在P<0.05水平差异有统计学意义。
3 讨论
体质量超标和肥胖作为全球的流行病,对健康的影响从慢性疾病到严重的并发症乃至死亡,大大降低了生活与生命质量。由于肥胖增加了高血压、2型糖尿病、冠心病、结直肠癌、女性子宫内膜癌及绝经后乳腺癌、退行性关节病等相关伴发疾病的危险性,被认为是重要的公共健康问题[5-6]。机体能量平衡的调节受控于一个复杂的系统,该系统可能被不同方式及不同环节所干扰从而引起肥胖。目前已有多种关于肥胖原因的机制,当然可能会有许多相互关联的起因,其中最主要涉及遗传与环境2个方面。基因遗传无疑是重要的,不同的个体其易感性不同。同一疾病的不同患者可能对药物治疗的反应(应答)不同,同样,人群对于高脂、高能量、低纤维饮食这一肥胖的重要膳食危险因素的反应(应答)也有不同。研究发现,SD大鼠对高脂饲料具有不同的应答能力[1,4]。本实验以高脂饲料喂养SD大鼠3周后依据体质量增加量排序分组,继续给予高脂饲料饲喂12周,获得体质量、BMI、脂肪含量、血脂、血清瘦素水平差异显著的肥胖易感及肥胖抵抗大鼠模型,为后续研究建立了由饮食诱导的并且具有接近人类肥胖发生异质性特点的动物模型。
增加膳食纤维的摄入能够预防和改善肥胖以及与肥胖相关疾病的发生。膳食纤维并不被哺乳动物胃及小肠内的酶消化,而是被结肠内的细菌酵解,其发酵的程度与纤维的类别和物理性状以及宿主结肠内菌群和菌相有关。膳食纤维中的多糖如魔芋葡甘聚糖等在结肠内经细菌分解产生短链脂肪酸,主要为乙酸、丙酸和丁酸等,对肠内容物有影响,如pH可降至4.8~5.0,引起肠道内菌群和菌相发生改变、胆酸盐浓度改变及代谢的变化[7]。丁酸作为短链脂肪酸的主要成分,是结肠上皮细胞的主要能量来源,尤其是末段结肠黏膜细胞的最好能量来源,并可抑制结肠和直肠上皮细胞的过度增生及转化,降低结、直肠癌的发病率以及预防和改善溃疡性结肠炎。丁酸与钠结合后形成的钠盐由于具有亲水和亲脂两亲性,被用于研究丁酸的作用机制。丁酸钠能够通过肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)或/及线粒体途径诱导肿瘤细胞凋亡[8],调节白细胞介素(interleukin, IL)、一氧化氮合酶 (nitric oxide synthase, NOS)以及环氧合酶-2(yclooxygenase-2, COX-2)等的表达在炎性反应中发生作用,而肥胖(尤其是单纯性肥胖)的发生也被认为一定程度上是细胞增殖和分化失控的结果,肥胖者体内与脂肪细胞凋亡调节相关的因子被观察到有一定的异常,如肥胖者脂肪组织和血中TNF-α可增加3~5倍[9]。炎性或免疫反应的异常则被认为广泛存在于肥胖以及相关慢性疾病或/及肿瘤的发生过程中,在肿瘤内或其周围微环境中,某些细胞分泌促炎性因子TNF-α、IL-1、IL-6和IL-8等,还分泌基质降解酶、生长因子和活性氧,这些因子和活性氧导致DNA的损伤,最终导致癌症发生。丁酸钠的生物活性与抑制组蛋白去乙酰化酶(histone deacetylase, HDAC)1、2相关。组蛋白去乙酰化酶通过蛋白质去乙酰化作用修饰染色体结构,从而调控基因转录。本文观察了丁酸钠对由高脂饮食诱导的肥胖敏感及肥胖抵抗大鼠体质量、BMI、脂肪含量、血脂、血清瘦素水平的调控作用。结果发现:对于高脂饮食敏感的SD大鼠,在其高脂饲料中添加丁酸盐能够预防肥胖及瘦素抵抗发生;而对于非敏感的SD大鼠,添加丁酸盐类对其摄食、运动及脂肪代谢无影响。Gao等[10]研究发现,对于喂养导致肥胖的C57BL/6J小鼠,丁酸盐类补充饲料可以预防和治疗高脂饲养所导致的胰岛素抵抗,其作用机制与促进能量消耗、诱导线粒体功能相关。在本实验中丁酸钠的作用机制尚待进一步研究。
4 结论
SD大鼠对于高脂饲料具有不同的应答能力,干预3周后按照其体质量增加量排序分组,继续给予高脂饲料12周可获得肥胖敏感及肥胖抵抗模型,该模型对添加丁酸钠的饮食干预有不同响应。对于高脂饮食敏感的SD大鼠,在其高脂饲料中添加丁酸盐能够改善体质量增加与体质指数,减少体脂肪含量,降低血脂与血清瘦素水平,而对肥胖抵抗SD大鼠的相应指标无显著影响。
[1] Mercer J G, Archer Z A. Diet-induced obesity in the Sprague-Dawley rat: Dietary manipulations and their effect on hypothalamic neuropeptide energy balance systems.BiochemicalSocietyTransactions, 2005,33:1068-1072.
[2] Waldecker M, Kautenburger T, Daumann H,etal. Inhibition of histone-deacetylase activity by short-chain fatty acids and some polyphenol metabolites formed in the colon.TheJournalofNutritionalBiochemistry, 2008,19(9):587-593.
[3] Santini V, Gozzini A, Ferrari G. Histone deacetylase inhibitors: Molecular and biological activity as a premise to clinical application.CurrentDrugMetabolism, 2007,8(4):383-393.
[4] 刘健敏,郑龙,张焕玲,等.肥胖易感及肥胖抵抗动物模型的建立与评价.科学技术与工程,2012,12(28):7344-7346.
Liu J M, Zheng L, Zhang H L,etal. Establishment of obesity prone and obesity resistant rats induced by high-fat diet.ScienceTechnologyandEngineering, 2012,12(28):7344-7346. (in Chinese with English abstract)
[5] Finegood D T. Canada in context: Challenging our epidemics of obesity and obesity-related chronic diseases.HealthReports, 2009,20(4):9-10.
[6] Nelson R, Antonetti I, Bisognano J D,etal. Obesity-related cardiorenal syndrome.TheJournalofClinicalHypertension, 2010,12(1):59-63.
[7] Chen H L, Liu Y M, Wang Y C. Comparative effects of cellulose and soluble fibers (pectin, konjac glucomannan, inulin) on fecal water toxicity toward Caco-2 cells, fecal bacteria enzymes, bile acid, and short-chain fatty acids.JournalofAgriculturalandFoodChemistry, 2010,58(18):10277-10281.
[8] Wang L, Luo H S, Xia H. Sodium butyrate induces human colon carcinoma HT-29 cell apoptosis through a mitochondrial pathway.TheJournalofInternationalMedicalResearch, 2009,37(3):803-811.
[9] Qian H, Hausman D B, Compton M M,etal. TNFα induces and insulin inhibits caspase 3-dependent adipocyte apoptosis.BiochemicalandBiophysicalResearchCommunications, 2001,284(5):1176-1183.
[10] Gao Z G, Yin J, Zhang J,etal. Butyrate improves insulin sensitivity and increases energy expenditure in mice.Diabetes, 2009,58(7):1509-1517.
Effect of sodium butyrate on diet-induced obesity in the Sprague-Dawley rat. Journal of Zhejiang University (Agric. & Life Sci.), 2015,41(2):195-200
Zhu Han1, Tan Shasha1, Yang Hong2, Wang Ling1*
(1.KeyLaboratoryofEnvironmentCorrelativeDietology,MinistryofEducation,CollegeofFoodScienceandTechnology,HuazhongAgriculturalUniversity,Wuhan430070,China; 2.Pu’aiHospitalofWuhan,Wuhan430030,China)
sodium butyrate; high-fat diet; obesity
中央高校基本科研业务费专项资金(2011QC073);湖北省自然科学基金(2013CFB197).
联系方式:朱涵,E-mail:jiana1995@163.com
2014-09-19;接受日期(Accepted):2014-12-02;网络出版日期(Published online):2015-03-20
R 151.3; TS 201.4
A
*通信作者(Corresponding author):王凌,E-mail:wangling@mail.hzau.edu.cn
URL:http://www.cnki.net/kcms/detail/33.1247.S.20150320.2007.009.html

