前列腺增生和前列腺癌中缺氧诱导因子-1α的表达
段传军,杨振忠,法 文
(1.安徽省淮南市新华医院泌尿外科,安徽 淮南 232052;2.安徽省淮南市新华医院病理科,安徽 淮南 232052)
前列腺增生和前列腺癌中缺氧诱导因子-1α的表达
段传军1,杨振忠2,法 文2
(1.安徽省淮南市新华医院泌尿外科,安徽 淮南 232052;2.安徽省淮南市新华医院病理科,安徽 淮南 232052)
目的 探讨前列腺癌及前列腺增生组织中缺氧诱导因子-1α(HIF-1α)的表达情况。方法 CD34单克隆抗体免疫染色鉴别微血管;细胞质单克隆抗体染色识别血管内皮生长因子(VEGF)阳性细胞;细胞核单克隆抗体染色识别HIF-1α阳性细胞。结果 前列腺癌组织中CD34、VEGF和HIF-1α染色率显著高于前列腺增生组织,CD34和HIF-1α、VEGF和HIF-1α及CD34和VEGF具有相关性。结论 前列腺癌组织中MVD、VEGF与HIF-1α水平显著高于前列腺增生组织。
前列腺癌;肿瘤血管生成;缺氧诱导因子-1α;血管内皮生长因子
1 材料与方法
1.1 材料
随机选取安徽省淮南市新华医院2006-02—2015-03月收治的70例经直肠前列腺穿刺活检、经尿道前列腺电切术及开放手术获取的石蜡保存的前列腺组织标本。病理证实为前列腺增生35例(BPH组),年龄58~85岁,中位年龄74岁;均行经尿道前列腺电切术。前列腺腺癌35例(PCa组),年龄55~91岁,中位年龄75岁;Gleason评分6~9分;其中行前列腺穿刺活检8例,开放性前列腺切除术1例,经尿道前列腺电切术26例。术前均未接受过内分泌治疗、放疗及化疗。
1.2 试剂
一抗:CD34为即用型鼠抗人单克隆抗体,VEGF为即用型鼠抗人单克隆抗体,HIF-1α为浓缩型鼠抗人单克隆抗体。二抗:即用型免疫组化EliVisionTMsuper试剂盒,包括放大剂(鼠/兔)及多聚酶复合物。以上抗体、DAB底物显色剂及免疫组化试剂盒均购自福州迈新生物技术开发有限公司。
1.3 方法
免疫组化采用Envision两步法,步骤严格参照检测试剂盒说明书进行。PBS代替一抗作空白对照,已知阳性组织切片作阳性对照。实验步骤:组织标本经甲醛溶液常规固定,石蜡包埋,连续切片,3~4 μm,烘干,二甲苯脱蜡三次,每次15 min,梯度酒精水化,3%双氧水阻滞内源性过氧化物酶,水浴修复。分别滴加入一抗(50 μL),置湿盒中,4℃ 24 h。取出切片,室温下放置30 min,PBS液冲洗后加二抗(50 μL),室温孕育10 min,PBS液冲洗,加入DAB显色剂,显微镜下观察3~5 min,苏木素复染,中性树脂封片。
1.4 观察指标
微血管密度(micro-vessel density,MVD)计数:参照Weidner等[5]的方法,CD34单克隆抗体免疫染色鉴别微血管,全面观察组织切片(低倍镜10×10),找出肿瘤组织中微血管致密区域,即新生毛细血管热岛(Hotspot),再在血管致密区域计数5个高倍视野(10×40)下毛细血管的平均值,定为MVD值。CD34单克隆抗体染色的血管密度中位值是90(35~210),定量关系如下:(+)0~35;(++)36~90;(+++)大于90。
在近两个小时与肖建国的对话中,我们不仅了解到王选院士为人师的钻研精神和高尚师德,而且也通过肖建国对于过去拼搏历程的回顾,体会到持续的创新精神和永不妥协的奋斗精神。愿这样的精神,可以成为我们新一代印刷人努力前进的无穷动力。
即用型鼠抗人单克隆抗体染色识别VEGF表达,定位于细胞质判断VEGF阳性程度,分为以下四个级别:(-)没有染色;(+)染色点小于5%的细胞;(++)染色点5%~25%细胞之间;(+++)染色点大于25%的细胞(高VEGF)。
定位于细胞核判断HIF-1α阳性程度,分为以下四个级别:(-)无核染色;(+)染色点小于10%的细胞染色;(++)染色点10%~50%细胞之间;(+++)染色点大于50%的细胞(高HIF-1α)。
MVD、VEGF和HIF-1α免疫组化表达由两位研究者独立评价,若偏差超过10%,则重新检查该切片。3个标志物结果一致率大于90%。
1.5 统计学方法
3种标志物采用半定量和定量法进行评估,SPSS 10.0程序包分析数据,数据符合正态分布采用方差分析,独立样本使用U检验和非参数检验。采用回归分析同一组连续变量的相关性,采用相关系数和F检验分析同一组分类变量的相关性。P<0.05为差异有显著性。
2 结 果
2.1 CD34、VEGF和HIF-1α在前列腺增生和前列腺癌组织中的表达
在良性前列腺增生和前列腺癌组织血管网中很容易观察CD34抗体,癌旁前列腺增生组织中CD34表达比单纯前列腺增生组织中更强。在良性前列腺增生组织中,增生结节周围CD34阳性血管多于结节中央,尤其是血管内皮型结节。小结节比大结节CD34阳性血管更多。在前列腺增生组织中,40%标本表现出高MVD;在前列腺癌组织中,54.3%标本表现出高MVD(图1A、B,表1)。
大部分标本细胞质中均有VEGF免疫染色,35例前列腺增生组织标本中有30例VEGF免疫染色,35例前列腺癌组织标本均有VEGF免疫染色。45.7%前列腺增生组织标本中VEGF呈高表达,51.4%前列腺癌组织标本中VEGF呈高表达(图2A、B,表1)。
前列腺增生和前列腺癌组织标本中HIF-1α阳性区域免疫染色主要位于细胞核,但是细胞质染色偶尔也可以被观察到。35例前列腺增生组织标本中有19例HIF-1α免疫染色,35例前列腺癌组织标本有28例HIF-1α免疫染色。8.6%前列腺增生组织标本中HIF-1α呈高表达,31.4%前列腺癌组织标本中HIF-1α呈高表达(图3A、B,表1)。
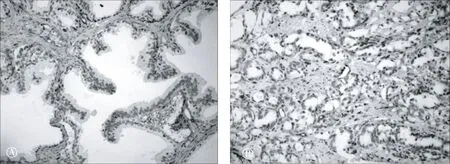
A CD34在前列腺增生组织中的表达(EnVision×200)B CD34在前列腺癌组织中的表达(EnVision×200)
图1
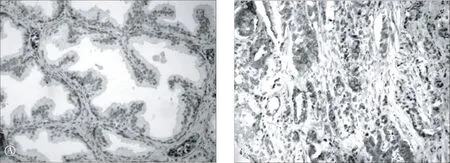
A VEGF在前列腺增生组织中的表达(EnVision×200)B VEGF在前列腺癌组织中的表达(EnVision×200)
图2

A HIF-1α在前列腺增生组织中的表达(EnVision×200)B HIF-1α在前列腺癌组织中的表达(EnVision×200)
图3

表1 BPH组与PCa组免疫组化结果比较 n(%)
2.2 CD34、VEGF和HIF-1α间的关系
PCa组CD34、VEGF和HIF-1α表达明显高于BPH组(秩和检验P=0.001,柯尔莫诺夫-斯米尔诺夫检验P<0.001)。BPH组中,CD34与HIF-1α、VEGF与HIF-1α及CD34与VEGF相关(F检验,P值分别为=0.001,<0.001,<0.001);PCa组中,VEGF与HIF-1α相关(F检验,P<0.001,秩相关系数P<0.001)。
3 讨 论
近年来,肿瘤血管生成在肿瘤发展及抗血管治疗肿瘤中的重要地位得到普遍认可,血管生成是指来自于已有血管的新的毛细血管的形成,是原发性或者转移恶性肿瘤持续生长的必要条件[6]。肿瘤生成的新生血管不同于其他非肿瘤性组织中的新生血管,与正常内皮细胞相比更脆弱和不规则,同时通透性和增殖性都更强。MVD是实体肿瘤生长、转移、预后的指标之一,却只能在术后获得。CD34是作为血管内皮细胞标记物,特异度较高,与相应内皮细胞通过抗体结合,反映微血管密度状况。目前许多学者通过研究肿瘤微血管密度反映肿瘤微血管生成[7]。采用单克隆抗体拮抗VEGF与HIF-1α可以进一步评价血管轮廓。
在特定微环境中,非血管细胞如巨噬细胞、纤维母细胞和肥大细胞可通过分泌大量血管生成因子调节血管生成,这些因子中最常见的是纤维母细胞生长因子、血管生成素、转化生长因子-β(transforming growth factor-β,TGF-β)和VEGF。尽管VEGF表达增高的机制不是很清楚,但转录和转录后调节功能已被认可[8]。HIF-1α是第一个被研究与VEGF转录调控有关的因子,HIF-1α是HIF-1的一个功能亚基,是具有bHLH-PAS结构的异质二聚体转录因子,在肿瘤细胞克隆选择、缺氧适应、糖酵解和血管生成中具有重要作用[9]。HIF-1α的mRNA水平在常氧和缺氧下近乎相等,但在缺氧状态下可通过泛素-蛋白酶体途径抑制氧气依赖HIF-1α蛋白降解。有研究显示HIF-1α被VHL肿瘤抑制基因产物调控[10]。与HIF-1β异二聚作用后,HIF-1结合于缺氧反应元件的DNA,从而激活VEGF因子,VEGF是HIF-1α重要目标基因之一,是一种重要的血管生成刺激物。本研究中,HIF-1α在前列腺癌中较前列腺增生组织中明显高表达,表明HIF-1α在前列腺癌中的潜在角色,HIF-1α表达受抑制后,肿瘤血管生成减少,细胞缺氧,组织坏死,乃至凋亡。因而,HIF-lα有可能成为前列腺癌靶向治疗的新位点。
HIF-1α参与多种肿瘤生物学行为,包括促进肿瘤细胞增殖和血管生成,增强肿瘤细胞侵袭能力[11]。HIF-1α表达增高在人类许多原位和远处转移恶性肿瘤中都有发现,目的是适应缺氧环境。非小细胞肺癌中HIF-1α表达增高常见,与肿瘤大小、淋巴结转移和病理分期等病理参数进展有关,同时也意味着不良预后[11]。HIF-1α与宫颈癌不良预后及消化道癌症对放疗不敏感有关。HIF-1α表达增高正性调节VEGF途径,在子宫内膜癌和尿路上皮癌中也发现HIF-1α可增加微血管密度和不良预后风险[12]。HIF-1α累积意味不良的总体生存率和无瘤生存率。
本研究中,前列腺增生组织VEGF阳性表达率显著低于前列腺癌组织,VEGF与MVD计数正相关。VEGF是一种糖蛋白二聚体,分子量约为46 kD,由肿瘤细胞合成、分泌。血管内皮细胞在其作用下进行有丝分裂、增殖,肿瘤组织血管加速生长,导致肿瘤进展;同时,VEGF通过增强血管通透性,促进肿瘤细胞局部进展[13],新生血管在促进肿瘤细胞生长同时可分泌VEGF等细胞因子[14]。由此,血管生成与肿瘤细胞生长、发展互为因果。
本研究中,所有恶性肿瘤及大部分良性增生中均可发现VEGF染色,有研究者猜测在整个良性肿瘤过程中VEGF诱导新血管生成,如前列腺增生,在恶变前保持渐进进展,但并非所有研究者赞同这一观点。血管生成在前列腺癌中精确作用目前尚未阐明[15]。
本研究显示VEGF和HIF-1α在前列腺癌组织中的表达具有相关性,表明HIF-1α在肿瘤血管生长和进展中的重要作用,依此,我们认为HIF-1α可能成为前列腺癌抗血管生成治疗新的靶点。通过MVD定量分析新生血管,尽管MVD在前列腺癌中的平均值高于前列腺增生,但40%的前列腺增生显示高MVD,所以我们推断血管生成在前列腺增生的生长发展中一样起着重要作用。
[1]Spinu D,Mischianu D,Surcel M,et al.Immunological investigations in prostatic pathology-a prospective study[J].Roum Arch Microbiol Immunol,2014,73(1-2):51-55.
[2]Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[3]韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330-334.
[4]赫捷,陈万青.2012中国肿瘤登记年报[R].北京:军事医学科学出版社,2012.
[5]Weider N,Semple J P,Welch W R,et al.Tumor angiogenesis and metastasis-correlation in invasive breast cancer[J].Engl J Med,1991,324:1-328.
[6]Hanson J A,Hsu F P,Jacob A T,et al.Antivascular endothelial growth factor antibody for treatment of glioblastoma multiforme[J].Perm J,2013,17(4):68-74.
[7]张奎美,纪新强,徐平平.卵巢上皮性癌中APE/Re-f1的表达及与VEGF和MVD的关系[J].肿瘤基础与临床,2009,22(1):11-14.
[8]Forsythe J A,Jiang B H,Iyer N V,et al.Activation of vascular endothelial growth factor gene transcription by hypoxia inducible factor-1[J].Mol Cell Biol,1996,16:4604-4613.
[9]Zhong H,Hanrahan C,Van der Poel H,et al.Hypoxia-inducible factor 1a and 1β proteins share common signaling pathways in human prostate cancer cells[J].Biochem Biol Res Comm,2001,284:352-356.
[10]Iyer N V,Kotch L E,Agani F,et al.Cellular and developmental control of O2homeostasis by hypoxia-inducible factor-1α[J].Genes Dev,1998,12:149-162.
[11]Semenza G L.HIF-1 mediates metabolic responses to intratumoral hypoxia and oncogenic mutations[J].J Clin Invest,2013,123(9):3664-3671.
[12]Theodoropoulos V,Lazaris A C,Sofras F,et al.Hypoxia-inducible factor-1α expression correlates with angiogenesis and unfavorable prognosis in bladder cancer[J].Eur Urol,2004,46:200-208.
[13]Jussila L,Alitalo K.Vascular growth factors and lymph angiogenesis[J].Physiol Rev,2002,82(3):673-700.
[14]Hamada J,Cavanaugh P C,Lotan O.Separable growth and migration factors for large-cell lymphoma cells secreted by micro vascular endothelial cells derived from target organs for metastasis[J].Br J Cancer,1992,66(2):349.
[15]Stefanou D,Batistatou A,Kamina S,et al.Expression of vascular endothelial growth factor(VEGF)and association with micro vessel density in benign prostatic hyperplasia and prostate cancer[J].In Vivo,2004,18:155-160.
[责任编辑:李蓟龙 英文编辑:谢利峰]
Expressions of HIF-1α in Hyperplastic and Malignant Prostate Tissue
DUAN Chuan-jun1,YANG Zhen-zhong2,FA Wen2
(1.Department of Urology,Xinhua Hospital,Huainan 232052,China;2.Department of Pathology,Xinhua Hospital,Huainan 232052,China)
Objective To investigate the role of HIF-1α in patients with prostate cancer(PCa).Methods Seventy(70)prostatic tissue samples were immunohistochemically evaluated,while the micro-vessel density(MVD)was calculated by CD34 immunostaining;the percentage of cells with cytoplasmic VEGF reactivity was recorded;and HIF-1α immunoreaction was recognized through nuclear staining of positive cells.Results CD34,VEGF and HIF-1α staining reactions were significantly higher in the PCa group than those of BPH group.In both groups,an interrelationship between the immunoexpression of CD34 and HIF-1α,VEGF and HIF-1α,as well as VEGF and CD34 was detected.Conclusion MVD,VEGF and HIF-1α were more prominent in PCa than in benign prostate hyperplasia (BPH).
prostate cancer;tumor angiogenesis;hypoxia-inducible factor-1α;vascular endothelial growth factor
安徽省淮南市科技攻关计划项目(No.485)
段传军(1974-),男,副主任医师,研究方向:微创泌尿外科。
R 737.25
A
10.3969/j.issn.1673-1492.2015.05.016
来稿日期:2015-07-25

