运动训练对小鼠心肌线粒体miR-499-CaN-Drp-1凋亡通路的影响*
赵永才
(唐山师范学院体育系, 河北 唐山 063000)
运动训练对小鼠心肌线粒体miR-499-CaN-Drp-1凋亡通路的影响*
赵永才△
(唐山师范学院体育系, 河北 唐山 063000)
目的:本文考察游泳训练对小鼠心肌miR-499和相关蛋白的影响,探讨运动干预心肌凋亡的机制。方法:雄性C57BL/6小鼠随机分为3组(n=14):安静组(SE组)、运动训练1组(ET1组)、运动训练2组(ET2)。SE组不运动,ET1组进行8周游泳训练;ET2组在ET1组负荷基础上增加,前5周与ET1相同,后3周每天2次。TUNEL检测心肌凋亡,RT-PCR和Western blot测定miR-499和蛋白。结果:相比SE组,ET1组心肌凋亡指数(AI)、miR-499、CaN蛋白表达及活性、Drp-1表达均无显著性改变(P>0.05);相比SE组,ET2 组AI显著性下降(P<0.01),miR-499表达显著性升高(P<0.05),Drp-1蛋白表达显著性下降(P<0.01),但CaN蛋白表达及活性无显著改变(P>0.05)。结论:游泳训练能降低心肌凋亡水平,Drp-1表达下降是凋亡率下降的部分机制,但本研究上游CaN不参与运动调节心肌凋亡的信号。
运动;心肌;线粒体;微小RNA;凋亡;小鼠
细胞凋亡是由基因控制细胞主动性死亡过程,伴随DNA早期降解、染色质浓缩、细胞碎裂。尽管心肌细胞为终末分化细胞,但凋亡在心肌细胞同样发生。近年研究表明,心肌细胞虽存在一定水平的增殖能力[1],但这种低水平的增殖并不能有效补偿心肌的凋亡流失,因此病理生理因素引发的高水平凋亡在心脏病理、生理发展过程中起到重要作用,也是各类心肌病,如心梗、病理性肥大等由代偿性向病理性转化的细胞学基础[2]。目前认为线粒体是调节内源性心肌凋亡的关键细胞器,心肌线粒体处于分裂、融合动态过程中,线粒体过多分裂是内源性凋亡通路必要途径,促进细胞色素c释放和Caspase蛋白激活,动力相关蛋白1(dynamin-related protein-1, Drp-1)是引发线粒体分裂的一种关键蛋白,其表达含量和修饰水平在心肌线粒体分裂和促凋亡过程中起重要作用[3]。目前发现心肌上游microRNA-499(miR-499)直接以钙调神经磷酸酶(calcineurin, CaN)为靶目标,抑制CaN表达,而CaN对Drp-1的去磷酸化作用是促进Drp-1线粒体膜定位,加强心肌线粒体分裂,引发凋亡产生的机制之一,即心肌miR-499可通过抑制CaN来控制Drp-1分裂线粒体,对抗心肌凋亡[4]。心肌线粒体凋亡途径存在miR-499-CaN-Drp-1调节通路,运动对此通路有何影响还不知晓,本文考察游泳运动对miR-499-CaN-Drp-1信号通路的影响,探讨运动干预心肌凋亡的分子机制。
1 材料与方法
1.1 实验动物及分组
雄性C57BL/6小鼠,8周龄,平均体重为(17.0±1.8)g,北京维通利华实验动物公司提供。本研究动物在运动生理实验室动物房常规饲养,小鼠先适应性喂养1周,标准普通饲料喂养,昼夜节律人工光照控制,每天光照12 h。自由饮食和饮水,分笼饲养。随机分为3组(n=14):安静组(sedentary group, SE)、训练组1 (exercise training group 1, ET1)、训练组2 (exercise training group 2, ET2),各组小鼠运动训练前体重无显著性差异。
1.2 运动训练安排
小鼠先适应性喂养1周,学习游泳运动,适应游泳环境。正式训练开始后,SE组不做运动;ET1组进行8周递增负荷游泳训练,5天/周,每天训练1次,第1周每次时间安排为30 min,以后每周增加10 min,第7和第8周游泳时间维持在90 min;ET2组进行8周训练,5天/周,前5周和ET1组训练模式相同,后3周每次游泳时间和ET1组也一样,但每天训练2次,时间间隔至少6 h。
1.3 样本处理
最后一次训练结束24 h后,所有小鼠提取心肌,每组随机选取7样本用于TUNEL检测,多聚甲醛固定,石蜡包埋,切片6张,厚度4 μm备用,剩余部分样本研磨离心,测定CaN活性;每组剩余7样本心肌漂洗后液氮速冻,-80℃低温保存,用于RT-PCR和Western blot检测。
1.4 TUNEL凋亡检测方法
按照试剂盒说明操作(Cat.No. G7130, Promega)。组织切片进行二甲苯常规脱蜡2次,梯度浓度酒精水化处理,0.85%浓度NaCl冲洗5 min,PBS 冲洗每次5 min,4%浓度多聚甲醛固定15 min,PBS 冲洗两次,每次5 min,20 μg/ml蛋白酶k室温孵育30 min,PBS 冲洗两次,每次5 min,4%多聚甲醛固定10 min,PBS 冲洗两次,每次5 min,Equilibration Buffer 室温平衡10 min,rTdT反应液37℃孵育60 min,2×SSC溶液洗涤15 min。PBS冲洗,3% H2O2室温封闭10 min,PBS冲洗,Streptavidin HRP (1∶500 PBS稀释),室温孵育30 min,PBS冲洗两次,DAB显色,室温显色,控制显色时间,终止反应后苏木精复染核5 min,常规梯度酒精脱水,封片。对切片随机5个视野进行观察,正常细胞核呈蓝色,阳性细胞核根据凋亡程度不同呈现棕色或棕褐色,统计凋亡细胞和正常细胞的数量,阳性细胞与总细胞比值计算凋亡指数(apoptotic index, AI)。
1.5 miR-499检测
1.5.1 引物设计及miRs逆转录 RT-PCR技术测定心肌miR-499,利用Primer 5.0引物设计软件根据miR-499和内参的序列设计反转录引物及扩增引物,以U6作为内参,引物序列具体见表1。按照RNA提取试剂盒要求操作(Invitrogen公司)提取心肌总RNA,并检测RNA质量,OD260/OD280>1.8,符合RNA检测要求,取100 ng RNA利用miRs-Stem-Loop反转录引物进行cDNA的合成。
1.5.2 RT-PCR反应 PCR反应过程包括以下试剂:Power SYBR Green PCR Master Mix 10 μl(内含DNA聚合酶、Buffer、dNTP、SYBR Green),miRs cDNA 1 μl,miRs通用下游引物(10 μmol/L) 0.5 μl,miRs特异性上游引物(10 μmol/L) 0.5 μl,Nuclease-Free Water 8 μl,总反应体积20 μl,进行40个反应循环,反应条件:95℃变性10 min;95℃15 s;60℃1 min。使用7900HT Fast荧光定量PCR仪(ABI公司),系统自动获取指标有:检测样品CT值、△CT值和融解曲线。miR-499表达水平采用2-ΔΔCT公式计算,CT代表PCR反应检测到的荧光强度值显著大于背景值的循环数,△CT代表样品Ct值减去同一样品内参基因(U6)Ct值得到的差值,ΔΔCT代表上述实验样品△Ct值减去对照样品△Ct的差值。
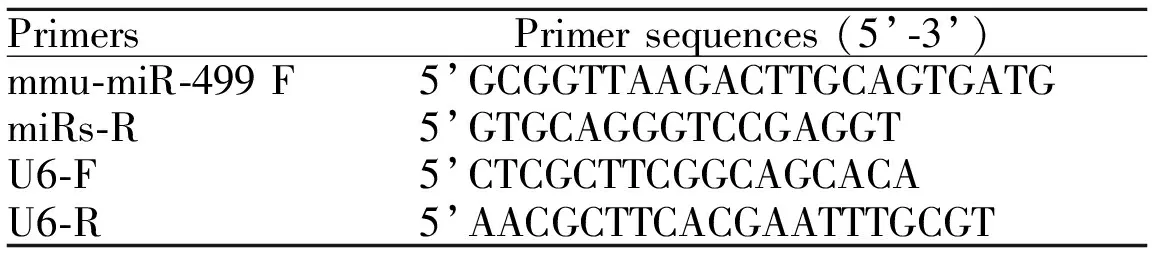
Tab. 1 The primers of miR-499 and U6
1.6 Western blot检测蛋白
从肌组织提取蛋白,样品与RIPA buffer(碧云天生物公司)混合,在冰上培养20 min,12 000×g离心20 min。蛋白样品上样,浓缩胶浓度为5%,分离胶浓度为8%,120 V电泳50 min。电泳结束后将包含目的蛋白在内的蛋白转印至PVDF膜(Millipore),然后将PVDF 膜浸入5% 脱脂奶粉中封闭2 h。4℃一抗孵育过夜,CaNA抗体1∶1 000 稀释(Santa Cruz: sc-9070),Drp-1抗体1∶1 000 稀释(CST: 8570S),GAPDH抗体1∶10 000稀释(康成生物),洗膜完后过氧化物酶标记二抗,37℃环境孵育60 min。ECL试剂(碧云天生物公司)作用于PVDF膜上,然后于暗室中显影并定影,使用凝胶成像系统半定量分析灰度值确定目的蛋白表达的相对量。对所得灰度比值进行转化,以SE组均值为1,观察另两组的表达。
1.7 心肌组织CaN活性检测
比色法测定心肌组织CaN活性,操作按照试剂盒说明书进行(南京建成生物工程研究所),心肌组织制成5%的组织匀浆,取上清液,进行酶促反应,再进行定磷操作,然后加稳定剂,混合液室温静置5 min,分光光度计测定标准管、测定管及空白对照管吸光度值,计算CaN活性,同时测定总蛋白浓度进行校正。
1.8 统计学处理
2 结果
2.1 TUNEL凋亡检测结果
研究发现ET1组训练后心肌细胞AI (2.41±0.56)%与SE组AI (2.26±0.55)%比较无显著性差异(P>0.05);而ET2组训练后心肌细胞AI (1.45±0.39)%非常显著地低于ET1组和SE组(P<0.01),结果显示ET2组训练负荷能显著降低细胞凋亡水平(图1)。
Fig. 1 Effects of swimming training on myocardial apoptosis demonstrated by TUNEL assay. Representative images of myocardium sections in SE (A), ET1 (B) and ET2 (C). Apoptotic index evaluated by TUNEL assay (D) SE: Sedentary group; ET1: Exercise training group 1; ET2: Exercise training group 2**P<0.01vsSE;##P<0.01vsET1
2.2 运动训练后心肌miR-499表达结果
总RNA提取后电泳正常,miR-499 PCR反应溶解曲线呈一个波峰,属于特异性扩增,扩增曲线也正常,引物设计和操作均符合要求(图2)。两个运动组miR-499表达变化不同,相比SE组,ET1组miR-499表达有提高趋势,但无显著差异,而ET2组提高幅度较大,显著高于SE组 (P<0.05, 表2)。
Fig. 2 miR-499 RT-PCR process and Gel electrophoresis image A: Electropherogram of Total RNA; B: Representative image of RT-PCR

GroupCaNactivitymiR⁃499expressionSE0.42±0.111.22±0.12ET10.49±0.181.27±0.45ET20.55±0.211.65±0.31∗
Unit of measurement of CaN activity is umolPi/(mg prot·hour)
SE: Sedentary group; ET1: Exercise training group 1; ET2: Exercise training group 2
*P<0.05vsSE
2.3 运动训练后心肌CaN、Drp-1蛋白表达及活性变化
结果显示CaN蛋白总体变化不显著,相比SE组,ET1组下降9%,但ET2却上升11%,但都不具有统计意义;而Drp-1表达变化均下降,相比SE组,ET1组下降幅度为17%,但无显著性,ET2下降了36% ,具有非常显著性差异(P<0.01,图3);另外对CaN活性进行检测, ET1、ET2组CaN活性呈升高趋势,但相比SE组均无显著性差异(表2)。

Fig. 3 Effects of swimming training on levels of CaN and Drp-1 proteins(n=7) A: Comparison of CaN levels; B: Comparison of Drp-1 levels; C: Representative blots of proteins**P<0.01vsSE
3 讨论
运动生理学领域多考察运动训练对心肌的保护效应,例如发现运动训练后的大鼠在一次急性运动后心肌的丙二醛相对更少,谷胱甘肽更多,认为运动训练可以延长大鼠一次运动时间,推迟疲劳的发生[5]。关于运动与心肌凋亡关系的研究相对较少,而且现有相关研究着重考察Bcl-2家族蛋白对各类运动的适应,间接评价运动和心肌凋亡的关系。有研究[6]认为高脂膳食导致大鼠心肌正常形态丧失,心肌细胞凋亡增加,但茶多酚补充和耐力训练分别可降低Bax/Bcl-2比值,认为运动训练有改善心脏损伤的效应,但此类研究缺乏凋亡指数检测。本研究首先考察心肌凋亡指数(AI)的变化,发现ET1组AI无显著性变化(P>0.05),而ET2组AI明显下降(P<0.05),表明ET1组训练强度可能相对较小,不能对心肌凋亡产生干预,ET2组训练负荷使凋亡指数显著下降,对心肌凋亡有抑制作用,ET2组训练负荷能产生良好心肌保护效应。
检索关于心肌凋亡指数与运动关系的研究,有研究[7]安排肥胖大鼠进行8周中等强度游泳训练,TUNEL凋亡检测发现肥胖游泳组心肌凋亡细胞显著减少,而且肥胖抵抗组大鼠也存在这样的规律,认为适量运动训练可以降低心肌凋亡水平。黄志辉[8]等人的研究发现游泳训练能够降低老年大鼠心肌的凋亡指数。本研究针对小鼠的研究也发现同样现象,总体可认为适量运动训练能降低心肌凋亡。
miRs是一类约22nt长的非编码RNA,与mRNA进行互补结合促进其降解或抑制蛋白质合成,对靶基因形成转录后调节。研究发现肌球蛋白重链(MHC)基因内含子能够转录合成特定miRs,α-MHC(Myh6)内含子转录miR-208a,β-MHC(Myh7)内含子转录合成miRNA-208b,而miR-499由第三种肌球蛋白重链Myh7b内含子转录。研究[4]发现心肌miR-499直接以CaN为靶目标,无论是α-催化亚基(CaNA-α) 还是β-催化亚基(CaNA-β),miR-499都可与其mRNA结合,翻译受抑。缺氧等刺激可诱导CaNA表达增加,促进心肌凋亡的产生,如果升高miR-499表达,CaNA表达显著下降,心肌凋亡减少。CaNA促进凋亡与其促进心肌胞浆Drp-1去磷酸化有关,降低CaNA含量,Drp-1去磷酸化水平下降,细胞凋亡减少。Drp-1近年是研究热点,Drp-1去磷酸化后可在线粒体膜与Bax集合定位,促进线粒体膜破裂,易引发Caspase激活和细胞色素c释放[9]。
本研究发现ET2游泳负荷显著提高了miR-499表达(P<0.05),说明生理状态下,游泳训练能使心肌miR-499产生适应性升高。miR-499表达升高能够对下游靶基因产生转录后抑制,但检测发现ET1组和ET2组CaNA表达分别呈现下降和升高趋势,并无显著性差异(P>0.05),并未产生预期下降的变化。目前认为单个miRs可以同时抑制多个靶基因,但同一个靶基因也可被多个miRs抑制[10],因此CaNA转录后翻译可能被多个因素控制,这可能是CaNA变化和miR-499变化不同步的原因,另外还发现两组CaNA活性变化也不明显,表明CaNA对本次运动负荷不敏感。考察发现CaNA下游的Drp-1对游泳训练负荷较敏感,ET1组下降不明显,但ET2组下降具有显著性(P<0.01),表明其对心肌细胞促线粒体分裂的潜力下降,这和ET2组凋亡指数显著下降相符合。本次研究总体上ET1组训练对miR-499、CaNA和Drp-1表达无显著影响,而ET2组尽管CaNA无论蛋白表达或活性均无明显改变,但miR-499升高和Drp-1明显下降和凋亡信号抑制是相符合的,这可能是ET2组心肌凋亡降低的机制之一。
值得关注的是,Drp-1去磷酸化转位至线粒体外膜,促进线粒体分裂后,Drp1 重回胞浆,循环反复[4]。Drp-1磷酸化和去磷酸化状态在心肌胞浆中都存在,而只有去磷酸化的Drp-1能聚集并剪切外膜,分裂线粒体。本次研究测定的是胞浆总Drp-1,ET2组训练后虽然CaNA变化不显著,但Drp-1表达含量下降,其总体去磷酸化储备潜能是下降的,以后研究可以增加对训练后心肌线粒体膜定位Drp-1的测定,更精确了解其变化规律。
本研究未发现CaN对运动产生变化,有研究发现12周游泳训练使大鼠产生心肌肥大,CaN活性和NFAT转运均无显著性改变[11]。而Wilkins 等人[12]的运动性心脏肥大模型中,同样没有发现CaN和NFAT的信号改变,但病理性心脏肥大上述信号显著增强。上述研究认为游泳训练不能影响心肌CaN活性,本次研究与其结果类似,发现游泳训练对CaN无显著性影响,Drp-1明显下降,凋亡发生率下降,说明本研究中,CaN可能不参与凋亡调节。
综上所述,游泳训练能降低心肌凋亡水平,同时显著提高miR-499表达,降低Drp-1表达,这可能是降低凋亡的分子机制之一;但本研究中,运动干预心肌凋亡通路下游Drp-1与上游miR-499和CaN关系不密切,此运动模式下,CaN可能不参与凋亡调节。
[1] Porrello ER, Johnson BA, Aurora AB,etal. MiR-15 family regulates postnatal mitotic arrest of cardiomyocytes[J].CircRes, 2011, 109(6): 670-679.
[2] Yang B, Ye D, Wang Y. Caspase-3 as a therapeutic target for heart failure[J].ExpertOpinTherTargets, 2013, 17(3): 255-263.
[3] Suen DF, Norris KL, Youle RJ. Mitochondrial dynamics and apoptosis[J].GenesDev, 22(12): 1577-1590.
[4] Wang JX, Jiao JQ, Li Q,etal. miR-499 regulates mitochondrial dynamics by targeting calcineurin and dynamin-related protein-1[J].NatMed, 2011, 17(1): 71-78.
[5] 朱 磊, 刘洪珍. 壮阳复方中药制剂对运动大鼠心肌组织自由基代谢影响的研究[J]. 中国应用生理学杂志, 2013, 29(4): 356-357.
[6] 罗艳蕊, 梅 涛, 孙景权. 茶多酚及耐力训练对高脂膳食大鼠心肌细胞结构和Bax、Bcl-2表达的影响[J]. 天津体育学院学报, 2011, 26(4): 336-340.
[7] 金 丽, 丁 宁, 杨月琴. 有氧运动对肥胖和肥胖抵抗大鼠心肌细胞凋亡及其它影响的研究[J]. 华中师范大学学报(自然科学版), 2011, 45(3): 456-461.
[8] 黄志辉, 刘 浩, 李宪航. 有氧运动对衰老大鼠心肌、肝脏细胞凋亡及线粒体膜电位的影响[J]. 西安体育学院学报, 2007, 24(1): 78-80.
[9]Wasiak S, Zunino R, McBride HM. Bax/Bak promote sumoylation of DRP1 and its stable association with mitochondria during apoptotic cell death[J].JCellBiol, 2007, 177(3): 439-450.
[10]Cannell IG, Kong YW, Bushell M. How do microRNAs regulate gene expression[J]?BiochemSocTrans, 2008, 36(Pt 6): 1224-1231.
[11]Yeves AM, Villa-Abrille MC, Pérez NG,etal. Physiological cardiac hypertrophy: Critical role of AKT in the prevention of NHE-1 hyperactivity[J].JMolCellCardiol, 2014, 76: 186-195.
[12]Wilkins BJ, Dai YS, Bueno OF,etal. Calcineurin/NFAT coupling participates in pathological, but not physiological, cardiac hypertrophy[J].CircRes, 2004, 94(1): 110-118.
Effects of exercise training on myocardial mitochondrial miR-499-CaN-Drp-1 apoptotic pathway in mice
ZHAO Yong-cai△
(Department of Physical Education, Tangshan Normal University, Tangshan 063000, China)
Objective: To detect the levels of miR-499 and relative proteins in hearts of mice after exercise training, and investigate the mechanism of exercise-regulative apoptosis. Methods: Male C57BL/6 mice were randomly divided into 3 groups(n=14): sedentary (SE), exercise training 1(ET1) and exercise training 2(ET2) group. SE did not do any exercise. ET1 performed swimming training for 8 weeks. ET2 performed the same work as ET1 until the 5th week. Then, mice trained twice a day until the end of training. TUNEL assay was applied to test myocardial apoptosis, RT-PCR and Western blot were used to detect miR-499 and proteins levels respectively. Results: Compared with SE, stress in ET1 failed to affect apoptotic index (AI) and miR-499-CaN-Drp-1 pathway (P>0.05). In contrast, exercise load in ET2 increased miR-499 level, decreased Drp-1 level and AI with statistical significance respectively(P<0.05), but neither CaN expression nor CaN activity was changed significantly(P>0.05). Conclusion: Swimming training can inhibit myocardial apoptosis, and the decrease in Drp-1 may be responsible for the reduced myocardial apoptosis. CaN, the upstream protein, does not participate in exercise-regulative apoptosis.
exercise; myocardium; mitochondria; microRNAs; apoptosis; mice
唐山师范学院科学研究基金项目(2013D03)
2014-10-13
2015-02-12
G804.7
A
1000-6834(2015)03-259-05
10.13459/j.cnki.cjap.2015.03.017
△【通讯作者】Tel: 0315-3863302; E-mail: 1067491223@qq.com

