三氯乙烯对人胚胎干细胞心肌分化的影响和机制*
王 丹, 陈 涛, 王国卿, 姜 岩
(苏州大学医学部, 江苏 苏州 215123)
三氯乙烯对人胚胎干细胞心肌分化的影响和机制*
王 丹, 陈 涛, 王国卿△, 姜 岩△
(苏州大学医学部, 江苏 苏州 215123)
目的:探讨三氯乙烯(TCE)对人胚胎干细胞心肌发育分化的影响。方法:以人胚胎干细胞H9体外心肌定向分化为模型,分化培养液中添加不同剂量的TCE(分别为处理组100 ppb组,1 ppm组,10 ppm组)以及DMSO(对照组)。对诱导后形成的拟胚体以及不同发育阶段的细胞进行检测,通过MTT法测定细胞的生存能力,统计有自主节律跳动的拟胚体的数量;流式细胞仪计数分析细胞分化比例;荧光定量PCR检测心肌特异性基因表达;并应用基因芯片方法初步筛选检测三氯乙烯对心肌细胞钙离子通道相关的基因表达的影响。结果:TCE的三个浓度处理组均未显示细胞毒性,但高浓度组明显抑制向心肌细胞分化,能产生自主节律搏动的拟胚体比例显著降低,同时心肌特异性标记物cTnT表达随剂量的增加而显著降低。在具有自主节律性的拟胚体中,钙离子通路的相关基因表达受到影响。结论:推测TCE通过降低成熟心肌的比例,以及影响心肌细胞中钙离子通道相关基因表达来共同导致心脏发育异常。
三氯乙烯;人胚胎干细胞;心肌分化;基因表达;钙离子通道
人胚胎干细胞(human embryonic stem cells, hESCs)是从早期胚胎的内细胞团中分离出来的具有多向分化潜能的细胞系,具有自我更新和向外、中、内三个胚层细胞多向分化的特性。本研究室的前期工作显示:人胚胎干细胞在生长因子及某些药物小分子的诱导下能够定向分化为心肌细胞,表达心肌特异性抗原并能够自主搏动[1]。随着新检测手段的发展以及人源性胚胎干细胞和诱导性多能干细胞库的建立,干细胞来源的心肌细胞已发展成为心衰、心肌缺血等疾病的细胞移植最佳候选细胞之一,干细胞体外心肌分化也越来越多的用于建立心肌分化发育模型,药物的心肌毒性筛选以及环境毒物的检测等诸方面[2]。
三氯乙烯(trichloroethylene, TCE)是一种工业上应用广泛的有机溶剂,具有较强的脱脂作用,主要用作脱脂剂、萃取剂、溶剂,人体可以通过呼吸道、消化道和皮肤吸收,并可在体内有一定的蓄积,主要蓄积于肝、脑、心脏等器官[3]。2012年国际癌症研究组织(IARC)将TCE从2A类(人类可能致癌物)升级为1类(人类致癌物),其对后代所产生的影响也正在受到关注。动物实验表明TCE暴露可导致动物心脏发育畸形[4,5]。人类流行病学研究表明孕期接触TCE与胎儿先天性心脏病风险增加有关[6,7]。但TCE暴露与先心病的因果关系以及TCE对人胚胎发育过程中的心肌毒性机制尚未明确。目前在用大、小鼠、鸡胚等实验模型的有关TCE产生心肌发育毒性作用的研究结果表明:TCE可干扰钙离子通道相关基因的表达[8]。而动物心肌发育时程、心肌的电生理特点与人有很大的物种差异,因此所得到的结果是否与人心肌发育分化相一致尚需进一步研究。本实验以hESCs的心肌细胞定向分化为模型,通过向培养液中添加不同剂量TCE,观察TCE对心肌发育分化的影响,并检测在此过程中钙离子信号通路相关基因的表达情况,以揭示TCE对于人心肌细胞分化影响的作用机制。
1 材料和方法
1.1 材料与试剂
人胚胎干细胞系H9(购自ATCC),三氯乙烯(TCE)(阿达玛斯,中国上海),DMSO,MTT试剂盒(BOSTER,南京生兴生物公司),RNA试剂盒(天根生化科技有限公司,北京),逆转录试剂盒(biomiga),Power SYBRGreenPCR MasterMix(上海英潍捷基),引物设计合成(苏州金唯智生物科技有限公司),BMP4,VEGF,b-FGF,DKK1,SB(全购自R&D systems,上海),cTnT抗体 (Abcam,上海)。
1.2 实验方法
1.2.1 实验分组 将hESCs细胞分为对照组(DMSO组)和TCE处理组,TCE的处理剂量分别为:760 nmol/L(100 ppb),7.6 μmol/L (1 ppm),76 μmol/L (10 ppm),溶于DMSO。所有的处理组和对照组经过换算保持DMSO浓度一致,实验组和处理组的DMSO浓度均不超过0.1%。
1.2.2 hESCs的培养 培养hESCs于KO-DMEM培养液含有20% Knockout 血清替代物,0.1 mmol/L双抗,2 mmol/L谷氨酰胺,1%(v/v)非必需氨基酸(均购自于Gibco,中国上海)及10 ng/mL b-FGF,置于37℃ 5%二氧化碳培养箱培养。每2天换液,4~5 d用胶原酶IV处理传代。
1.2.3 hESCs的心肌定向分化 定向分化开始前3 d,hESCs培养于铺被Matrigel胶的6孔板以消除饲养层细胞的影响。以开始分化记为分化天数D 0, 依次类推,前7 d进行拟胚体悬浮培养。分化D 0到D 3,添加BMP 42 ng/ml和b-FGF 5 ng/ml,分化D 4到D 7添加DKK1(150 ng/ml) VEFG(10 ng/ml),其中D 4和D 5补加SB 5.4 μmol/L。D 7天后进行贴壁培养直至D 21,光镜观察自主节律搏动拟胚体的出现。
1.2.4 细胞活性测定 收集分化第21天的心肌细胞以及未分化的hESCs,调整细胞悬液浓度(5 000 cells/well,96孔板铺板,按照分组设计添加各自TCE浓度的培养液,5%CO2,37℃孵育48 h,每孔加入10 μl MTT染色液,培养4 h,再加入100 μl Formanzan溶解液,置摇床上30 min使之混合均匀。用酶标仪(Molecular Devices,美国)570 nm测定吸光度。
1.2.5 基因表达检测 收集对照组和不同TCE剂量处理组分化发育的心肌细胞,提取总RNA,定量1 μg 反转录成cDNA,反应参数为25℃ 5 min,40℃ 15 min,85℃ 5 min,后置于-80℃保存备用。应用荧光定量PCR技术检测心肌分化过程中相关基因:Nanog,T,ISL-1,cTnT以及调节钙离子相关基因如Serca2A和Cav1.2的表达。以cDNA为模板,应用引物进行扩增。PCR反应参数,95℃ 10 min,95℃ 15 s,60℃ 60 s,共40个循环,反应体系20 μl。实时荧光定量PCR仪进行扩增反应(美国ABI7500)。
1.2.6 流式细胞分析分化比例 在分化的第21天,收集不同处理组和对照组的细胞,消化洗涤后,加入甲醛固定20 min,而后加入预冷的甲醇溶液(9∶1)破膜,充分洗涤后加入一抗cTnT避光孵育1 h,洗涤3次后加入FITC标记的羊抗小鼠IgG于室温孵育30 min,洗涤后加入0.5 ml PBS重悬细胞,流式细胞仪(Beckman Coulter,美国)检测cTnT阳性细胞率,并用Flow Jo 软件进行数据分析。
1.2.7 心肌钙离子通道相关基因表达检测 应用基因芯片技术检测心肌钙离子通道相关基因Serca2和Cav1.2的表达。收集分化第21天的细胞,用TRIzol法提取总RNA,定量2 μg逆转录成cDNA,再用Cyanine-3-CTP进行荧光标记,进行杂交反应,用激光共聚焦荧光扫描仪(Leica,德国)进行信号检测,ANOVA分析结果。选取表达差异高于2倍的目的基因进一步进行荧光定量PCR验证。
1.3 统计分析
2 结果
2.1 胚胎干细胞向心肌定向分化
随着分化培养时间的推移可以观测到hESC细胞形态发生变化如图1所示,依次经过多能干细胞期、拟胚体悬浮期以及自发节律性搏动的贴壁拟胚体形成期。除形态学变化外,进一步分析在分化过程中阶段特异性基因的表达。在细胞因子的联合诱导作用下由多能性基因(Nanog)的下调表达起始心肌分化,而后按时间推移,依次检测到中胚层特异性基因(T)和心肌前体特异性基因(ISL-1)显著上调,在分化第21天,自主搏动的拟胚体数量达到最大,此时,心肌特异性基因cTnT的表达显著升高(表1,P<0.05,P<0.01)。

Fig. 1 Morphological appearance of phase contrast images of undifferentiated cells, embryoid bodies and beating clusters(Bar=100 μm)
Tab. 1 Analysis of gene expression level during cardiac differetiation

GroupNanogTISL⁃1cTnTDay01111Day70.62±0.21∗5.32±0.40∗∗5.53±1.50∗2.44±0.67Day140.26±0.01∗∗2.58±0.25∗12.48±2.77∗∗29.23±5.80∗Day210.13±0.08∗∗0.09±0.021.78±0.02107.27±12.60∗∗
*P<0.05,**P<0.01vsDay 0 group
2.2 TCE对细胞的毒性作用
根据环境组织对于饮用水中TCE的测定以及疾病相关性分析,并参考实验动物和其他细胞体外培养致毒实验,本实验选定TCE的作用浓度范围为760 nmol/L(100 ppb),7.6 μmol/L(1 ppm)和76 μmol/L(10 ppm)。MTT比色法显示所检测的浓度对于未分化的胚胎干细胞和终末分化的心肌细胞的细胞活性均不产生明显细胞毒性作用,在10 ppm对于心肌细胞有一定的刺激增殖影响,但差异不显著(图2)。该结果说明所测剂量的TCE不影响细胞活性,因此后续的分化实验中所研究的TCE致毒机制为非细胞毒性致毒。
2.3 TCE对hESCs心肌定向分化的影响
该研究沿用国际标准EST评价指标,以自发节律性搏动的拟胚体形成作为成功的心肌分化的功能标记。对照组在拟胚体贴壁培养的第2天开始出现自发节律性搏动,随着体外培养时间的延长,观测到的拟胚体搏动数目增加,在第21天时,阳性搏动比例达到高峰。在TCE 1 ppm和10 ppm处理组中,自发搏动拟胚体发生的时间较对照组向后推移,同时,这两个剂量组显著抑制了自发节律搏动拟胚体的阳性率(对照组38.33%;100 ppb 组35.33%;1 ppb组9.33%;10 ppb组8.67%,P<0.05,图3A)。以心肌特异性标记cTnT为检测抗体,流式细胞检测显示TCE随剂量增加对心肌分化的抑制程度提高(P<0.05,P<0.01,图3B)。

Fig. 2 Effect of TCE on cellular viability (9 different biological replicates per each condition)
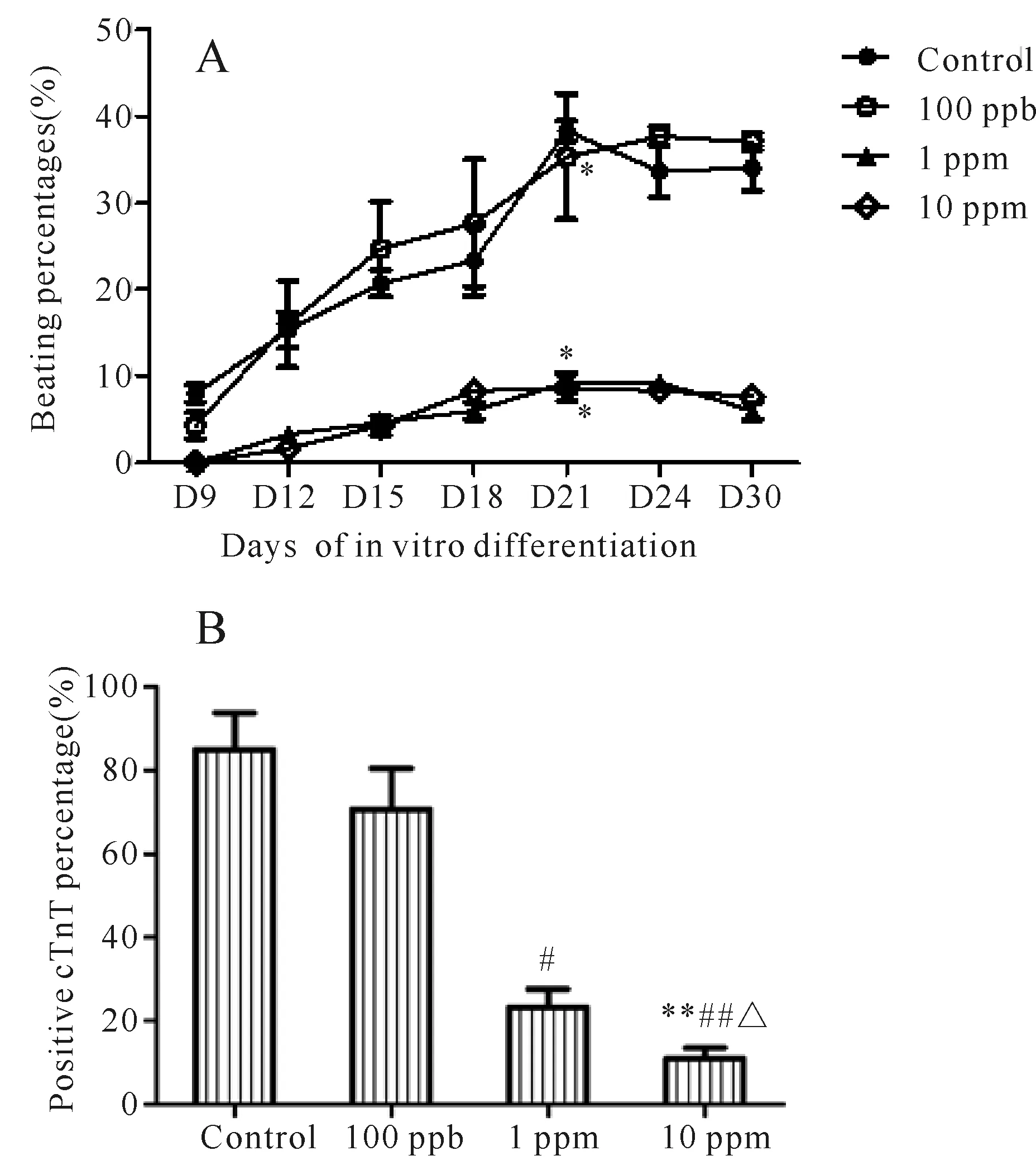
Fig. 3 Differentiation inhibition of hESCs following continuous TCE exposure during cardiac differentiation A: Spontaneous beating percentage during the differentiation period; B: Flow cytometry analysis of cTnT positive cells; hESCs: Human embryonic stem cells; TCE: Trichloroethylene**P<0.01vscontrol;#P<0.05,##P<0.01vs100 ppb;△P<0.05vs1 ppm
2.4 TCE对心肌分化的基因表达影响
胚胎干细胞在BMP4和Actinin及其Wnt信号通路细胞因子的共同作用下启动向心肌细胞的定向分化。TCE对于全能性基因Nanog、中胚层形成相关基因T、心肌前体细胞基因ISL1没有显著影响。但TCE能够显著影响cTnT的表达,并呈现一定的剂量依赖性,说明TCE影响心肌细胞从心肌前体期到成熟心肌分化的转变(P<0.05,P<0.01,表2)。
Tab. 2 Q-PCR analysis of the effect of TCE induced cardiac development related gene expression changes
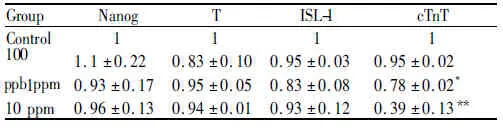
GroupNanogTISL⁃1cTnTControl1111100ppb1.1±0.220.83±0.100.95±0.030.95±0.021ppm0.93±0.170.95±0.050.83±0.080.78±0.02∗10ppm0.96±0.130.94±0.010.93±0.120.39±0.13∗∗
#P<0.05,**P<0.01vscontrol group
2.5 TCE对心肌钙离子通道相关基因表达的影响
将具有自主性节律搏动的心肌细胞进行芯片分析,发现这些能够自主搏动的细胞中与钙离子通道相关的基因数目总体上呈现下调。由于基因芯片的分辨率较低,我们又选取了与钙瞬变相关的两个重要基因Serca2基因和Cav1.2进一步验证显示:Serca2基因和Cav1.2基因转录水平在TCE 1 ppm和TCE 10 ppm组显著受到抑制(P<0.05,图4)。

Fig. 4 Q-PCR analysis of Ca2+signaling related genes expression by TCE treatment TCE: Tichloroethylene*P<0.05vscontrol group;#P<0.05vs100 ppb group
3 讨论
先天性心脏病是先天性畸形疾病中最常见的一种,是由于胚胎发育时期心脏及大血管的形成障碍或发育异常而引起的解剖功能异常,主要由环境因素和遗传因素或者两者共同作用而引起。已有报道显示人怀孕期TCE暴露与先天性心脏病具有相关性,但有关具体的分子机制尚未见报道[6,7]。动物研究中表明TCE主要通过干扰胚胎发育相关基因以及钙离子通路蛋白影响心肌发育[4,8],但人中尚无类似报道。胚胎干细胞在体外可以长期培养传代,并能够在适当的条件下诱导成为包括心肌细胞在内的各种细胞类型,是目前发展起来的对环境致毒物进行安全评价的较好动物替代模型[9]。与传统的实验动物研究相比,进行胚胎干细胞心肌定向为模型其优点在于灵敏度高,可以检测发育过程中不同时期的基因表达细微变化,另外,由于心肌细胞的作用与窦房结,心房,心室的功能极其相似,因此可以反映整个组织的发育特性。
本研究利用人胚胎干细胞体外心肌定向分化模型,探讨TCE对于心肌发育和分化的影响。Dawson在鸡胚中的研究显示TCE暴露减少了心内皮细胞向间充质细胞的转化,导致瓣膜形成障碍,但TCE并不影响心肌细胞的分化[10]。本文的结果显示TCE显著抑制心肌细胞的分化,这与动物研究不一致,推测这个与染毒剂量有关,更与不同物种对于毒物的反应差异性有关。为排除细胞系之间差异,后期需要对更多的人多能干细胞系进行相关研究。另外,本文从基因表达的水平初步发现TCE并不影响全能阶段和中胚层以及前体细胞的分化,但是影响心肌细胞分化。推测TCE影响心肌前体细胞到心肌细胞的分化过程,是否影响心肌前体细胞增殖/分化平衡或者心肌/内皮细胞发育谱系改变,其确切机制尚须进一步研究。外钙内流引发的内钙离子释放是引起心肌细胞收缩的关键因素,动物模型研究显示TCE可干扰肌浆网钙ATP酶以及钙离子电压门控通道相关基因的表达[8]。本实验利用人胚胎干细胞体外定向分化模型研究表明:TCE能够显著的降低钙离子通道相关基因的表达,包括(Serca2A,Cav1.2等),这一结果提示TCE可能通过干扰心肌细胞钙离子通道的开放而影响心肌细胞自主节律性搏动。
综上所述,本研究以人胚胎干细胞为模型揭示了TCE可能通过影响心肌细胞定向分化,以及干扰心肌细胞钙离子通道基因表达介导心脏发育毒性作用。该模型的应用符合现代毒理替代方法的发展方向;对TCE等环境致毒物作用机理的深入研究对于未来先天性心脏病的预防和相关药物的开发治疗提供基础,具有一定的应用前景。
[1] Jiang Y, Habibollah S, Tilgner K,etal. An induced pluripotent stem cell model of hypoplastic left heart syndrome (HLHS) reveals multiple expression and functional differences in HLHS-derived cardiac myocytes[J].StemCellsTranslMed, 2014, 3(4): 416-423.
[2] Matsa E, Denning C. In vitro uses of human pluripotent stem cell-derived cardiomyocytes[J].JCardiovascTranslRes, 2012, 5(5): 581-92.
[3] 胡明霞. 三氯乙烯的毒理学研究新进展[J]. 国外医学卫生学分册, 2001, 28(3): 155-158.
[4] Collier JM, Selmin O, Johnson PD,etal. Trichloroethylene effects on gene expression during cardiac development[J].BirthDefectsResAClinMolTeratol, 2003, 67(7): 488-495.
[5] Loeber CP, Hendrix MJ, Diez De Pinos S,etal. Trichloroe thylene: a cardiac teratogen in developing chick embryos [J].PediatrRes, 1988. 24(6): 740-744.
[6] Chiu WA, Jinot J, Scott CS,etal. Human health effects of trichloroethylene:key findings and scientific issues[J].EnvironHealthPerspect, 2013, 121(3): 303-311.
[7] Yauck JS, Malloy ME, Blair K,etal. Proximity of residence to trichloroethylene-emitting sites and increased risk of offspring congenital heart defects among older women[J].BirthDefectsResAClinMolTeratol, 2004, 70(10): 808-814.
[8] Caldwell PT, Thorne PA, Johnson PD,etal. Trichloroethylene disrupts cardiac gene expression and calcium homeostasis in rat myocytes[J].ToxicolSci, 2008, 104(1): 135-143.
[9] Suzuki N, Ando S, Sumida K,etal. Analysis of altered gene expression specific to embryotoxic chemical treatment during embryonic stem cell differentiation into myocardiac and neural cells[J].JToxicolSci, 2011,36(5): 569-585.
[10]Dawson BV, Johnson PD, Goldberg SJ,etal. Cardiac teratogenesis of trichloroethylene and dichloroethylene in a mammalian model[J].JAmCollCardiol, 1990, 16(5): 1304-1309.
The effects of trichloroethylene on cardiac differentiation in human embryonic stem cells and its mechanisms
WANG Dan, CHEN Tao, WANG Guo-qing△, JIANG Yan△
(Medical Department, Soochow University, Suzhou 215123, China)
Objective: To explore the effects of trichloroethylene (TCE) on cardiac developmental differentiation in human embryonic stem cells. Methods: In this study, based on the human embryonic stem cells in vitro cardiac differentiation assay, we investigated the potential effect of TCE exposure on the cardiac toxicity in embryo development. Human embryonic stem cells were treated with TCE at different concentrations of 100 ppb, 1 ppm, and 10 ppm and dimethyl sulfoxide(DMSO)treated as control. The MTT assay was performed to examine the cytoplasmic toxicity of TCE exposure. The beating percentages were recorded and the expression of cardiac specific gene was evaluated by PCR or flow cytometry. Also, real time PCR was performed to verify the micro array analysis on the expression level changes of genes which were involved in the Ca2+signal pathways. Results: Compared with the control group, there was no significant difference in cell viability when cells were treated with TCE at the concentrations of 100 ppb, 1 ppm, and 10 ppm. However, TCE could inhibit the expression of cTnT protein in a concentration-dependant manner. And the most interestingly, TCE significantly inhibited the cardiac differentiation characterized by the decrease beating percentages. Genes involved in Ca2+signaling pathway were severely disrupted by TCE. Conclusion: TCE inhibited the cardiac specific differentiation of human embryonic stem cell and at the meanwhile the genes responsible for Ca2+signaling pathway were severely disrupted, which could contribute the severe effects of TCE cardiotoxicity.
trichloroethylene; human embryonic stem cells; cardiac differentiation; gene expression; calcium channel
国家自然科学基金项目(81300143);中国博士后基金(2013M541718)
2014-11-13
2015-03-09
R991
A
1000-6834(2015)03-216-05
10.13459/j.cnki.cjap.2015.03.006
△【通讯作者】Tel: 0512-65880127; E-mail: wangguoqing@suda.edu.cn, yjiang@suda.edu.cn

