miR-21与DNA甲基化在不同乳腺癌细胞中的相互作用*
张楹怡, 田卫平, 梅 玫
(天津医科大学基础医学研究中心, 天津 300070)
miR-21与DNA甲基化在不同乳腺癌细胞中的相互作用*
张楹怡, 田卫平△, 梅 玫△
(天津医科大学基础医学研究中心, 天津 300070)
目的:探究不同乳腺癌细胞(MCF-7、MDA-MB-231)中miR-21与DNA甲基化相互调节作用。方法:将荧光标记的miR-21抑制剂及阴性对照瞬时转入MCF-7、MDA-MB-231细胞中,用荧光显微镜观察其转染效率,以Real-time PCR检测miR-21的敲低水平,并以bisulfite-qMSP法检测基因组DNA甲基化水平。同时,以2.5 μmol/L DNA甲基化酶抑制剂5-AZA处理细胞72 h,以单纯二甲基亚枫(DMSO)处理做为阴性对照,观察DNA甲基化改变对miR-21表达水平的影响,接着以Western blot检测miR-21下游基因人第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)、蛋白激酶 B(AKT)蛋白的表达水平。结果:miR-21抑制剂可敲低MCF-7细胞中miR-21的表达水平(P<0.01),并引起基因组DNA甲基化水平的显著升高以及DNA甲基化转移酶Dnmt1、Dnmt3a以及Dnmt3b 的普遍升高(P<0.05,P<0.01)。而在MDA-MB-231细胞中瞬转miR-21抑制剂则引起miR-21表达水平的小幅度升高(P<0.01)以及整体DNA甲基化水平的降低(P<0.05),并伴随有Dnmt3a的升高及Dnmt3b的降低。使用5-AZA处理后发现,其可显著上调MCF-7以及MDA-MB-231细胞中miR-21的表达(P<0.01),并引起其下游基因PTEN在MCF-7细胞内的表达升高,进而下调AKT的蛋白水平。结论:瞬转miR-21抑制剂对MCF-7与MDA-MB-231细胞DNA甲基化水平的调节截然相反,而DNA甲基化的降低则可使miR-21的表达一致上调。本研究可为以后不同类型乳腺癌的临床治疗提供一定的实验依据。
microRNA-21;DNA甲基化;相互作用;乳腺癌
乳腺癌为妇女最常见恶性肿瘤之一。近年来,其发病率呈逐年升高趋势,每年全球范围内新增乳腺癌病例约138万[1],局部地区其死亡率高达40%左右[2]。微小RNA (microRNA,miRNA)是一类长度为19~25 nt的内源性小非编码RNA[3],其可特异识别并结合目标mRNA,促进目标mRNA 的降解或抑制其翻译而负性调控基因的表达[4]。以往研究发现,miR-21作为一种致癌基因在乳腺癌细胞(MCF-7、MDA-MB-231)中表达升高[3, 5],并且这种高表达水平与乳腺癌病人的较差预后密切相关[6],相反敲低miR-21的表达则可显著抑制乳腺癌细胞的体内外生长并增强其对紫杉醇化疗的敏感性[7, 8]。DNA甲基化是以S-腺苷甲硫氨酸提供甲基,在DNA甲基转移酶(DNA Methyltransferase, DNMT)催化下,使胞嘧啶第5位碳原子甲基化而转化为5-甲基胞嘧啶[9]。DNA甲基化的改变亦存在于乳腺癌的发生及其对紫杉醇化疗耐药之中[10]。
miR-21与DNA甲基化在乳腺癌的发生以及其药物化疗过程中均发挥重要作用,然而其二者在乳腺癌中的相互关系却知之甚少。因此,本研究旨在探究乳腺癌细胞中miR-21与DNA甲基化的相互调节关系,以期为深入了解乳腺癌的发生机制及制定合理的化疗方案提供新的理论依据。
1 材料与方法
1.1 细胞株及主要试剂
人乳腺癌细胞系MCF-7、MDA-MB-231购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所,常规培养。miR-21抑制剂购自上海吉玛公司,靶序列为:5’ -UCA ACAUCAGUCUGAUAAGCUA-3’,其阴性对照序列为:5’-CAGUACUUUUGUGUAGU ACAA-3’, TRNzol总RNA提取试剂(Cat# DP405-02)、SuperReal SYBR Green荧光定量试剂(Cat# FP205-02)购自天根生化科技有限公司,SuperScript Ⅲ反转录试剂盒(Cat# 18080-051)、LipofectamineTM 2000转染试剂(Cat# 11668-019)购自Invitrogen公司,EpiTect Bisulfite试剂盒(Cat# 59104)购自QIAGEN公司,5-Aza-2’deoxycytidine(5-AZA) (Cat# A3656)购自SIGMA公司,RIPA组织/细胞裂解液(Cat# R0010)、PMSF(Cat# P0100)、BCA蛋白浓度测定试剂盒(Cat# PC0020)、ECL发光液(Cat# PE0010)均购自北京索莱宝科技有限公司,所有抗体均购自Affinity公司(PTEN: Cat# AF6351,AKT: Cat# AF6259 ,β-actin: Cat# AF7018),DMEM培养基及血清均购自Gibco公司。
1.2 miR-21抑制剂的细胞转染
挑选对数生长期人乳腺癌细胞(细胞,常规胰酶消化,4×105cells/well于无抗生素DMEM培养基中接种于6孔板之中,待细胞融合度达80%左右时,即可用于转染。实验分组为:(1)Naive 组:细胞不做任何处理,培养条件、时间同处理组;(2)阴性对照(NC)组:4 μl LipofectamineTM与4 μg阴性对照(NC)于无血清无双抗DMEM培养基中室温孵育20 min后加入细胞之中;(3)处理(miR-21抑制剂)组:4 μl LipofectamineTM 2000与4 μg miR-21抑制剂于无血清无双抗DMEM培养基中室温孵育20 min后加入细胞之中。转染6 h后,使用无抗生素DMEM培养基对转染细胞进行换液并拍摄荧光照片。转染48 h后收获细胞用以后续实验。
1.3 亚硫酸氢钠(bisulfite)转化基因组DNA
使用传统酚-氯仿抽提法提取基因组DNA,使用EpiTect Bisulfite试剂盒对其进行转化。反应体系包括:500 ng DNA,35 μl DNA保护液以及85 μl转化试剂。反应条件为:95℃ 5 min,60℃ 25 min,95℃ 5 min,60℃ 85 min,95℃ 5 min,60℃ 175 min,反应结束后使用试剂盒自带离心柱对产物进行纯化,用以后续实验或-20℃保存。
1.4 甲基化特异性定量PCR(qMSP)检测基因组DNA整体甲基化水平
LINE-1 是基因组广泛分布的长散布核元件-1( long interspersed nucleotide acids element-1,LINE-1),其在人类基因组的拷贝数大于50万,占人类基因组的18%,因此其甲基化程度可代表核基因组的甲基化程度[10]。β-Actin为内参基因,其扩增片段不含任何CpG位点。引物序列见表1。
1.5 5-AZA处理细胞
挑选对数生长期细胞,2.5 μmol/L DNA甲基化抑制剂5-AZA处理72 h后收集细胞[11]。对照组为相同稀释倍数的DMSO。
1.6 Real-time PCR检测miR-21以及DNA甲基化转移酶Dnmts的表达水平
以TRN-zol氯仿法提取细胞总RNA,使用SuperScript Ⅲ反转录试剂盒合成第1链cDNA,其中除miR-21使用特异性反转录引物以外,其余基因均使用随机引物。Real-time PCR使用SuperReal SYBR Green荧光定量试剂于ABI 7500FAST定量PCR仪进行,反应条件如下:95℃ 热启动15 min, 95℃ 30 s, 60℃ 1 min,40个循环。所有引物序列见表1。使用U6、Gapdh为内参基因,每个样本设3个重复。
1.7 Western blot 检测miR-21目标基因蛋白表达水平

Tab. 1 Primers used in the present study
遵照操作说明书,使用RIPA裂解液提取细胞总蛋白,以BCA试剂盒进行蛋白浓度测定。SDS-PAGE分离蛋白后转至PVDF膜上,封闭1 h。分别加入兔抗人PTEN、AKT和兔抗人β-actin一抗,4℃孵育过夜。辣根过氧化酶标记二抗孵育1 h。ECL发光显色及灰度分析。
1.8 统计学处理
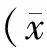
2 结果
2.1 miR-21抑制剂对乳腺癌MCF-7和MDA-MB-231细胞系中miR-21表达的影响
荧光显微镜观察结果(图1)显示, miR-21抑制剂可成功转入MCF-7及MDA-MB-231细胞之中。Real-time PCR进一步检测发现,瞬转miR-21抑制剂可显著敲低MCF-7细胞miR-21的表达水平(P<0.01),而在MDA-MB-231细胞系中,瞬转miR-21抑制剂则可引起miR-21表达水平的小幅度升高(P<0.01,表2)。此结果表明,瞬转miR-21抑制剂在不同乳腺癌细胞系中对miR-21 RNA水平的表达影响略有不同。
2.2 miR-21表达的改变对基因组DNA甲基化水平的改变
为了探究miR-21表达水平改变所引起的基因组DNA甲基化水平的变化,我们检测了LINE-1基因启动子区的甲基化水平进行检测,结果显示在miR-21被显著敲低的MCF-7细胞之中,LINE-1的甲基化水平显著升高(P<0.05)),而在miR-21升高的MDA-MB-231细胞系中,LINE-1的甲基化水平则有较小幅度的降低(P<0.05)。在进一步对Dnmts的检测中发现, MCF-7细胞中Dnmt1(P<0.01)、Dnmt3a(P<0.05)、Dnmt3b(P<0.05)的表达水平均显著升高,而在Dnmt3a(P<0.01)显著升高的MDA-MB-231细胞中则伴随有Dnmt3b(P<0.05)的小幅度降低。这些结果表明,miR-21表达水平的改变可引起基因组DNA甲基化以及Dnmts表达水平发生改变(表3)。
Fig. 1 Transfection efficiency observed using fluorescence microscopy( ×100)
Tab. 2 miR-21 expression level assessed by real-time PCR

GroupMCF⁃7MDA⁃MB⁃231Naive0.92±0.020.18±0.002NC0.98±0.020.20±0.01miR⁃21inhibitor0.15±0.01∗∗##0.24+0.01∗∗##
NC: Negative control
**P<0.01vsnaive group;##P<0.01vsNC group
2.3 甲基化酶抑制剂5-AZA对乳腺癌细胞系中miR-21表达的影响
上述研究结果显示,miR-21可调控乳腺癌细胞基因组DNA甲基化的改变,然而miR-21自身受DNA甲基化调控的情况尚不清楚。因此使用甲基化酶抑制剂5-AZA处理细胞,结果显示5-AZA可显著降低MCF-7及MDA-MB-231细胞基因组DNA甲基化水平(P<0.01),说明细胞处理方法正确有效。同时发现miR-21在两种细胞内的表达水平均有显著升高(P<0.01,表4),表明乳腺癌细胞中miR-21的表达可受DNA甲基化的调控。

Tab. 3 Regulation of DNA methylation by miR-21 inhibitor
NC: Negative control
*P<0.05,**P<0.01vsNC group
Tab. 4 Regulation of miR-21 expression by 5-AZA treatment

GroupMCF⁃7LINE⁃1miR⁃21MDA⁃MB⁃231LINE⁃1miR⁃21DMSO0.65±0.050.75±0.020.97±0.040.28±0.015⁃AZA0.55±0.01∗∗0.90±0.01∗∗0.70±0.05∗∗0.55±0.02∗∗
DMSO: Dimethyl sulfoxide
**P<0.01 DMSO group
2.4 甲基化酶抑制剂5-AZA对miR-21下游基因表达的影响
5-AZA处理之后,MCF-7细胞中PTEN的表达水平有显著增加,进而下调Akt的表达。而二者在MDA-MB-231细胞中则无明显变化(图2)。结果表明,在不同乳腺癌细胞中,5-AZA对miR-21目标基因可发挥不同的调控作用。
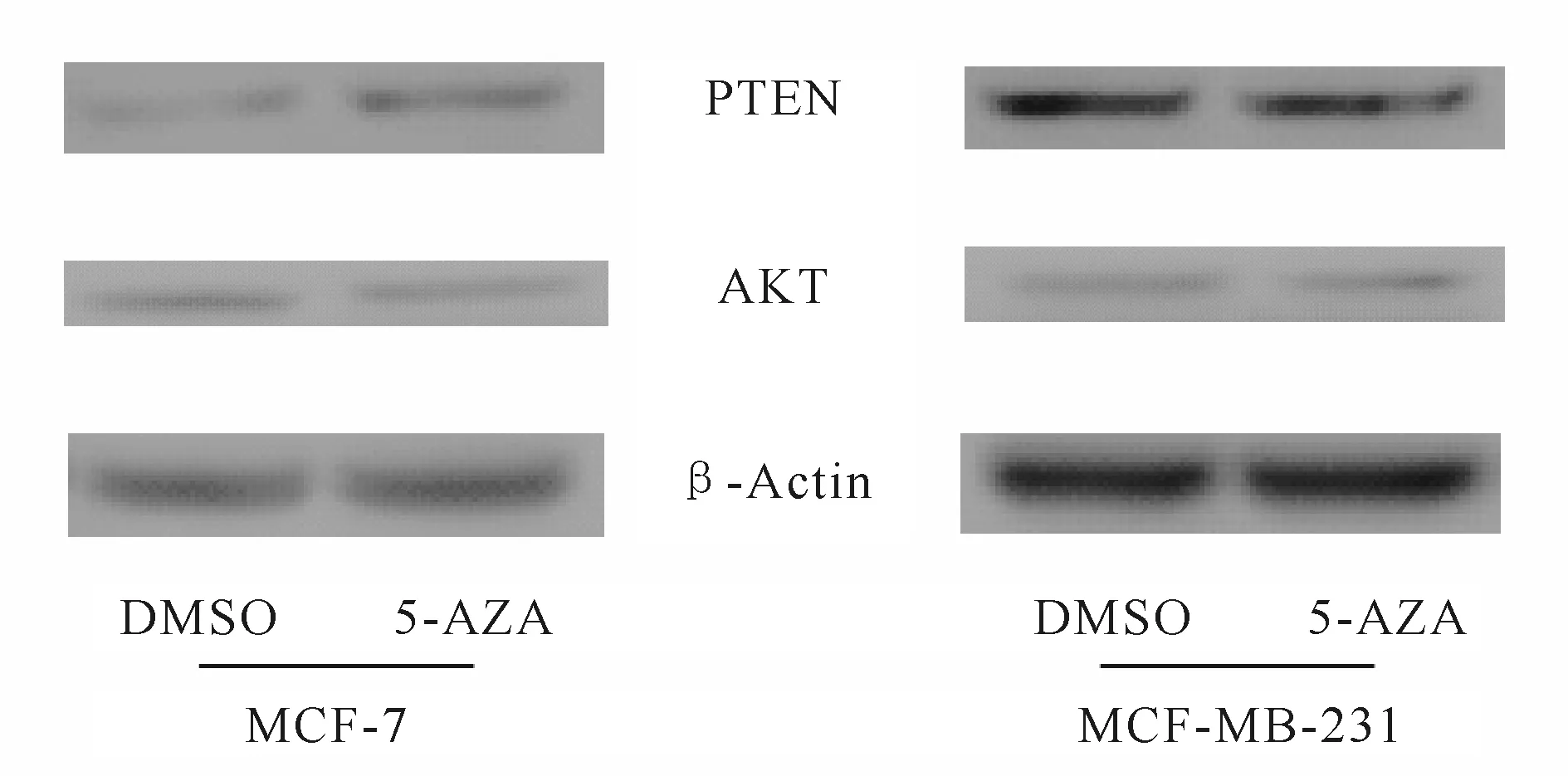
Fig. 2 Effects of 5-AZA on the expression of downstream genes of miR-21 PTEN: Phosphatase and tensin homolog deleted on chromosome; AKT: Protein kinase B
3 讨论
乳腺癌是一类分子表型异质性较高的复杂疾病,根据基因表达的差异,可将其分为至少五种亚型:管腔(luminal)型, 人表皮生长因子受体2(Her-2)过表达型,基底细胞样(basal-like)型以及正常乳腺样(normal-like)型,其中luminal型又分为A、B两个亚型[12]。本研究中所选乳腺癌细胞分别属于luminal A和basal-like型[13, 14],其最大差异为MCF-7细胞为雌激素受体阳性,而MDA-MB-231则为雌激素受体阴性细胞系。实验中,我们瞬转miR-21抑制剂可显著敲低MCF-7细胞系内miR-21的表达,而在MDA-MB-231细胞系中则无明显敲低效果,推测一方面原因可能与MDA-MB-231细胞系本身特性有关,导致miR-21抑制剂与miR-21结合后无法对其进行切割降解,其具体作用机制,有待于后续深入研究;另一方面可能与转染方式有关,瞬转仅可使miR-21抑制剂在细胞内一过性的存在,而不能维持其长时间的作用,故可导致敲除效果出现偏差。
miRNA可通过RNA介导的DNA甲基化途径(RNA-directed DNA methylation,RdDM)沉默目标基因[15],而启动子区的DNA甲基化水平的改变亦可影响miRNA自身的转录[16]。本研究发现敲低miR-21的表达可显著升高乳腺癌MCF-7细胞的DNA甲基化水平,与之对应的是三类DNA甲基转移酶Dnmt1、Dnmt3a以及Dnmt3b的表达均有显著升高。而在miR-21表达水平小幅度升高的MDA-MB-231细胞系中,其DNA甲基化水平则有轻微的下降,同时伴随有Dnmt3a的升高以及Dnmt3b的降低。DNA甲基化无疑是由DNMTs所催化的[17],但是在一些情况下Dnmt3a亦可介导DNA的去甲基化过程[18]。因此,推测本研究中MDA-MB-231细胞的低甲基化可能受升高的Dnmt3a与降低的Dnmt3b同时介导。这些结果表明,在不同乳腺癌细胞系中,瞬转miR-21对DNA甲基化的调控作用不尽相同。同时发现,使用Dnmt抑制剂5-AZA降低基因组DNA甲基化水平,可显著提高MCF-7以及MDA-MB-231细胞中miR-21的表达,表明在不同乳腺癌细胞系中DNA甲基化对miR-21的调控更为一致,亦表明这种调控更为稳定,适用性更广。
以往研究发现,作为miR-21的目标基因,PTEN同时受DNA甲基化的直接调控[19]。PTEN的抑制以及Akt信号通路的激活存在于多种肿瘤的发生过程中[20],本课题组的前期研究发现使用miR-21抑制剂可显著升高乳腺癌细胞中PTEN的表达并有效抑制Akt的表达,进而增强乳腺癌细胞对紫杉醇化疗的敏感性[7]。在本研究中,使用5-AZA处理乳腺癌MCF-7细胞,在提高miR-21表达的同时却不能有效降低PTEN的表达,反而对其表达水平有一定促进作用。表明DNA甲基化的调节在此过程中发挥主要作用,并与miR-21抑制剂作用相仿。进而推测在此过程中,5-AZA发挥主要作用。
综上所述,本研究通过瞬转miR-21抑制剂与DNA甲基化酶抑制剂5-AZA的使用,初步阐述了乳腺癌细胞中miR-21与DNA甲基化的相互调节关系。结果发现瞬转miR-21抑制剂对MCF-7与MDA-MB-231细胞DNA甲基化水平的调节截然相反,而DNA甲基化的降低则可使miR-21的表达一致上调。此外,在对miR-21下游基因的调控中,DNA去甲基化与miR-21抑制剂在MCF-7细胞中表现为相仿的作用,因而本研究可为以后不同类型乳腺癌的临床治疗提供一定的实验依据。
[1] Lee BL, Liedke PE, Barrios CH,etal. Breast cancer in Brazil: present status and future goals[J].LancetOncol, 2012, 13(3): e95-102.
[2] DeSantis C, Siegel R, Bandi P,etal. Breast cancer statistics, 2011[J].CACancerJClin, 2011, 61(6): 409-418.
[3] Marino AL, Evangelista AF, Vieira RA,etal. MicroRNA expression as risk biomarker of breast cancer metastasis: a pilot retrospective case-cohort study[J].BMCCance, 2014, 14: 739.
[4] Lim LP, Lau NC, Garrett-Engele P,etal. Microarray analysis shows that some microRNAi downregulate large numbers of target mRNAs[J].Nature, 2005, 433(7027): 769-773.
[5] Iorio MV, Ferracin M, Liu CG,etal. MicroRNA gene expression deregulation in human breast cancer[J].CancerRes, 2005, 65(16): 7065-7070.
[6] Pan F, Mao H, Deng L,etal. Prognostic and clinicopathological significance of microRNA-21 overexpression in breast cancer: a meta-analysis[J].IntJClinExpPathol, 2014, 7(9): 5622-5633.
[7] Mei M, Ren Y, Zhou X,etal. Downregulation of miR-21 enhances chemotherapeutic effect of taxol in breast carcinoma cells[J].TechnolCancerResTreat, 2010, 9(1): 77-86.
[8] Yan LX, Wu QN, Zhang Y,etal. Knockdown of miR-21 in human breast cancer cell lines inhibits proliferation, in vitro migration and in vivo tumor growth[J].BreastCancerRes, 2011, 13(1): R2.
[9] Chiang PK, Gordon RK, Tal J,etal. S-Adenosylmethionine and methylation[J].FASEBJ, 1996, 10(4): 471-480.
[10]Shi JF, Li XJ, Si XX,etal. ERalpha positively regulated DNMT1 expression by binding to the gene promoter region in human breast cancer MCF-7 cells[J].BiochemBiophysResCommun, 2012, 427(1): 47-53.
[11]Hostetter CL, Licata LA, Keen JC. Timing is everything: order of administration of 5-aza 2' deoxycytidine, trichostatin A and tamoxifen changes estrogen receptor mRNA expression and cell sensitivity[J].CancerLett, 2009, 275(2): 178-184.
[12]Perou CM, Sorlie T, Eisen MB,etal. Molecular portraits of human breast tumours[J].Nature, 2000, 406(6797): 747-752.
[13]Kao J, Salari K, Bocanegra M,etal. Molecular profiling of breast cancer cell lines defines relevant tumor models and provides a resource for cancer gene discovery[J].PLoSOne, 2009, 4(7): e6146.
[14]Holliday DL, Speirs V. Choosing the right cell line for breast cancer research[J].BreastCancerRes, 2011, 13(4): 215.
[15]He XJ, Hsu YF, Zhu S,etal. An effector of RNA-directed DNA methylation in arabidopsis is an ARGONAUTE 4- and RNA-binding protein[J].Cell, 2009, 137(3): 498-508.
[16]Iorio MV, Visone R, Di Leva G,etal. MicroRNA signatures in human ovarian cancer[J].CancerRes, 2007, 67(18): 8699-8707.
[17]Szyf M. Epigenetics, DNA methylation, and chromatin modifying drugs[J].AnnuRevPharmacolToxicol, 2009, 49: 243-263.
[18]Kangaspeska S, Stride B, Metivier R,etal. Transient cyclical methylation of promoter DNA[J].Nature, 2008, 452(7183): 112-115.
[19]Meng F, Henson R, Wehbe-Janek H,etal. MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J].Gastroenterol, 2007, 133(2): 647-658.
[20]Graff JR, McNulty AM, Hanna KR,etal. The protein kinase Cbeta-selective inhibitor, Enzastaurin (LY317615.HCl), suppresses signaling through the AKT pathway, induces apoptosis, and suppresses growth of human colon cancer and glioblastoma xenografts[J].CancerRes, 2005, 65(16): 7462-7469.
Interaction between miR-21 and DNA methylation in different breast cancer cells
ZHANG Ying-yi, TIAN Wei-ping△, MEI Mei△
(Tianjin Research Center of Basic Medical Science, Tianjin Medical University, Tianjin 300070, China)
Objective: To determine the interaction between miR-21 and DNA methylation in different breast cancer cells. Methods: Fluorescence tagged miR-21 inhibitor and its negative control (NC) were transient transfected into MCF-7 and MDA-MB-231 cell, the transfection efficiency was observed using fluorescence microscopy, and the miR-21 expression level and genome DNA methylation status before and after transfection were assessed by real-time PCR and bisulfite-qMSP respectively. To investigate the regulation effect of DNA methylation on miR-21, cells were treated with 5-AZA (2.5 μmol/L) for 72 h, with dimethyl sulfoxide (DMSO) treatment as its negative control (NC), and the expression level of phosphatase and tensin homolog deleted on chromosome ten (PTEN) and AKT(also known as Protein Kinase B), two downstream genes of miR-21 were detected by Western blot. Results: The expression of miR-21 in MCF-7 cell was significantly knocked down (P<0.01) by miR-21 inhibitor, with the genome DNA methylation level (P<0.05) and all the three Dnmts: Dnmt1, Dnmt3a, and Dnmt3b unregulated. In contrast, the miR-21 expression in MDA-MB-231 cell was elevated (P<0.01) by miR-21 inhibitor, meanwhile, downregulated of genome DNA methylation (P<0.05) and Dnmt3b expression, upregulation of Dnmt3a were also observed. In addition, treated with 5-AZA resulted in significant increases of miR-21 expression in both MCF-7 and MDA-MB-231 cells (P<0.01), with the protein level of PTEN increased in MCF-7 cell, which was further involved in the downregulation of AKT. Conclusion: The regulation effects of DNA methylation by transient transfection of miR-21 in MCF-7 and MDA-MB-231 cells are almost opposite, whilst the expression of miR-21 in two cell lines were all upregulated by decreased DNA methylation level. and our results may provide some experimental evidences for the future development of rational therapy for different breast cancer.
microRNA-21; DNA methylation; interaction; breast cancer
天津市科委项目(13JCYBJC21600);天津市教委项目(20130601);天津医科大学项目(2012KYM10)
2015-01-07
2015-03-06
RT37.9
A
1000-6834(2015)03-220-05
10.13459/j.cnki.cjap.2015.03.007
△【通讯作者】Tel: 022-83336530, 022-83336519; E-mail: tianweiping@yahoo.com,meim@tijmu.edu.cn

