双光子显微镜检测活体小鼠脑内微循环技术的建立*
刘双双, 黄继云, 肖桂凤, 尹 伟, 林赵肖楠, 卢应梅
(1. 浙江大学医学院公共技术成像平台, 2. 浙江大学毒理与生化药学研究所, 杭州310058;3. 浙江大学城市学院医学院, 杭州 310015)
双光子显微镜检测活体小鼠脑内微循环技术的建立*
刘双双1, 黄继云2, 肖桂凤1, 尹 伟1, 林赵肖楠1, 卢应梅3△
(1. 浙江大学医学院公共技术成像平台, 2. 浙江大学毒理与生化药学研究所, 杭州310058;3. 浙江大学城市学院医学院, 杭州 310015)
目的:利用正置双光子显微镜系统和荧光探针标记技术,观察活体小鼠脑内血管的三维立体分布,建立测量单根毛细血管血流速度的新方法。方法:麻醉小鼠,制作活体小鼠颅骨开窗样本,尾静脉注射血浆标记物Texas-Red dextran,利用双光子显微镜z序列扫描检测脑内微循环系统的三维分布;利用线扫描测量毛细血管的血流速度。结果:通过双光子显微镜可以探测到脑内500 μm处的血管分布和走向,图像清晰且信噪比高;通过计算单位时间内红细胞的运动距离测得毛细血管(直径≤6 μm)的血流速度为(0.59±0.12) mm/s。结论:利用双光子显微镜观察脑内微循环系统技术平台初步建立,为基础研究和医药应用提供了在体实验依据。
双光子显微镜;大脑皮层;微循环;血流速度
健全的微循环功能是保证大脑执行正常功能的首要前提,当微循环发生障碍时,血液流速减慢易形成血栓,导致局部脑组织缺血、缺氧甚至坏死,引起一系列临床症状。医学研究已证明:人体衰老、高血压、糖尿病及多种心脑血管疾病都与脑微循环障碍密切相关。血液动力学是表征血液循环系统的流动参数,是反映微循环功能变化的重要指标,因此血液动力学变化的检测对于研究脑微血管功能,延缓上述重大疾病发展具有重要意义。
检测微循环血液动力学具有多种方法,传统检测血流的方法有核磁共振、断层扫描和光谱学方法。这些方法能够测定血液流量、氧化作用,但只能测出整体血流量,不能细微到单根血管。后来又有光学检测方法,由于使用的是场光源,使得图像的对比度和分辨率较低,无法实现活体动物在体观察;共聚焦显微镜由于探测针孔的存在,使得成像深度也只有几十个微米,无法深入到活体脑深部进行微血管检测。因此建立精确检测脑微血管系统特别是脑微血管血流参数变化的计数方法具有重要意义。双光子显微镜成像是近年来出现的新技术,具有高信噪比、高穿透性、低漂白性等特性,更适合检测组织中深层结构或者活体内部结构[1]。如果能有效借助于双光子显微镜技术开展相关工作,将为缺血性脑中风、老年痴呆、糖尿病等疾病的机制研究提供实验依据,也将通过探索休止的、激活的、损伤的、新生的脑微血管的调控机制,为开发保护脑微循环的新型药物、防治心脑血管疾病开辟广阔的前景。本工作利用双光子显微镜和荧光染料负载技术观察活体小鼠脑内微循环系统的三维分布,测量脑内单根毛细血管的血流速度。
1 材料和方法
1.1 实验材料
主要试剂:低熔点琼脂糖(Sigma公司),人工脑脊液(mmol: NaCl 125, KCl 3, glucose 10, NaHCO326, NaH2PO41.1, CaCl22, MgSO41),Texas Red dextran(Invitrogen, D1830),70%消毒酒精,水合氯醛,生理盐水,双氧水(上海生工)。
实验动物和设备: 1月龄健康、清洁级Balb/c小鼠,体重18~20 g(购自浙江大学实验动物中心)。正置双光子显微镜(Olymupus正置显微镜, 型号:BX61WI-FV1000,四通道多光子荧光探测器,×25超级消复色差物镜,FV1000驱动软件),MaiTai飞秒激光器(波长690~1020 nm连续可调),脑立体定位仪,盖玻片,眼科弯镊,牙科电钻,脑固定铁圈和长柄铁块。
1.2 小鼠大脑颅骨开窗手术
1.2.1 动物麻醉 选取1月龄的Balb/c小鼠(18~20 g),腹腔注射3%水合氯醛,注射剂量为1.35~1.4 ml/100 g。
1.2.2 开颅前准备 将麻醉的小鼠用剃须刀剃去脑表面的毛发,眼科剪刀剪去头皮,用蘸有双氧水的棉签擦拭脑表面以除去表面的筋膜,然后用蘸有人工脑脊液的棉签擦拭头骨以保持湿润。
1.2.3 颅骨开窗手术 将麻醉的小鼠用脑立体定位仪进行固定,用牙科电钻小心地打磨待观察区域边缘的头骨,开窗区域大约为6×6 mm的圆孔,为了降低出血量,在用电钻打磨过程中,选择中等刃径的钻头,待头骨边缘呈半透明状态后轻轻按压头骨,观察到边缘软化即可停止,用眼科弯镊小心地从边缘夹取头骨将其轻轻地掀掉,此过程要求动作轻微,尽量避免出血,以免影响成像,并用人工脑脊液多次清洗窗口,直至没有血液出现。
1.2.4 开窗区的密封和固定 将配好的琼脂糖凉至室温,滴到开窗的脑表面,上面盖盖玻片(直径为8×8 mm)以抑制呼吸节律对成像产生的影响。用制备好的牙膏粉将铁圈封在盖玻片的外围,保证开孔处在铁圈中央,最后将铁圈固定在长柄铁块上,使成像时老鼠大脑始终固定[2]。
1.3 荧光染料的标记
制备终浓度为0.5 mg/ml 的Texas-Red溶液,尾静脉按0.01 ml/g动物体重注射,15 min后经血液循环进入全身可进行成像。
1.4 双光子显微镜观察
利用Olympus正置双光子显微镜装置进行成像,激发光波长选取860 nm,发射的荧光通过外置探测器接收,使用双色镜(DM560)结合带宽滤色片(575~640)探测血浆发出的荧光。利用z序列扫描观察脑内脉管系统的三维分布,扫描速度为2 μs/pixel,扫描步径为2 μm,图像大小为512×512个像素;利用线扫描测量单位时间内红细胞的运动距离,扫描速度为10 μs/pixel,连续扫描2 000张。
1.5 图像记录和数据处理
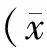
2 结果
2.1 在体双光子成像系统的组成
双光子显微镜系统主要由飞秒激光器、扫描振镜、物镜、探测器、数据采集系统组成。成像流程为:钛-蓝宝石激光器输出脉冲激光,经过反射镜反射到达扩束镜,激光束被调整为强度均匀的平行光束,光束到达扫描振镜,透过二色镜,经过物镜汇聚到样品上,样品被激发后发出荧光,经二色镜反射到达探测器,信号被数据采集系统收集(图1A)。小鼠麻醉后,将其固定在脑立体定位仪上进行颅骨开窗手术(图1B),颅骨开窗后,用牙膏水泥将脑固定圈固定在开窗区外的颅骨上,并通过螺丝将其固定到长柄铁块上(图1C),最后将制备好的动物样本放置在双光子显微镜下进行观察(图1D)。
2.2 脑内微循环的三维立体分布
小鼠颅骨开窗后,尾静脉注射Texas-Red染料,经血液循环到达全身血管,15 min后,将小鼠放置在双光子显微镜载物台上,激发光调至860 nm,调节焦平面选取血管密集区,利用×25物镜进行双光子扫描成像。通过双光子显微镜z序列扫描,探测脑内较深区域的血管分布和走向,通过优化设置,成像深度达到脑内500 μm处,能够清楚的看到脑内血管走向及分支(图2A),其中300 μm以内成像信噪比(S/N)较高。利用共聚焦显微镜成像仅能探测到脑内100 μm处的荧光信号(图2B)。

Fig. 1 Schematic diagram of in vivo two photon imaging and imaging apparatus A: Schematic diagram of two-photon laser scanning microscopy imaging; B: Skull exposure is achieved in a stereotactic frame; C: Brain fixation devices: long handle iron and brain retainer ring; D: Example of an anesthetized mouse during two-photon imaging

Fig. 2 Three-dimensensional reconstruction of cortical vasculatureinvivoA: Three-dimensional reconstruction of cortical vasculature by two-photon microscopy; B: Three-dimensional reconstruction of cortical vasculature by confocal microscopy
2.3 血流速度的量化方法
尾静脉注射Texas-Red后,染料仅能标记血浆而不进入红细胞,利用双光子显微镜进行线扫描时,随着扫描时间的变化,红细胞的运动轨迹形成暗影。如示意图所示(图3A):x轴为红细胞运动的距离,y轴为扫描时间,黑色的圆圈代表红细胞,随着时间变化红细胞的运动形成一条黑色斜线,通过计算单位时间内红细胞的运动距离量化血流速度,红细胞的运动速率表示为Δx/Δt,血流方向为斜率的走向(图3B)。

Fig. 3 Movement locus for red blood cell by two photon microscopy line scanning A: Illustration of red blood cell flow in a capillary; B: Movement locus of red blood cells by two photon microscopy line scanning
2.4 毛细血管血流速度的测定
选取5只健康小鼠(体重20~25 g),在脑内(200~250) μm处选取直径小于6 μm的毛细血管测量血流速度。每只小鼠选取10根血管进行线扫描,扫描速度为10 μs/pix,连续扫描2 000幅,测得的红细胞平均流速为(0.59±0.12)mm/s,血流经线扫描后,斜率越大,单位时间内红细胞的运动距离越短,血流速度越慢;单位长度内阴影越多,红细胞数目越多(图4)。
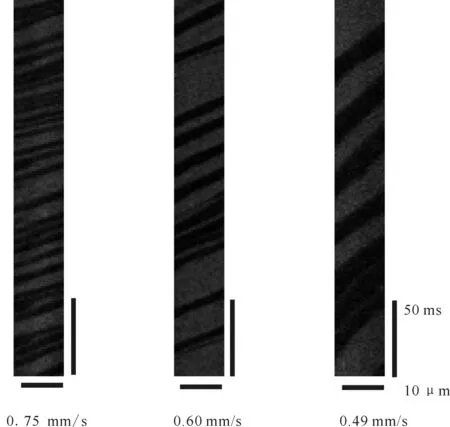
Fig. 4 Red blood cell velocity in capillary by line scanning
3 讨论
与传统的共聚焦显微镜成像方法比较,双光子激发成像有以下优点:(1)长波长的光比短波长的光受散射影响较小容易穿透标本;(2)双光子成像不需要共聚焦针孔,这样就提高了对荧光的吸收率,而收集率的提高使得图像对比度提高;(3)长波长的近红外光比短波长的光对细胞毒性小;(4)使用双光子显微镜观察标本的时候,只有在焦平面上才有光漂白和光毒性,所以双光子显微镜比共聚焦显微镜更适合用来观察厚标本和活体组织[3]。通过光学显微镜或者共聚焦显微镜进行观察,只能在脑表面或者在脑切片上进行,无法深入到活体脑内部观察,科研的发展需要细微到单个血管,跟踪活体小鼠脑内部微循环的变化,双光子显微镜由于其穿透能力强、光毒性小等优势,使得观察活体小鼠脑内循环系统成为可能。
实验结果表明利用双光子显微镜观察活体脑内血管分布和走向,能够得到高分辨率的图像。为了达到最好的成像效果,样本制作过程尽量避免待观察区的出血现象,过多的出血影响成像效果,因此,制备高质量的活体样本是完成实验的关键。通过优化手术过程,调节成像参数,利用双光子专用镜头×25水镜,探测到了活体脑内500 μm处的荧光信号。2011年日本科学家Hiroshi Hama发现了一种新型的透明剂scale,利用这种透明及处理样本后,能达到4 mm的成像深度,使用透明剂的样本需经过固定处理,所以尚未在活体上实现深度成像[4]。
结果还显示通过荧光标记技术,能测出单根血管内红细胞的运动速度。其原理为:尾静脉注射Texas-Red荧光染料后,染料特异性标记血浆,而不进入红细胞,当进行线扫描时,血浆部分发出红色荧光,红细胞则表现为黑色,红细胞随时间变化的运动轨迹形成了一条黑色暗影,通过计算红细胞的运动速度和血管直径量化血流速度。目前量化血流的方式有三种:血流量(血流量=血流速度x 血管直径)、红细胞线性密度(红细胞的线性密度=血流量/血流速度)和红细胞运动速度[5]。血液携带氧气和营养的能力与血流量成正比,检测血流量需要测量红细胞流动速度和血管直径,但是血流速度和血管直径可以各自独立发生改变,所以必须同时测量这两个参数。而测定红细胞运动速度的方法相对简单易行,其应用更加广泛。
利用双光子显微镜成像活体动物脑内结构,虽然能够达到较深的成像深度,但是由于脑内结构复杂,光散射和折射较强,随着脑内深度的增加,成像信号也会越弱,将会形成信号越来越弱的三维结构。为了保持信号强度相对一致,我们通过优化设置,利用双光子显微镜的z-bright功能,随着焦点深度的增加,逐渐增加双光子激光强度,光电倍增管电压值,并将改变的信息进行保存,进行三维扫描时,不同的深度按照保存的信息进行扫描,以保持在较深范围仍然能够得到强度相对均一的信号,获得高信噪比图像。
双光子显微镜技术及其在活体成像记录上的优点为研究复杂的循环系统结构和功能提供了一条新的途径。但是目前也存在一些问题:脑表面大血管血流速度快,线扫描后无法得到单个红细胞运动的阴影,因此测定大血管血流速度还需进一步探索。脑开颅手术过程中,如何减少损伤和感染,使动物能长期存活,实现对血流速度和血流方向的长时间连续监测也值得进一步探索。
[1] Svoboda K, Yasuda R. Principles of two-photon excitation microscopy and its applications to neuroscience[J].Neuron, 2006, 50(6): 823-839.
[2] Mostany R, Portera-Cailliau C. A craniotomy surgery procedure for chronic brain imaging[J].JVisExp, 2008, 15(12): 680.
[3] Helmchen F, Denk W. Deep tissue two-photon microscopy [J].NatMethods, 2005, 2(12): 932-940.
[4] Hiroshi Hama, Hiroshi Kurokawa, Hiroyuki Kawano,etal. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain[J].NatNeurosci, 2011, 14(11): 1481-1488.
[5] Chaigneau E, Oheim M, Audinat E,etal. Two-photon imaging of capillary blood flow in olfactory bulb glomeruli.[J].ProcNatlAcadSciUSA, 2003, 100(22): 13081-13086.
In vivo imaging of blood flow using two-photon laser scanning fluorescent microscopy
LIU Shuang-shuang1, HUANG Ji-yun2, XIAO Gui-feng1, YIN Wei1, LIN Zhao-xiao-nan1, LU Ying-mei3△
(1. the Imaging Center, Core Facilities of Zhejiang University School of Medicine, 2. Institute of Pharmacology, Toxicology and Biochemical Pharmaceutics of Zhejiang University, Hangzhou 310058; 3. Zhejiang University City College of Medicine, Hangzhou 310015, China)
Objective: To observe the three-dimensional distribution of vessels, and to establish a new method for measurement of blood flow velocity in mice cerebral cortex using two-photon laser scanning microscopy and fluorescence probe labeling technique. Methods: The mouse was made cranial window surgery and injected Texas-Red through tail vein after anesthetized. The three-dimensional imaging of vessel was obtained through z-stack scanning, and blood flow velocity was quantified through line scanning. Results: We could detect vascular distribution for more than 500 μm depth using two-photon microscopy. The velocity of blood flow was (0.59±0.12) mm/s in capillary. Conclusion: The method for observing the brain blood flow by two-photon microscopy was established, which could achieve quantification of single vascular blood flow velocity and provide experimental evidence for basic research and medical applications.
two-photon microscopy; cerebral cortex; microcirculation; blood flow velocity
浙江省科技厅分析测试项目(2012C37060,2014C37068);浙江大学实验技术研究项目(SYB201306, SYB201407);中央高校基本科研业务费专项资金资助(519000*72210151)
2014-11-06
2015-03-03
Q334
A
1000-6834(2015)03-245-04
10.13459/j.cnki.cjap.2015.03.014
△【通讯作者】Tel: 0571-88206270; E-mail: lufx@zju.edu.cn

