蝎源活性肽对帕金森病大鼠凋亡因子改变的影响*
徐 红, 安 冬, 殷盛明, 陈 薇, 赵 丹, 孟 旭, 于德钦, 孙艺平,, 赵 杰, 张万琴
(大连医科大学 1. 生理学教研室, 2. 机能实验室, 3. 2012/3级, 辽宁 大连 116044)
蝎源活性肽对帕金森病大鼠凋亡因子改变的影响*
徐 红2, 安 冬3, 殷盛明1△, 陈 薇3, 赵 丹3, 孟 旭3, 于德钦1, 孙艺平1,2, 赵 杰1, 张万琴1
(大连医科大学 1. 生理学教研室, 2. 机能实验室, 3. 2012/3级, 辽宁 大连 116044)
目的:研究早期帕金森病(PD)大鼠脑内凋亡因子的改变及蝎源活性肽的保护作用。方法:选取健康雄性SD大鼠,体重为180~220 g,随机分为4组(n=10):早期PD模型组、假手术对照组、单独蝎源活性肽处理组和蝎源活性肽治疗组。采用6羟多巴胺(6-OHDA)制备大鼠PD早期模型,免疫组化观察大鼠黑质致密部和纹状体尾状核处Bax和Bcl-2免疫反应阳性颗粒数量和光密度的变化,观察大鼠PD发病早期脑内促进凋亡的Bax和抑制凋亡的Bcl-2的表达情况,进一步观察蝎源活性肽保护作用的抗凋亡机制。结果:发现在6-OHDA给药侧,PD早期大鼠与对照组相比,脑内促进凋亡的Bax表达增强,而抑制凋亡的Bcl-2表达减弱,而蝎源活性肽可有效的逆转这种异常的表达。结论:早期PD大鼠促进凋亡的Bax表达增强和抑制凋亡的Bcl-2表达减弱参与PD的早期病变,而抗凋亡机制参与了蝎源活性肽对中脑多巴胺能神经元的早期保护作用。
帕金森病; 蝎源活性肽; Bcl-2; Bax;大鼠
帕金森病(Parkinson’s disease, PD) 是以运动障碍为特征的慢性神经系统退行性疾病[1],其基本病理改变为选择性中脑黑质多巴胺能神经元进行性丢失[2]。PD从发病到有典型的临床表现需要很长的时间,最新研究显示甚至在新生儿期的脑内炎性损伤是导致几十年后PD的原因之一[3]。PD的早期诊断和治疗具有重要的意义,但是有关PD早期的发病机制尚未阐明。细胞凋亡参与PD的发病机制,抗凋亡也是PD治疗中关注的热点之一[4]。抗凋亡基因Bcl-2和促凋亡基因Bax是否参与早期PD的发病,少见报道。6-羟多巴胺( 6-hydrxydopamine, 6-OHDA )可在体外诱导多巴胺能神经元的凋亡[5,6]。6-OHDA大鼠是研究PD防治的理想模型,将其注射到纹状体后,大鼠黑质纹状体系统将发生缓慢的退行性病变,在纹状体一侧注射小剂量6-OHDA能够建立有PD早期病理特征的动物模型[7]。目前用于PD常规治疗的左旋多巴制剂经长期使用,药效降低,副作用大[8]。已有资料记载蝎毒可用于PD的治疗[9],但其机制尚不清楚。我们前期研究已发现蝎源活性肽可保护1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(MPTP) 小鼠 PD模型[10]中脑黑质内多巴胺能神经元,蝎源活性肽可以保护早期6羟多巴大鼠脑内的多巴胺能神经元[11]。本研究采用6-OHDA早期PD大鼠模型,旨在观察大鼠PD早期脑内促进凋亡的Bax和抑制凋亡的Bcl-2的表达情况,进一步观察蝎源活性肽保护作用的抗凋亡机制。为研究PD的早期诊断和防治提供依据。
1 材料与方法
1.1 药品、试剂与仪器
1.1.1 药品与试剂 所用药品包括6-OHDA(美国Sigma 公司)、Bcl-2与Bax抗体(Sigma公司)、生物素化的羊抗兔的IgG(武汉Boster公司)和蝎源活性肽(提取于东亚钳蝎,本课题组专利,ZL0116116-9)。
1.1.2 仪器 所用仪器为ZPQ-86型振动切片机(上海海天电子仪器有限公司)、DKI5600型脑立体定位仪(美国)和HPIAS 系列彩色病理图文分析系统(华海电子有限公司)。
1.2 实验动物与分组
1.2.1 实验动物 所用实验动物为SD大鼠(大连医科大学动物实验中心,许可证号为SCXXⅡ2008002)。健康雄性SD大鼠,体重为180~220 g,随机将实验动物分为4组(n=10):早期PD模型组、假手术对照组、单独蝎源活性肽处理组和蝎源活性肽治疗组。
1.2.2 蝎源活性肽处理 单独蝎源活性肽对照组和蝎源活性肽治疗组在完成行为学测试后给予蝎源活性肽(2.20 mg/(kg·d), ip)一周,早期PD模型组只给予生理盐水(NS,2 ml/kg)。蝎源活性肽剂量依据前期的研究和预实验。
1.2.3 PD动物模型制备 实验动物经腹腔注射4%水合氯醛(400 mg/kg),麻醉后将其固定在脑立体定位上,门齿杆长为3.4 mm。依据大鼠脑定位图谱(George Paxinos Charles Watson)来选取给药的靶点,纹状体为早期 PD的给药靶点,具体的定位靶点为 AP=+1.0(前囟前),R=3.0 mm(右旁开),H=-4.5 mm(硬膜下)。早期PD的模型组和蝎源活性肽治疗组的动物按照前述靶点定位,于脑内定点注射6-OHDA, 将6-OHDA溶解于Vehicle,内含0.1%抗坏血酸和0.9% NaCl,浓度为20 μg/3 μl。药物注射的时间约为3 min,留针约3 min之后再慢慢退出。假手术对照组的动物在同等条件下,于靶点内注射容量相同的Vehicle。
1.3 观察指标
1.3.1 动物旋转行为检测 术后两周,所有的实验动物都在颈部皮下注射0.4 ml阿朴吗啡,剂量为0.5 mg/kg,在30 min内观察并记录诱导出的旋转行为,小于7 r/min的左旋鼠视为模型成功的标志。
1.3.2 迈步试验 采用1.1 m长木板,将其倾斜放置,一端与鼠笼连接。在3 d内,训练大鼠在木板爬行,之后回到笼内并适应实验环境。在正式实验中,实验者用右手固定大鼠的双后肢,将其轻轻上提,使实验动物离开桌面,用左手固定其一侧前肢,让其未固定的另一侧前肢能够接触桌面。待该前肢可以自动移动的时候开始计时。记录开始迈步直到返回鼠笼的时间和动物爬行在斜面上的步数。先检测左侧,之后是右侧,重复2次。
1.3.3 免疫组织化学反应 采用免疫组织化学染色(ABC法)来检测抗凋亡因子Bcl-2和促凋亡因子Bax的免疫反应活性。选取实验动物的切片,定位为中脑黑质,采用PBS漂洗振荡共3次(10 min/count)。PBS(含1%过氧化氢)处理10 min以清除内源性的过氧化物酶。PBS漂洗振荡共3次(10 min/count),PBS(含1%牛血清蛋白)封闭30 min。分别加入抗Bcl-2和Bax一抗抗体,在4℃下进行孵育过夜。PBS漂洗共3次(10 min/count),加入生物素化的二抗在室温下孵育1.5 h;漂洗三次后再与卵白素-生物素的复合物A∶B∶PBS(1∶1∶200)在室温下进行振荡孵育1 h,漂洗充分后再用现配的含有0.05%的二氨基联苯胺(DAB)-PBS的缓冲液显色,显色后终止反应,梯度脱水,二甲苯透明之后采用中性树脂进行封片。
1.3.4 免疫染色阳性细胞的计数 采用病理图文分析系统来定量分析Bcl-2和Bax免疫反应(IR)阳性的细胞(n=6)。根据George Paxinos Charles Watson大鼠的脑图谱选取脑片的部位,10倍物镜下观察后,选取纹状体和黑质致密部(substantia nigra compact, SNC),测量框的面积是20 000 μm2(100 μm×200 μm),在上下左右四个部位进行计数,计算并采用其平均值。计算并分析框内Bcl-2和Bax-IR阳性的细胞个数。分别在选取脑区范围内的上下左右四个象限内随机选择6个Bcl-2和Bax-IR阳性的细胞,测定其胞浆的平均灰度。
1.4 统计方法
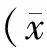
2 结果
2.1 行为学结果
在迈步实验中,与蝎源活性肽治疗组相比,早期PD模型组的大鼠在其左前肢迈步开始至返回到鼠笼所需总时间和迈步的数目没有明显的差异。
2.2 Bax和Bcl-2免疫组化的变化
2.2.1 Bax和Bcl-2免疫组化图像结果 Bax和Bcl-2免疫组化结果显示与假手术对照组相比,6-OHDA处理的早期PD动物黑质致密部SNC和纹状体尾状核处(striatum caudate putamen, CPu)的Bax和Bcl-2出现异常表达,促进凋亡的Bax阳性表达的免疫反应活性增强 (图1B、E,见彩图页Ⅲ);而抑制凋亡的Bcl-2阳性表达的免疫反应活性减弱(图2B、E,见彩图页Ⅲ),蝎源活性肽治疗组能够有效逆转这种增强或减弱的趋势。单独蝎源活性肽处理组与假手术对照组相比,无明显差异,所以结果中未展示。
2.2.2 Bax和Bcl-2免疫组化阳性颗粒数量和光密度统计的变化 Bax和Bcl-2免疫组化结果统计显示,与假手术对照组相比,6-OHDA处理的早期PD动物黑质致密部和纹状体处促进凋亡的Bax的阳性颗粒数与吸光度值均显著增多;而抑制凋亡的Bcl-2的阳性颗粒数与吸光度值均显著下降,蝎源活性肽治疗组能够有效逆转这种增多或减少的趋势(P<0.05,P<0.01,表1、表2)。单独蝎源活性肽处理组与假手术对照组相比,无明显差异,所以结果中未展示。
Tab. 1 Analysis of immunohistochemistry results of Bax in the SNC and CPu of the rats

GroupNumberSNCCPuODSNCCPuSham2.20±0.423.80±0.54124.20±3.71123.25±6.80EarlyPD3.85±0.60∗∗5.45±0.84∗∗138.15±1.96∗135.75±5.28∗∗Therapy2.00±0.59##3.30±0.89##122.95±6.98##122.50±4.03#
SNC: Substantianigra compact; CPu: Striatumcaudate putamen*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vstherapy group
Tab. 2 Analysis of immunohistochemistry results of Bcl-2 in the SNC and CPu of the rats

GroupNumberSNCCPuODSNCCPuSham4.20±0.455.40±0.86130.22±5.33124.90±0.98EarlyPD2.50±0.18∗∗2.40±0.20∗∗118.36±3.66∗∗103.90±2.08∗Therapy4.10±0.60##5.15±0.52##129.47±3.66##124.00±1.36#
SNC: Substantianigra compact; CPu: Striatumcaudate putamen*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vstherapy group
3 讨论
PD是一种以静止性震颤、动作迟缓及减少等症状为主要临床表现的中枢神经退行性疾病,主要发生于中老年人。50岁之后PD发病率超过1%[12]。PD显著的病理学特征是中脑黑质致密部多巴胺能神经元脱失引起纹状体多巴胺分泌不足,进而导致基底节神经调节功能的紊乱[13]。目前帕金森病的发病机制尚不明确[14,15],细胞凋亡可能是PD发生过程中多巴胺能神经元死亡的共同通路[16]。Matus等[17]研究发现,PD患者的黑质神经元凋亡明显增加,还有报道细胞凋亡可能在PD的黑质多巴胺能神经元死亡中发挥重要作用[18],并提出了在PD治疗过程中可采用抗细胞凋亡的方法。因此,对神经元的保护和抗细胞凋亡疗法已成为PD治疗的主要思路之一。
细胞凋亡是由基因控制的细胞自主的有序的死亡,是相对细胞坏死而言的另一种细胞死亡方式。细胞内存在两种具有相反功能的与凋亡相关的基因:促凋亡基因(Bax、Bak等)和抗凋亡基因(Bcl-2、Bcl-XL等)。在黑质DA能神经元凋亡的调控中,Bcl-2蛋白表达水平的下降,会引起Bax蛋白同源二聚体形成,从而促进DA能神经元凋亡;当Bcl-2蛋白表达水平上调时,Bax蛋白同源二聚体解聚,促使Bcl-2与Bax两种蛋白异源二聚体形成,抑制DA能神经元凋亡。有研究表明,Bax与Bcl-2的比值影响细胞凋亡过程,Bax/Bcl-2值升高可促进细胞凋亡[19]。Miyashita等[20]研究证实,Bax是包括6-OHDA所致纹状体内DA能神经元损伤等各种神经细胞损伤的启动因素之一,Bax的过表达会导致细胞色素C释放增多,Apaf-1变构加速,作用于Caspase前体,使其活化,从而激活Caspase级联凋亡程序[21]。Bcl-2能够促进DNA损伤修复,调节细胞内Ca水平,减少线粒体释放细胞色素C进入胞浆[22]。
目前,PD的治疗多采用针对性补充多巴胺等对症治疗,随着治疗时间的增长,药物对症治疗效果越来越差,静止性震颤、肌肉僵直等症状日渐明显,严重影响患者的生活质量并加重其经济负担[23]。因此,探讨PD的发生机制并寻找性价比高的对症药物成为目前研究的热点。蝎毒作为我国传统中药, 早有记载可用于治疗PD[8]。本研究在大鼠纹状体一侧注射小剂量6-OHDA,制备PD早期动物模型,经旋转行为实验与迈步实验检测,实验组与对照组没有明显的差异,可证实早期PD大鼠模型制备成功[24-26]。我们研究发现蝎源活性肽对早期PD大鼠多巴胺能神经元具有保护作用[11],进而通过更深一步研究观察到早期PD大鼠相对于对照组而言,其6-OHDA损毁侧中脑促进凋亡的Bax阳性表达免疫反应活性增强,而抑制凋亡的Bcl-2阳性表达免疫反应活性减弱,而蝎源活性肽可有效的逆转这种异常的表达。表明促进凋亡的Bax表达增强和抑制凋亡的Bcl-2表达减弱参与PD的早期病变,而抗凋亡机制参与了蝎源活性肽对中脑多巴胺能神经元的早期保护作用。推测蝎源活性肽可能通过促进Bcl-2的表达和抑制Bax的表达,达到抑制神经细胞的凋亡来减少多巴胺神经元的丢失,从而发挥抗PD作用。
综上所述,PD发病与细胞凋亡密不可分。Bax可启动并诱导黑质DA能神经元凋亡,是一种前凋亡蛋白,而Bcl-2可通过调控DNA损伤修复来抑制细胞凋亡。所以,干扰Bax蛋白表达,使其表达水平下调等抑制细胞前凋亡步骤的方法以及调节Bax/Bcl-2比值在临床治疗中具有重大意义。相信随着对PD多巴胺能神经元凋亡发病机制与蝎源活性肽药用价值的进一步研究,蝎源活性肽抗DA能神经元凋亡治疗PD一定会得到充分的认识和发展,为PD的预防与治疗提供了又一重要的理论依据。
[1] Mihara T, Mihara K, Yarimizu J,etal. Pharmacological characterization of a novel, potent adenosine A1 and A2A receptor dual antagonist, 5[ 5-amino-3-(4-fluorophenyl) pyrazin-2-yl]-1-isopropylpyridine-2(1H)-one (ASP5854), in models of Pakinson’s disease and cognition [J].JPharmacolExpTher, 2007, 323(2): 708-719.
[2] Kwon DH, Kim JM, Oh SH,etal. Seven-Tesla magnetic resonance images of the substantia nigra in Parkinson disease[J].AnnNeurol, 2012, 71(2): 267-277.
[3] Cai Z, Fan LW, Kaizaki A,etal. Neonatal systemic exposure to lipopolysaccharide enhances susceptibility of nigrostriatal dopaminergic neurons to rotenone neurotoxicity in later life[J].DevNeurosci, 2013, 35(2-3): 155-171.
[4] De Jes ú-Cort és H, Xu P, Drawbridge J,etal. Neuroprotectiv efficacy of aminopropyl carbazoles in a mouse model of Parkinson disease[J].ProcNatlAcadSciUSA, 2012, 109(42): 17010-17015.
[5] Guan S, Jiang B , Bao YM ,etal. Protocateehuic acid suppresses MPP(+)-induced mitochondrial dysfunction and apoptotic cell death in PC12 cells[J].FoodChemToxicol, 2006, 44(10): 1659-1666.
[6] Takata MK, Yamaguchi F, Nakanose K,etal. Neuroprotective effect of D-psicose on 6-hydroxydopamine-induced apoptosis in rat pheochromocytoma (PC12) cells [J].JBiosciBioeng, 2005, 100(5): 511-516.
[7] Jenner P. Functional models of Parkinsonc’s disease: a valuable tool in the development of novel therapies [J].AnnNeurol, 2008, 64(Suppl 2): 16-29.
[8] 侯 颖, 张本恕. 帕金森病的神经保护治疗[J]. 国外医学(老年医学分册), 2006, 27(3): 102-105.
[9] Tansey MG, Frank-Cannon TC, McCoy MK,etal. Neuroinflam mation in Parkinson’s disease: is there sufficient evidence for mechanism-based interventional therapy [J].FrontBiosci, 2008, 13(1): 709-717.
[10]Yin SM, Yu DQ, Gao X,etal. Scorpion venom heat-resistant protein decreases immunoreactivity of OX-42-positive microglia cells in MPTP-treated mice [J].NeuralRegenRes, 2008, 3(9): 967-970.
[11]Yin SM, Zhao D, Yu DQ,atel. Neuroprotection by scorpion venom heat resistant peptide in 6-hydroxydopamine rat model of early-stage Parkinson's disease[J].ActaPhysiolgicaSinica, 2014, 66(6): 658-666.
[12]Isabella Russo, Luisi Bubacco, Elisa Greggio. Exosomes-associated neurodegeneration and progression of Parkinson’s disease[J].AmJNeurodegenerDis, 2012, 1(3): 217-225.
[13]Ferrer I, Martinez A, Blanco R,etal. Neuropathology of sporadic Parkinson disease before the appearance of parkinsonism:preclinical Parkinson disease[J].JNeuralTransm, 2011, 118(5): 821-839.
[14]Surmeier DJ, Sulzer D. The pathology roadmap in Parkinson disease [J].Prion, 2013, 7(1): 85-91.
[15]Rana AQ, Masroor MS, Khan AS. A review of methods used to study cognitive deficits in Parkinson’s disease[J].NeurolRes, 2013, 35(1): 1-6.
[16]Choi JG, Kim HG, Kim, MC,etal. Polygalae radix inhibits toxin-induced neuronal death in the Parkinson’s disease models[J].JEthnopharmacol, 2011, 134(2): 414-421.
[17]Matus S, Castillo K, Hetz C. Hormesis: protecting neurons against cellular stress in Parkinson disease[J].Autophagy, 2012, 8(6): 997-1001.
[18]Battisti C, Formichi P, Radi E,etal. Oxidative-stress-induced apoptosis in PBLs of two patients with Parkinson disease secondary to alpha-synuclein mutation [J].JNeurolSci, 2008, 102(2): 254-261.
[19]Li X, Yin J, Cheng CM,etal. Paraquat induces selective dopaminergic nigrostriatal degeneration in aging C57BL/6 mice [J].ChinMedJ, 2005, l18(16): 1357-1361.
[20]Miyashita T, Krajewski S, Krajewska M,etal. Tumor suppressor p53 is a regulator of bcl-2 and bax gene expression in vitro and in vivo [J].Oncogene, 1994, 9(6): 1799-1805.
[21]Su JH, Deng G, Cotman CW. Neuronal DNA damage precedes tangle formation and is associated with up-regulation of nitrotyrosine in Alzheimer's disease brain[J].BrainRes, 1997, 774(1-2): 193-199.
[22]Adams JM, Cory S. Bcl-2-regulated apoptosis: mechanism and theraprutic potential [J].CurrOpinImmunol, 2007, 19(5): 488-496.
[23]Hindle JV. The practical management of cognitive impairment and psychosis in the older Parkinson’s disease patient [J].JNeuralTransm, 2013, 120(4): 649-653.
[24]徐 红, 董方圆, 殷盛明, 等. 早期帕金森病大鼠胶质细胞免疫反应活性的改变及其意义[J]. 中国应用生理学杂志, 2012, 28(1): 71-73,93.
[25]彭 岩, 殷盛明, 于德钦, 等. 脑立体定位选择性切断技术[J]. 大连医科大学学报, 2010, 32(3): 363-365.
[26]彭 岩, 殷盛明, 于德钦, 等. 早期帕金森病大鼠血清抗氧化能力降低[J]. 中国应用生理学杂志, 2011, 27(2): 218-220.
The alterations of apoptosis factor Bcl-2/Bax in the early Parkinson’s disease rats and the protective effect of scorpion venom derived activity peptide
XU Hong2, AN Dong3, YIN Sheng-ming1△, CHEN Wei3, ZHAO Dan3, MENG Xu3, YU De-qin1, SUN Yi-ping1,2, ZHAO Jie1, ZHANG Wan-qin1
(Dalian Medical University 1. Department of Physiology, 2. Functional Laboratory, 3. 2012/3 grade students, Dalian 116044, China)
Objective: To explore the alterations of apoptosis factor Bcl-2/Bax in the early Parkinson’s disease (PD) rats and the protective effect of scorpion venom derived bioactive peptide. Methods: Healthy male SD rats (180~220 g) were randomly divided into 4 groups (n=10): early PD model group, sham operation group, scorpion venom derived bioactive peptide control group, scorpion venom derived bioactive peptide therapy group. 6-hydroxydopamine (6-OHDA) was used to prepare the early PD rat model. The immunohistochemistry was used to detect the expression of Bax and Bcl-2 and further explore the mechanism of anti-apoptosis regarding the neuroprotective effect of scorpion venom derived bioactive peptide. Results: The results indicated that compared with the control rats, the immunostaining of Bax in the brain increased significantly while that of Bcl-2 decreased significantly in the lesion side of 6-OHDA treated rats. Interestingly, scorpion venom derived bioactive peptide could attenuate the above abnormal changes. Conclusion: Up-regulation of Bax and down-regulation of Bcl-2 could participate in the early stage of PD and the anti-apoptotic mechanism could be involved in the neuroprotective effect exerted by scorpion venom derived activity peptide regarding the dopaminergic neuron in the early stage.
Parkinson’s disease; scorpion venom derived activity peptide; Bcl-2; Bax; rats
国家自然科学基金资助项目(31201724);辽宁省大学生科研创新活动(201310161008)
2014-12-15
2015-02-10
R741
A
1000-6834(2015)03-225-05
10.13459/j.cnki.cjap.2015.03.008
△【通讯作者】Tel: 0411-86110288; E-mail: dlshengming@163.com

