慢性肾脏病治疗的新靶点和新药物
柳 晶 综述 季大玺 审校
慢性肾脏病治疗的新靶点和新药物
柳 晶 综述 季大玺 审校
慢性肾脏病(CKD)是全球范围内重要的公共健康问题。在探索CKD分子致病机制的基础上发现新的治疗靶点和药物,对提高CKD诊治水平,延缓疾病进展,改善患者长期预后,减轻政府卫生经济负担具有极其重要的意义。本文总结近年来CKD研究中发现的新的分子致病机制,及针对这些新机制的治疗方法和药物,重点关注了作用于转化生长因子β超家族的抗肾脏纤维化药物,以及血管钙化因子、烟酰胺腺嘌呤二苷酸磷酸(NADPH)过氧化物家族、核因子κB通路等在CKD发生发展中的分子致病机制。
慢性肾脏病 治疗靶点 治疗药物
近年来,随着经济发展和生活方式的改变,慢性非传染性疾病发生率不断增加,慢性肾脏病(CKD)导致的死亡患者人数占我国总人数的比重,从上世纪90年代的27位,截止2010年已升至第22位。我国CKD的患病率为10.8%,据此估算CKD患者近1亿,其中约100万患者可能进入终末期肾病(ESRD),需要接受肾脏替代治疗,故CKD已经成为了我国乃至全球性的公共健康问题之一,带来沉重的经济和社会负担。目前治疗CKD的主要措施包括控制蛋白尿、高血脂和高血压等,但均不能完全阻断CKD的进展,因此亟需寻找延缓CKD进展的新疗法。本文就近年来针对CKD患者肾脏纤维化的分子致病机制的研究,及其相关的治疗药物作一简述。
转化生长因子β(TGF-β)
肾脏纤维化是CKD的共同表现,以肾小球硬化及肾小管间质纤维化为显著特征。有证据表明TGF-β是导致肾纤维化过程中基质合成增加、基质降解抑制及肌成纤维细胞活化的主要介质。在糖尿病、嘌呤霉素肾病、单侧输尿管梗阻性肾病及高血压肾损害等动物模型中的研究均证实,抑制TGF-β可减少基质生成[1,2]。因此,抑制TGF-β信号通路已成为治疗CKD的新手段。动物实验证实,应用抗体中和TGF-β[2,3]和水溶性TGF-β受体,或以TGF-β的Ⅱ类受体为目标的小干扰RNA[4]等均可减轻肾脏损伤,延缓肾脏纤维化。但值得注意的是,抗TGF-β抗体虽然可减少肾小球及肾小管间质基质聚集,却不能减少蛋白尿。
Trachtman等[5]应用TGF-β抗体Fresolimumab治疗特发性局灶节段性肾小球硬化(FSGS)的Ⅰ期临床试验结果显示,患者耐受性良好。16例患者接受最高剂量为4 mg/kg的Fresolimumab治疗,随访观察112d,唯一的不良反应是2例患者发生了脓疱型皮疹,经治疗后均好转。16例患者尿白蛋白/肌酐比值(ACR)平均下降1.2 mg/g。另一种抗TGF-β抗体LY2382770DE治疗难治性FSGS和糖尿病肾病(DN)的 Ⅱ期临床研究也正在进行中[6]。
值得注意的是,抑制TGF-β可能会在抑制纤维化同时促进炎症反应和上皮细胞增殖,因此,研究正在试图寻找更具有靶向性的抗纤维化治疗靶点。结缔组织生长因子(CTGF)位于TGF-β信号通路下游,被认为与肾纤维化进展紧密关联[7,8]。抗CTGF抗体FG-3019治疗DN的Ⅰ期临床试验表明,24例患者ACR平均下降28 mg/g[9]。目前,联合应用FG-3019和血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂治疗DN的临床试验[10,11]和单用FG-3019治疗激素抵抗FSGS的临床试验[12]均在进行中。
此外,抑制TGF-β通路的多种药物也被证实可延缓CKD模型肾脏纤维化进展。吡非尼酮不仅能抑制TGF-β,还能抑制血小板源性生长因子和肿瘤坏死因子(TNF),可减少CKD动物模型中肾脏细胞外基质聚集及炎症细胞浸润[13,14]。Sharma等[15]开展了吡非尼酮治疗DN的多中心、随机、双盲和安慰剂对照的临床试验,吡非尼酮治疗组(1.2 g/d)平均估计肾小球滤过率(eGFR)较基线升高3.3 ±8.5 ml/(min·1.73 m2),但蛋白尿水平无明显改变。动物实验证实,另一种口服抗纤维化药物曲尼司特可减少肾小球硬化,减轻肾小管间质纤维化。两项小样本临床试验[16,17]证实曲尼司特可降低DN患者尿液Ⅳ型胶原和蛋白尿水平,随访观察1年发现所有患者的肾功能无明显下降。FT011是一种口服的曲尼司特衍生物,在5/6肾切除大鼠和链脲霉素诱导的Ren-2转基因高血压糖尿病大鼠模型中,FT011治疗后尿蛋白平均下降186 mg/d,并且具有减轻炎症反应,减少肾小球硬化的作用[18]。已经完成的FT011的Ⅰ期临床试验表明患者的耐受性良好[19]。
骨形态发生蛋白7(BMP-7)是TGF-β超家族成员,介导了Smad1、Smad5和Smad8磷酸化。BMP-7敲除的小鼠会出现肾功能衰竭,CKD患者肾组织中BMP-7水平下降[20,21]。BMP-7可能通过Smad7抑制TGF-β信号,从而减少肾纤维化[20,21]。因此,BMP-7被认为是潜在的治疗靶点。补充BMP-7可导致软组织钙化,因而临床应用受到限制,但BMP-7受体激动剂等药物仍极具临床应用前景。
睾丸特异性Y型编码样蛋白(TSPYl 2),又称细胞分裂自身抗原1(CDA1),也可能是阻止肾脏TGF-β信号通路传导的分子靶点[22],在TGF-β信号转导中起关键作用。CDA1在DN的足细胞和肾小管上皮细胞中表达均上调,敲除培养细胞中的CDA1,可减少细胞外基质蛋白产生,并降低由TGF-β所刺激的Ⅰ型和Ⅲ型胶原基因表达。敲除糖尿病小鼠的Tspyl 2基因,可减少肾脏细胞外基质蛋白聚集,降低肾小管及肾小管间质损伤程度,并且可减少TGF-β及其Ⅰ类受体基因表达,降低Smad3的磷酸化程度[22],提示Tspyl 2可直接调节TGF-β信号通路传导。值得关注的是,靶向性敲除Tspyl 2并不影响糖尿病小鼠其他的表型,如高三酯甘油血症,肾脏肥大和肾脏高灌注等。因此,仍需要更多的研究来评估CDA1在持续性蛋白尿和肾脏纤维化进展中的作用。
血管钙化因子
血管钙化和高血磷是CKD的常见并发症。对成纤维细胞生长因子23(FGF-23)和Klotho的功能研究揭示了血管钙化相关的机制和效应。FGF-23由骨组织产生,肾脏是其重要的靶器官。FGF23单独或协同Klotho,可增加尿磷排泄、抑制1,25-羟维生素D3产生。FGF-23还可抑制甲状旁腺激素的分泌,是导致CKD患者心肌肥厚的独立危险因素。FGF-23通过FGF受体和Klotho发挥作用[23]。Klotho由肾小管上皮细胞生成,存在膜结合型和分泌型两种类型[24]。膜结合型的Klotho可作为肾小管上皮细胞FGF-23的共受体之一,同时可增强FGF-23功能,促进尿磷排泄[24]。随着肾功能降低,循环中FGF-23水平不断增加,并在ESRD阶段达到高峰,以代偿性保持磷平衡。随着肾功能减退和肾单位的丧失,肾脏Klotho表达下降,FGF-23促进尿磷排泄的功能逐渐受限。抗FGF-23抗体是以FGF-23分子为治疗靶点,极具潜力的疗法,但可能抑制尿磷酸盐排泄,并不适用于CKD早期。
氧化应激和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶
研究证实在肾脏纤维化过程中,肾脏活性氧增加,线粒体超氧化物产生水平升高,但其通路激活的始作俑者尚未证实。NADPH氧化酶在肾脏中广泛表达,是肾脏活性氧的主要来源。NADPH氧化酶的主要异构体包括NADPH氧化酶1(NOX-1)、NOX-2(也被称为cytochrome b-245重链)、NOX-4和NOX-5,在大鼠和人的肾脏中均可表达[25,26],具有损伤血管、促进炎症反应和纤维化的作用[27]。DN患者肾脏NOX-5表达增加[28]。在动物模型中是细胞特异性表达人NOX-5(NOX-5 pod+)的转基因小鼠,可出现蛋白尿、足细胞足突融合,并伴血压升高[28]。
研究发现,db/db小鼠给予NOX-1和NOX-4的共同抑制剂GKT136901后,高糖诱导的近端肾小管的氧化应激和促纤维化信号标志物明显降低,且小鼠蛋白尿和氧化应激水平下降[29,30]。研究还证实,NOX-1和NOX-4抑制剂GKT137831,可改善肝脏纤维化,减少主动脉内皮细胞氧化应激[31,32]。Ⅰ期临床试验证实单倍剂量GKT137831治疗安全性良好[33],并且Ⅱ期临床试验也正在进行中[33]。
核因子κB (NF-κB)信号通路
NF-κB可激活大量促炎基因,吡咯烷二硫代氨基甲酸盐(PDTC)是NF-κB通路抑制剂,体内研究证实, PDTC可减轻庆大霉素诱导的CKD大鼠的肾脏炎症反应[34]。在醛固酮和高盐饮食诱导的CKD动物模型,PDTC可减轻肾脏损伤,抑制TGF-β、细胞间黏附因子1(ICAM-1)、Ⅳ型胶原和 CTGF等基因表达[34]。
雷公藤甲素是中国传统中药雷公藤的提取物,也具有抑制NF-κB通路的作用。研究证实雷公藤甲素可减轻db/db小鼠的肾小球系膜基质扩展、Ⅳ型胶原沉积和TGF-β基因的表达,改善小鼠胰岛素抵抗,发挥肾脏保护作用[35]。雷公藤甲素可降低小鼠尿液中多种促炎症细胞因子水平。在缺血再灌注介导的急性肾脏损伤模型中,雷公藤甲素可抑制肾脏炎症,对肾小管损伤具保护作用[34]。
虽然大量的动物实验研究证实NF-κB抑制剂具有减轻肾脏炎症反应,延缓肾脏纤维化,改善肾脏功能,但是,迄今为止,尚无有关NF-κB通路抑制剂治疗CKD的临床研究数据。
小结:近年来,针对TGF-β及其下游信号传导通路、血管钙化因子、氧化应激和NADPH氧化酶及NF-κB等分子和通路在肾脏慢性炎症反应和肾脏纤维化中的作用研究,揭示了一批具有发展前景的CKD分子治疗靶点,在此基础上研发的CKD干预药物大多已在动物模型中获得了良好的治疗效果(表1),随着进一步临床试验的开展(表2),相信在不久的将来,会为CKD的治疗带来新的途径。伴随着生命科学新技术在CKD研究中的不断应用,肾脏病医师、药物研发公司和政府部门的不断密切合作,必将迎来CKD治疗药物研发的新时代。
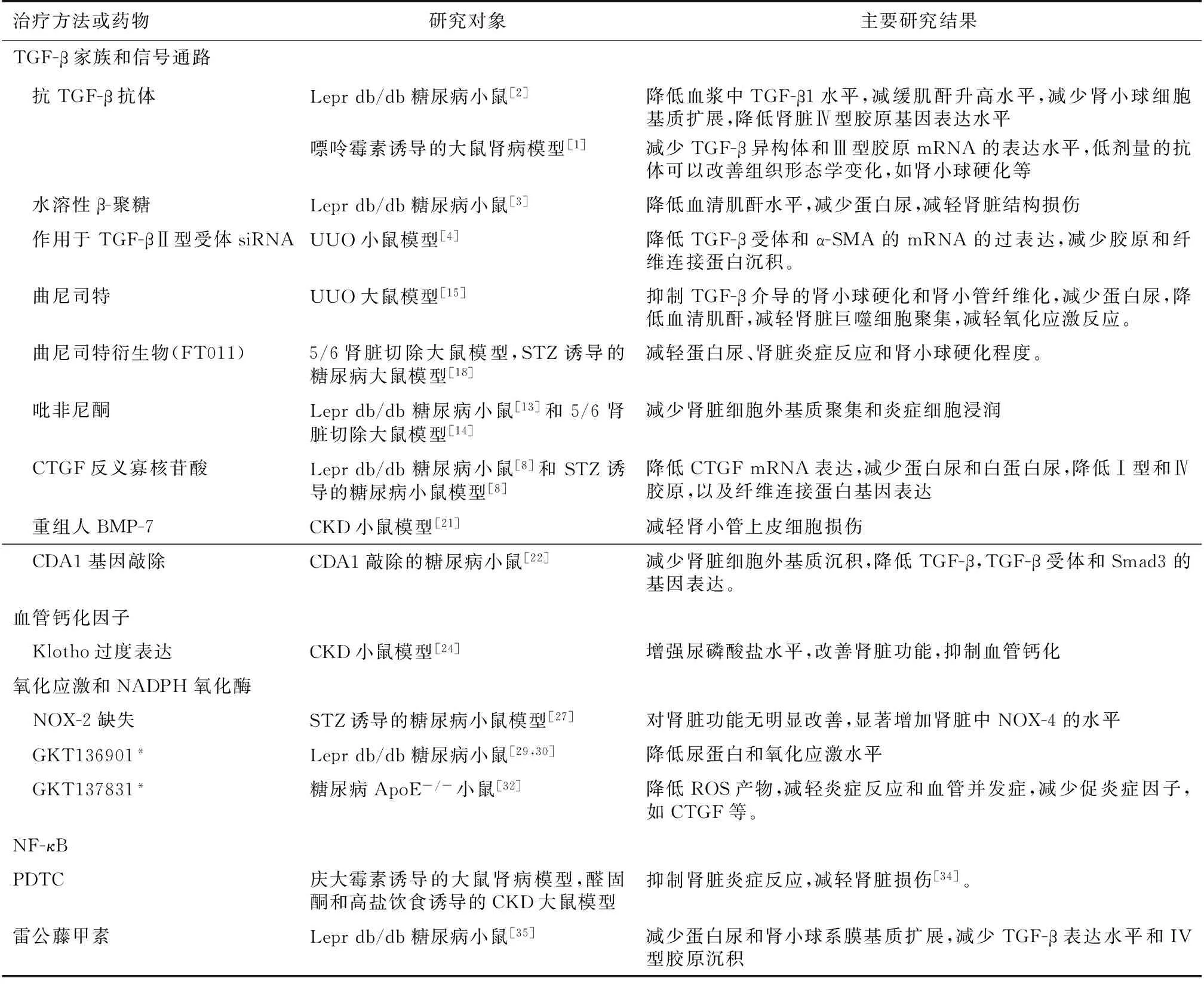
表1 治疗CKD的动物模型
α-SMA:α平滑肌肌动蛋白; ApoE:载脂蛋白E;BMP:骨形态发生蛋白; CDA1:细胞分裂自身抗原1;CKD:慢性肾脏病;CTGF:结缔组织生长因子;NF-κB:核因子κB;NOX:烟酰胺腺嘌呤二核苷酸磷酸氧化酶;PDTC:吡咯烷二硫代氨基甲酸;ROS:活性氧;siRNA:小干扰RNA;STZ:链脲佐菌素;TGF-β:转化生长因子β; UUO:单侧输尿管梗阻;*:NOX-1和NOX-4的双重抑制剂

表2 慢性肾脏病治疗方法的临床研究
ACEI:血管紧张素转换酶抑制剂; ACR:白蛋白肌酐比值; ARB:血管紧张素Ⅱ受体拮抗剂; CTGF:结缔组织生长因子;DN:糖尿病肾病;FSGS:局灶节段性肾小球硬化; TGF-β:转化生长因子β
1 Ma LJ,Jha S,Ling H,et al.Divergent effects of low versus high dose anti-TGF-beta antibody in puromycin aminonucleoside nephropathy in rats.Kidney Int,2004,65(1):106-115.
2 Ziyadeh FN,Hoffman BB,Han DC,et al.Long-term prevention of renal insufficiency,excess matrix gene expression,and glomerular mesangial matrix expansion by treatment with monoclonal antitransforming growth factor-beta antibody in db/db diabetic mice.Proc Natl Acad Sci U S A,2000,97(14):8015-8020.
3 Guan Q,Li S,Gao S,et al.Reduction of chronic rejection of renal allografts by anti-transforming growth factor-beta antibody therapy in a rat model.Am J Physiol Renal Physiol,2013,305(2):F199-F207.
4 Kushibiki T,Nagata-Nakajima N,Sugai M,et al.Delivery of plasmid DNA expressing small interference RNA for TGF-beta type II receptor by cationized gelatin to prevent interstitial renal fibrosis.J Control Release,2005,105(3):318-331.
5 Trachtman H,Fervenza FC,Gipson DS,et al.A phase 1,single-dose study of fresolimumab,an anti-TGF-beta antibody,in treatment-resistant primary focal segmental glomerulosclerosis.Kidney Int,2011,79(11):1236-1243.
6 US National Library of Medicine.ClinicalTrials.gov [online],http://clinicaltrials.gov/ct2/show/NCT01113801 (2013).
7 Boor P,Floege J.Chronic kidney disease growth factors in renal fibrosis.Clin Exp Pharmacol Physiol,2011,38(7):441-450.
8 Guha M,Xu ZG,Tung D,et al.Specific down-regulation of connective tissue growth factor attenuates progression of nephropathy in mouse models of type 1 and type 2 diabetes.FASEB J,2007,21(12):3355-3368.
9 Adler SG,Schwartz S,Williams ME,et al.Phase 1 study of anti-CTGF monoclonal antibody in patients with diabetes and microalbuminuria.Clin J Am Soc Nephrol,2010,5(8):1420-1428.
10 US National Library of Medicine.ClinicalTrials.gov [online],http://clinicaltrials.gov/ct2/show/NCT00754143 (2011).
11 US National Library of Medicine.ClinicalTrials.gov [online],http://clinicaltrials.gov/ct2/show/NCT00913393 (2012).
12 US National Library of Medicine.ClinicalTrials.gov [online],http://clinicaltrials.gov/ct2/show/NCT00782561 (2009).
13 RamachandraRao SP,Zhu Y,Ravasi T,et al.Pirfenidone is renoprotective in diabetic kidney disease.J Am Soc Nephrol,2009,20(8):1765-1775.
14 Chen JF,Ni HF,Pan MM,et al.Pirfenidone inhibits macrophage infiltration in 5/6 nephrectomized rats.Am J Physiol Renal Physiol,2013,304(6):F676-F685.
15 Sharma K,Ix JH,Mathew AV,et al.Pirfenidone for diabetic nephropathy.J Am Soc Nephrol,2011,22(6):1144-1151.
16 Soma J,Sugawara T,Huang YD,et al.Tranilast slows the progression of advanced diabetic nephropathy.Nephron,2002,92(3):693-698.
17 Soma J,Sato K,Saito H,et al.Effect of tranilast in early-stage diabetic nephropathy.Nephrol Dial Transplant,2006,21(10):2795-2799.
18 Gilbert RE,Zhang Y,Williams SJ,et al.A purpose-synthesised anti-fibrotic agent attenuates experimental kidney diseases in the rat.PLoS One,2012,7(10):e47160.
19 Australian New Zealand Clinical Trials Registry.Anzctr.org [online],https://www.anzctr.org.au/Trial/Registration/TrialReview.aspx?ACTRN=12613000386730 (2013).
20 Spanjol J,Djordjevic G,MarkiD,et al.Bone morphogenetic protein-7 expression in human pyelonephritis.Coll Antropol,2010,34 (Suppl 2):61-64.
21 Bramlage CP,Tampe B,Koziolek M,et al.Bone morphogenetic protein (BMP)-7 expression is decreased in human hypertensive nephrosclerosis.BMC Nephrol,2010,11:31.
22 Chai Z,Dai A,Tu Y,et al.Genetic deletion of cell division autoantigen 1 retards diabetes-associated renal injury.J Am Soc Nephrol,2013,24(11):1782-1792.
23 Komaba H,Fukagawa M.The role of FGF23 in CKD——with or without Klotho.Nat Rev Nephrol,2012,8(8):484-490.
24 Hu MC,Kuro-o M,Moe OW.Klotho and kidney disease.J Nephrol,2010,23(Suppl 16):S136-S144.
25 Babelova A,Avaniadi D,Jung O,et al.Role of Nox4 in murine models of kidney disease.Free Radic Biol Med,2012,53(4):842-853.
26 Gorin Y,Block K.Nox as a target for diabetic complications.Clin Sci (Lond),2013,125(8):361-382.
27 You YH,Okada S,Ly S,et al.Role of Nox2 in diabetic kidney disease.Am J Physiol Renal Physiol,2013,304(7):F840-F848.
28 Sedeek M,Nasrallah R,Touyz RM,et al.NADPH oxidases,reactive oxygen species,and the kidney:friend and foe.J Am Soc Nephrol,2013,24(10):1512-1518.
29 Sedeek M,Callera G,Montezano A,et al.Critical role of Nox4-based NADPH oxidase in glucose-induced oxidative stress in the kidney:implications in type 2 diabetic nephropathy.Am J Physiol Renal Physiol,2010,299(6):F1348-F1358.
30 Sedeek M,Gutsol A,Montezano AC,et al.Renoprotective effects of a novel Nox1/4 inhibitor in a mouse model of Type 2 diabetes.Clin Sci (Lond),2013,124(3):191-202.
31 Aoyama T,Paik YH,Watanabe S,et al.Nicotinamide adenine dinucleotide phosphate oxidase in experimental liver fibrosis:GKT137831 as a novel potential therapeutic agent.Hepatology,2012,56(6):2316-2327.
32 Gray SP,Di Marco E,Okabe J,et al.NADPH oxidase 1 plays a key role in diabetes mellitus-accelerated atherosclerosis.Circulation,2013,127(18):1888-1902.
33 US National Library of Medicine.ClinicalTrials.gov [online],http://clinicaltrials.gov/ct2/show/NCT02010242 (2014).
34 Li Y,He D,Zhang X,et al.Protective effect of celastrol in rat cerebral ischemia model:down-regulating p-JNK,p-c-Jun and NF-kappaB.Brain Res,2012,1464:8-13.
35 Kim JE,Lee MH,Nam DH,et al.Celastrol,an NF-κB inhibitor,improves insulin resistance and attenuates renal injury in db/db mice.PLoS One,2013,8(4):e62068.
(本文编辑 律 舟 凡 心)
The novel therapeutic targets and treatments for chronic kidney diseases
LIUJing,JIDaxi
DaxiNationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Chronic kidney disease (CKD) is becoming a worldwide epidemic. Novel targets and treatments for CKD are, therefore, desperately needed to both mitigate the burden of this disease in the general population and reduce the necessity for renal replacement therapy in individual patients. This review highlights new insights into the mechanisms that contribute to CKD, and approaches that might facilitate the development of disease arresting therapies for CKD. Particular focus is given to therapeutic approaches using antifibrotic agents that target the transforming growth factor β superfamily. In addition, we discuss new insights regarding the roles of vascular calcification, the NADPH oxidase family, and NF-κB pathway in the pathogenesis of CKD. Prospective therapeutics based on these findings will hopefully renew hope for clinicians and patients in the near future.
chronic kidney diseases therapeutic target drugs
国家科技支撑计划课题(2013BAI09B04)(2015BAI12B05);江苏省临床医学中心项目(BL2012007)
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2014-08-07

