尿毒症肌少症的发病机制和治疗
任红旗 综述 龚德华 审校
·血液净化·
尿毒症肌少症的发病机制和治疗
任红旗 综述 龚德华 审校
肌少症是以骨骼肌质量、力量以及功能降低为主要特征的退行性综合征。年龄与肌少症密切相关,然而,慢性肾脏病尤其终末期肾病可加速肌肉消耗,增加肌少症发生率。导致尿毒症肌少症因素较多,如激素、免疫和肌细胞的改变,代谢性酸中毒,蛋白质摄入减少及运动减少等。尿毒症合并肌少症发生率高,且死亡率高,因而,需要早期预防、早期诊断和治疗。
尿毒症 肌少症 发病机制
肌少症亦称骨骼肌减少症或增龄性骨骼肌减少,是以骨骼肌质量、力量及功能降低为主要特征的退行性综合征[1]。肌少症不仅仅见于尿毒症患者,但在尿毒症患者中发生率更高,极大增加了患者死亡率且导致医疗费用剧增[2]。合并肌少症对尿毒症患者预后影响更大,因而必须早期预防、早期诊断和治疗。本文综述尿毒症患者并发肌少症的原因及可能的发病机制,以提高对此症的认识,制订合适的预防和治疗措施。
定义、临床表现及诊断
随着肾功能恶化,尿毒症患者出现肌肉力量降低、选择性肌肉结构改变和明显的肌肉萎缩,称之为尿毒症肌少症。临床主要表现肌力减退,患者活动能力降低,易出现疲劳、乏力,行走、坐立、登高和举重物等日常动作完成困难,甚至导致难以站立、极易摔倒、平衡障碍等[3-5]。
尿毒症肌少症的诊断目前尚缺乏统一的检测方法及诊断标准,主要参考欧洲老年肌少症工作组(European Working Group on Sarcopenia in Older People,EWGSOP)制订的诊断标准。诊断该症包括肌量减少、肌力减少和肌肉功能减退3个要素[6,7]。肌少症可分为3期,即肌少症前期(仅有肌量减少)、肌少症期(肌量减少、肌力减低伴或不伴肌肉功能减低)及重度肌少症期(肌量减少、肌力和肌肉功能减低)[7]。
肌肉质量可以通过多种方法测得。生物电阻抗(BIA)测定的肌肉质量,常以骨骼肌质量指数(SMI)表示,正常男性SMI≥10.76 kg/m2,女性SMI≥6.76 kg/m2;中度肌少症患者:男性SMI 8.51~10.75 kg/m2,女性SMI 5.76~6.75 kg/m2;重度肌少症患者:男性SMI≤8.50 kg/m2,女性SMI≤5.75 kg/m2。肌力常用握力(HGS)评价,肌少症患者男性HGS<30 kg,女性HGS<20 kg。
发生率
目前有关尿毒症肌少症发生率报道较少。Kim等[8]采用EWGSOP诊断标准,研究95例50岁以上(平均年龄63.9±10.0岁)的维持性血液透析患者肌少症发生率发现,男性为37.0%,女性29.3%。Lamarca等[6]研究了102例60岁以上的老年血液透析患者,采用双能X线骨密度仪(DXA)、BIA、三角肌皱褶(SKF)及中臂肌周径(MAMC)及HGS等方法测量其瘦体重指数,结果发现尿毒症肌少症的发生率为3.9%~63.3%。其中,BIA和SKF测定结果与DXA法测定的结果较为接近,发生率37.3%~63%;而MAMC及HGS方法与DXA法测定的结果相差较远。
病因及发病机制
肌少症病因及发病机制可能与多因素有关,包括致炎因子增加、蛋白摄入减少、运动减少、性激素及生长激素减少、胰岛素和维生素D(VitD)水平降低,以及星状细胞减少等;而尿毒症肌少症病因及发病机制除以上因素外,还与代谢性酸中毒、蛋白质-能量消耗、血管紧张素Ⅱ以及肌抑素过度表达等因素有关(图1)[9]。
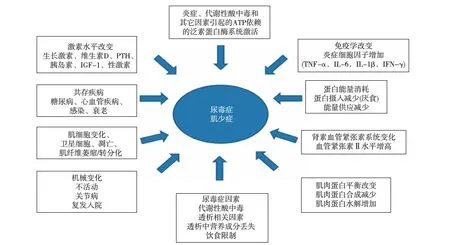
图1 尿毒症肌少症的病因及发病机制PTH:甲状旁腺激素;IGF-1:胰岛素样生长因子1;TNF-α:肿瘤坏死因子α;IL:白细胞介素;IFN-γ:γ干扰素
炎症与蛋白质-能量消耗(PEW) 微炎症状态在尿毒症患者特别是血液透析患者中较为常见,有研究表明在CKD早期阶段循环中炎症标志物[C反应蛋白(CRP)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)]水平即开始升高[10]。微炎症状态与尿毒症很多并发症密切相关,包括PEW及肌肉萎缩。有数据表明,透析患者肌肉质量与循环IL-6和CRP水平呈负相关。这些炎症介质可通过多种机制导致肌肉萎缩,如TNF-α可通过诱导核因子κB(NF-κB)通路使肌肉迅速萎缩,注射TNF-α可使胰岛素刺激的蛋白合成能力下降及通过活化NF-κB抑制肌细胞分化能力,导致肌肉萎缩。其他一些因子包括血管紧张素Ⅱ、IL-6、IL-1β和干扰素γ亦证实可通过NF-κB通路使肌肉蛋白的降解加快,并且通过基因和药物中和这些因子,使肌肉消耗明显减轻[11,12]。
微炎症状态与PEW密不可分,PEW在慢性肾脏病(CKD)患者中的发生率18%~75%[13],表现为循环中蛋白质减少、体重和肌肉质量下降等。
尿毒症患者肌肉蛋白平衡的调节机制十分复杂,其中ATP依赖的泛素-蛋白酶体系统(UPS)蛋白溶解被认为是增加CKD患者骨骼肌降解的主要原因。炎症和代谢性酸中毒在活化UPS中发挥重要作用。炎症活化UPS后导致可溶性的14 kDa的肌动蛋白片段断裂,是CKD患者蛋白溶解增加的重要标志[14]。尿毒症常见代谢性酸中毒,能诱导UPS上调和增加骨骼肌的氨基酸氧化。Boivin等[15]发现增加透析患者骨骼肌中天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase-3)活性,会引起14 kDa的肌动蛋白片段和泛素C端肌动蛋白片段产生增加,导致肌细胞凋亡增加。
食欲减退 尿毒症患者常有食欲减退,甚而出现厌食症。摄食减少必然导致营养不良,影响肌肉蛋白代谢。导致食欲减退的因素众多,包括调节食欲的激素失调(如瘦素-食欲抑制因子,生长素释放肽-食欲刺激因子等)、识别气味能力下降、味觉改变、尿毒症相关的胃肠综合征、抑郁、血液动力学不稳以及腹膜透析导致的胃肠道胀满感[9]。
代谢性酸中毒 代谢性酸中毒在CKD患者中非常普遍,尤其是CKD 4期患者;它可通过增加蛋白降解和降低蛋白合成促进肌肉蛋白消耗和PEW,导致蛋白更新速率变慢、Ⅱ型肌纤维萎缩,进而引起肌肉萎缩。代谢性酸中毒还通过上调UPS通路导致肌肉蛋白降解和骨骼肌氨基酸侧链过度氧化。
临床数据表明,纠正酸中毒可有助于改善患者肌肉减少及营养不良。Stein等[16]随机选取200例代谢性酸中毒的腹膜透析患者,用含35 mmol/L或40 mmol/L乳酸盐的腹膜透析液治疗,1年后,所有患者血清中的碳酸氢盐含量升高、体重增加,中臂肌肉周径增加。Pickering等[17]发现,CAPD患者血清中碳酸氢盐水平轻度升高可通过UPS途径降低蛋白分解,此外,血浆氨基酸侧链增加也会减少蛋白的分解。
血管紧张素Ⅱ 肾素-血管紧张素系统在尿毒症患者常处于活化状态,而其可对分解代谢产生影响,包括下调磷酸化pAkt、活化骨骼肌中caspase-3途径,引起肌动蛋白裂解、增加肌细胞的凋亡。Brink等[18]给大鼠输注血管紧张素Ⅱ引起了肌肉蛋白降解增加、循环和骨骼肌中胰岛素样生长因子1(IGF-1)水平降低,导致体重明显下降。转化生长因子β(TGF-β)信号增强是骨骼肌肌肉萎缩的机制之一。当给予氯沙坦(血管紧张素Ⅱ受体拮抗剂)时,会抑制TGF-β信号通路活性,促进马凡氏综合症小鼠模型的肌肉重塑,以及促进假肥大型肌营养不良症小鼠模型的肌肉重塑。另一项老年小鼠模型研究也表明,氯沙坦有助于损伤后的骨骼肌重塑,并能阻止制动期间的废用性萎缩[19]。
维生素D(VitD) Vit D水平和肌肉力量、身体活动能力呈正相关,与跌倒风险呈负相关,在免疫调节、炎症、胰岛素抵抗、高血压、血栓和一些细胞包括骨骼肌细胞增殖与分化过程中发挥重要作用。
肾功能正常VitD缺乏的CKD患者,肌肉收缩的舒张期延长,而这与血清钙、甲状旁腺激素或血磷水平无关。肌肉活检显示,VitD严重缺乏的患者Ⅱ型纤维萎缩、纤维间隙增大,脂肪、纤维组织以及糖原颗粒沉积[9]。补充VitD能够提高肌肉功能、减少跌倒风险,改变和修饰肌纤维的成分和形态。
卫星细胞异常 卫星细胞是骨骼肌特异性干细胞,定位于基底层和肌纤维膜之间,有稳定的生肌潜能和自我更新特征。肌肉损伤后,卫星细胞被活化并表达肌分化因子(MyoD)和肌细胞生成素转录因子,引起肌细胞增殖和形成,而后分化成新的肌纤维来修复受损的肌纤维。Wang等[20]报道了CKD小鼠受损的肌细胞中WyoD蛋白和肌细胞生成素表达下降,导致肌细胞再生能力受损。这些异常可通过抗阻练习来纠正。近年来,Fahal[9]研究发现卫星细胞功能受损引起IGF-1受体(IGF-1R)信号传导减少,导致卫星细胞增殖和分化能力下降,这可能是导致CKD患者肌肉萎缩的新机制。
性别和性激素 实验和临床研究均表明性别和肌少症的临床表现及症状的严重度密切相关,这主要与性激素相关。对于男性而言,睾酮是合成代谢的类固醇,能增加肌肉质量和力量,睾酮缺乏可导致起肌肉质量减少。而男性CKD患者睾酮缺乏较为常见,与催乳素清除减少以及尿毒症抑了促黄体生成素的信号在睾丸间质细胞中的传导有关。对女性而言,雌性激素如雌二醇与力量强度改变和力量产生有关,而女性CKD患者在早期即常有雌二醇缺乏和月经稀少。
但不同性别CKD患者体内的性激素紊乱对其影响有较大差别。男性尿毒症患者可能比女性更易于发生炎症所诱导的厌食症,导致骨骼肌异常,引起握力明显减弱等症状。动物实验也显示,雄性大鼠炎症诱导的厌食症症状更为严重;而雌性大鼠,当注射孕酮后厌食症症状明显减轻。另一项研究发现女性患者肌肉萎缩比男性更早,但如果使用激素替代治疗后,肌力能够保持良好[9]。
生长激素 CKD患者存在生长激素抵抗,也是引起骨骼肌蛋白分解代谢和消耗增加的潜在因素。研究显示,给予药理剂量的重组人生长激素(rhGH),能诱导净同化作用,改善尿毒症动物模型和进展期CKD患者的食物利用率[21]。血液透析患者短、中期给予药理剂量的rhGH,能增加3~4 kg的瘦体重。rhGH能改善全身的蛋白质稳态,明显减少慢性血液透析患者必须氨基酸和肌肉的损耗[22]。恶病质的血液透析患者给予rhGH 总量50 μg ,6周后这些患者肌肉蛋白平衡明显改善、瘦体重增加、生活质量改善、且无明显不良反应[9]。
胰岛素抵抗 胰岛素抵抗与CKD患者尿毒症肌病的发展有关,主要因为胰岛素抵抗不仅仅抑制胰岛素释放,还能减少糖原利用、增加肝糖原产生、减少肝脏和(或)骨骼肌糖原的摄取、细胞内葡萄糖代谢受损等。此外,胰岛素抵抗还可以通过UPS通路导致肌肉蛋白降解增加[23]。近来,研究表明肌肉中胰岛素/IGF-I信号受损导致P-AKT减少和肌肉消耗之间的关系尚不清楚,在血管紧张素Ⅱ释放增多、炎症和代谢性酸中毒等因素作用下,导致肌肉消耗的两条通路被可能被激活:首先,caspase-3活化裂解肌肉蛋白复杂结构;其次,低水平P-Akt减少叉头转录因子磷酸化,使其易位到细胞核内,而后刺激Atrogin-1/肌肉萎缩F-box蛋白(MAFbx)的表达和肌肉环指蛋白1(MuRF1)的表达。肌少症是一种进展性疾病,胰岛素抵抗在疾病过程中早期即起作用,并且具有累积效应。
肌抑素和卵泡抑素 肌抑素和卵泡抑素是TGF-β的家族成员。肌抑素在尿毒症恶病质患者体内过表达,对骨骼肌质量和生长具有负调节作用,通过激活Smad、丝裂原活化的蛋白激酶通路及抑制AKT信号等机制导致肌肉萎缩。
卵泡抑素是一种调节糖蛋白,之前被认为是FSH-抑制蛋白,现在认为可能是一种肌抑素拮抗剂。已有实验证明卵泡抑素过表达能使肌肉质量明显增加,但其作用机制仍不清楚。Gilson等[24]目前研究表明卫星细胞明显增殖有助于卵泡抑素引起的肌肉生长、增加蛋白合成。Miyamoto等[25]近来报道除了消瘦及合并感染的CKD患者外,其他CKD患者中卵泡抑素水平不受影响,其机制可能与卵泡抑素活化后减弱尿毒症患者肌抑素和苯丙酸诺龙的作用。
预防及治疗
尿毒症肌少症发生机制复杂且不断进展。老年患者较易发生肾衰竭,这会加速这些群体的生理性肌肉萎缩。尿毒症肌少症不仅使患者生活方式改变、生活质量降低,而且还能增加患者心血管并发症、从而增加发生率和死亡率。
尽管终末期肾病患者发生肌少症风险增加,然而,尿毒症肌少症可经药物治疗及生活方式干预,特别是在早期进行干预加以逆转(表2)[5,9]。

表2 尿毒症肌少症的预防及治疗措施
IL-6:白细胞介素6;IGF-1:胰岛素样生长因子1
体力活动、阻力锻炼是延缓肌少症的主要干预措施,高强度阻力锻炼较低中强度阻力锻炼更能显著提高肌量和肌力,可能对尿毒症肌少症具有一定的预防及治疗作用。
营养支持能够一定程度上提高尿毒症患者的生活质量,特别是增加机体蛋白质和氨基酸的摄入,对肌少症的预防甚至治疗有一定的作用,然而营养支持并不能有效地提高尿毒症肌少症患者的肌肉量和改善其功能状态。
性激素(包括睾酮和雌激素)是最重要的干预骨骼肌衰老的药物之一,睾酮可促进肌肉合成,使肌肉力量明显提高。生长激素也是促进肌肉合成的重要激素,使肌肉蛋白明显改善、瘦体重增加、生活质量改善。VitD除了在调节钙磷代谢中起重要作用外,还能促进骨骼肌细胞收缩、增殖、分化的蛋白质合成,对维护肌肉健康也起到重要的作用。此外,补充VitD可增加Ⅱ型骨骼肌纤维的比例,在防止摔倒中起着到重要的作用。
近年来,一些研究表明黑皮素4受体拮抗剂、肌抑素抑制剂、IL-6拮抗剂及合成的生长激素释放肽等在防治肌少症过程中也起着一定的作用,但其作用机制及疗效有待进一步论证,尤其需要系列的临床研究以进一步明确[5,26]。
小结:尿毒症肌少症不仅使患者生活方式改变、生活质量降低,还使患者心血管并发症增加、死亡率增高,因此必须提高对此病的认识。导致尿毒症肌少症因素较多,主要与激素、免疫和肌细胞的改变,代谢性酸中毒,蛋白质摄入减少及运动减少等有关。由于尿毒症合并肌少症发生率高,因而,需要早期预防、早期诊断和治疗。
1 A Sayer A,Stewart C,Patel H,et al.The developmental origins of sarcopenia: from epidemiological evidence to underlying mechanisms.J Dev Orig Health Dis,2010,1(3):150-157.
2 Janssen I,Shepard DS,Katzmarzyk PT,et al.The healthcare costs of sarcopenia in the United States.J Am Geriatr Soc,2004,52(1):80-85.
3 Domański M,Ciechanowski K.Sarcopenia:a major challenge in elderly patients with end-stage renal disease.J Aging Res,2012,2012:754739.
4 Greco A,Paroni G,Seripa D,et al.Frailty,disability and physical exercise in the aging process and in chronic kidney disease.Kidney Blood Press Res,2014,39(2-3):164-168.
5 Kim JC,Kalantar-Zadeh K,Kopple JD.Frailty and protein-energy wasting in elderly patients with end stage kidney disease.J Am Soc Nephrol,2013,24(3):337-351.
6 Lamarca F,Carrero JJ,Rodrigues JC,et al.Prevalence of sarcopenia in elderly maintenance hemodialysis patients:the impact of different diagnostic criteria.J Nutr Health Aging,2014,18(7):710-717.
7 Cruz-Jentoft AJ,Baeyens JP,Bauer JM,et al.Sarcopenia:European consensus on definition and diagnosis:Report of the European Working Group on Sarcopenia in Older People.Age Ageing,2010,39(4):412-423.
8 Kim JK,Choi SR,Choi MJ,et al.Prevalence of and factors associated with sarcopenia in elderly patients with end-stage renal disease.Clin Nutr,2014,33(1):64-68.
9 Fahal IH.Uraemic sarcopenia:aetiology and implications.Nephrol Dial Transplant,2014,29(9):1655-1665.
10 Mak RH,Ikizler AT,Kovesdy CP,et al.Wasting in chronic kidney disease.J Cachexia Sarcopenia Muscle,2011,2(1):9-25.
11 Zhang L,Du J,Hu Z,et al.IL-6 and serum amyloid A synergy mediates angiotensin Ⅱ-induced muscle wasting.J Am Soc Nephrol,2009,20(3):604-612.
12 Cheung WW,Paik KH,Mak RH.Inflammation and cachexia in chronic kidney disease.Pediatr Nephrol,2010,25(4):711-724.
13 von Haehling S,Anker SD.Prevalence,incidence and clinical impact of cachexia:facts and numbers-update 2014.J Cachexia Sarcopenia Muscle,2014,5(4):261-263.
14 Du J,Wang X,Miereles C,et al.Activation of caspase-3 is an initial step triggering accelerated muscle proteolysis in catabolic conditions.J Clin Invest,2004,113(1):115-123.
15 Boivin MA,Battah SI,Dominic EA,et al.Activation of caspase-3 in the skeletal muscle during haemodialysis.Eur J Clin Invest,2010,40(10):903-910.
16 Stein A,Moorhouse J,Iles-Smith H,et al.Role of an improvement in acid-base status and nutrition in CAPD patients.Kidney Int,1997,52(4):1089-1095.
17 Pickering WP,Price SR,Bircher G,et al.Nutrition in CAPD:serum bicarbonate and the ubiquitin-proteasome system in muscle.Kidney Int,2002,61(4):1286-1292.
18 Brink M,Price SR,Chrast J,et al.Angiotensin Ⅱ induces skeletal muscle wasting through enhanced protein degradation and down-regulates autocrine insulin-like growth factor I.Endocrinology,2001,142(4):1489-1496.
19 Burks TN,Andres-Mateos E,Marx R,et al.Losartan restores skeletal muscle remodeling and protects against disuse atrophy in sarcopenia.Sci Transl Med,2011,3(82):82ra37.
20 Wang XH,Du J,Klein JD,et al.Exercise ameliorates chronic kidney disease-induced defects in muscle protein metabolism and progenitor cell function.Kidney Int,2009,76(7):751-759.
21 Ziegler TR,Lazarus JM,Young LS,et al.Effects of recombinant human growth hormone in adults receiving maintenance hemodialysis.J Am Soc Nephrol,1991,2(6):1130-1135.
22 Pupim LB,Flakoll PJ,Yu C,et al.Recombinant human growth hormone improves muscle amino acid uptake and whole-body protein metabolism in chronic hemodialysis patients.Am J Clin Nutr,2005,82(6):1235-1243.
23 Siew ED,Pupim LB,Majchrzak KM,et al.Insulin resistance is associated with skeletal muscle protein breakdown in non-diabetic chronic hemodialysis patients.Kidney Int,2007,71(2):146-152.
24 Gilson H,Schakman O,Kalista S,et al.Follistatin induces muscle hypertrophy through satellite cell proliferation and inhibition of both myostatin and activin.Am J Physiol Endocrinol Metab,2009,297(1):E157-164.
25 Miyamoto T,Carrero JJ,Qureshi AR,et al.Circulating follistatin in patients with chronic kidney disease:implications for muscle strength,bone mineral density,inflammation,and survival.Clin J Am Soc Nephrol,2011,6(5):1001-1008.
26 Kung T,Springer J,Doehner W,et al.Novel treatment approaches to cachexia and sarcopenia:highlights from the 5th Cachexia Conference.Expert Opin Investig Drugs,2010,19(4):579-585.
(本文编辑 心 平 凡 心)
The pathogenesis and treatment of uraemic sarcopenia
RENHongqi,GONGDehua
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
Sarcopenia is a syndrome characterized by progressive and generalized loss of skeletal muscle mass and strength. Ageing is associated with sarcopenia, and end-stage renal disease accelerates the normal physiological muscle wasting resulting in an increasing prevalence of sarcopenia, which is named uraemic sarcopenia. There are several mechanisms that may be involved in the onset and progression of uraemic sarcopenia, such as hormones, changes in immune and muscle cells, metabolic acidosis, reducing protein intake and so on. Uraemic sarcopenia presents a high probability for morbidity and mortality, and consequently a high priority for muscle wasting prevention and treatment in these patients.
uraemic sarcopenia pathogenesis
国家科技支撑计划项目(2013BAI09B04)(2015BAI12B05);江苏省临床医学中心项目(BL2012007)
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2015-03-07

