生物样本库中血液样本microRNA和DNA的检测方法学探讨
蒋超,曹日昇,陈俊娣,石厚霞,黄娟,刘翠萍
我院生物样本库主要收集和存储肿瘤患者的血样和组织及相关的信息,其功能是为肿瘤临床和基础研究提供合格的研究对象。生物样本库是今后精准医疗不可缺少的重要组成部分,其在肿瘤疾病预测、诊断及治疗上变得极为重要[1-2]。有研究表明[3-5],很多肿瘤患者的外周血清或血浆中都具有特异性的循环 miRNA 的表达,血清或血浆中特异性的 miRNA 具有作为肿瘤标志物的可能。胃癌患者中 miR-378 以及肝癌患者中 miR-21 的表达都已成为标记物。这些研究充分证实,血清及血浆miRNA 的测定是一个检测癌症生物学标志物很有前途的领域。近年来,人类已进入后基因组时代,需要对个体遗传差异进行研究。这种研究需要从生物血液样本中提取 DNA,因此血样样本作为生物样本库中的重要组成部分,其保存和提取的质量直接关系到后续的科学研究的结果。目前国内大部分的生物样本的质控主要围绕冻存组织的蛋白质量或者 RNA 完整性的研究,有关样本库中的血样标本中 miRNA 检测以及血凝块中 DNA 质量的检测尚未见报道。本文随机抽取血浆标本进行了包括血浆中 miRNA 以及血凝块 DNA 的提取方法的摸索,进而建立一套生物样本库中较为规范的血样的质控体系。
1 材料与方法
1.1 材料
1.1.1 研究样本 随机选取 2012 – 2014年来自南京医科大学第一附属医院生物样本库,–80℃低温冰箱中冻存的胃癌、肝癌的冻存血浆各 10 管,每管体积约 200 μl。同时随机选取期间存储于深低温冰箱的 10 份血凝块标本。
1.1.2 实验试剂 miRNA 专用提取试剂盒miRNeasymini kit 和全血基因组 DNA 提取试剂盒均购自德国 Qiagen 公司;miRNA 逆转录试剂盒购自日本 Takara 公司;Q-PCR 试剂盒购自美国Roche 公司;其中 miRNA 引物由广州锐博公司设计并合成。
1.1.3 仪器 Nanodrop 2000 超微量分光光度计为美国 Thermo 公司产品;Stepone 定量 PCR 仪为美国 ABI 公司产品;Bioptic Qsep100 全自动核酸分析仪为台湾光鼎公司产品。
1.2 方法
1.2.1 血液样本的标准化收集,处理及存储 血样标本由手术室护士采集,一般为手术麻醉前外周静脉血。每例捐赠者提供的全血数量至少为6 ml,其中 3 ml 全血用于分离血清,3 ml 全血用于分离血浆。在采血管上记录患者的姓名、门诊(或住院号)等基本信息,后放置 4℃冰箱。待收集完所有血样后,交样本库操作人员进行处理。采集的血液在室温 25℃放置 30min 凝血。然后放入离心机,以 3000 r/min 离心 10min,220 μl/管分装,共分装 5 管,血凝块放入 1.8 ml 冻存管,同时贴冷冻管理系统标准码标签。标明:年-标本类型-流水号-标本种类-管数,及时放入超低温冰箱保存。登录样本信息,将采集到的血液样本和记录表输入信息管理系统中。
1.2.2 血浆中 miRNA 的提取 随机抽取存储的血浆样本,每份约 200 μl,按照血清 miRNA 的提取试剂盒操作说明进行提取。然后取 1 μl 的 RNA在超微量分光光度计上进行浓度和纯度的测定。本研究中使用的参照物是外源性的 cel-miR-39,一般200 μl 血浆样本中加入 10 μl 浓度为100 nmol/L的 cel-miR-39。
1.2.3 RT 以及 Q-PCR 检测 miRNA 的表达 本研究按照 Takara 反转录试剂盒说明,将血浆中所提取 miRNA 反转录为cDNA,分别加入对应的 RT Primer,后续以合成的 cDNA 为模板,利用 SYBR Green PCR 试剂盒进行 Q-PCR,反应条件如下:95℃预热 10min;然后 95℃,15 s,60℃,1min,共 40 个循环。以线虫 cel-miR-39 作为外参照,实验结束后,观察样本的 Ct 值和溶解曲线图以及各样本的扩增曲线图。
1.2.4 血凝块 DNA 的提取与鉴定 随机选取2012 – 2014年存于 –80℃的血凝块标本,每份样本约 1 ml,按照 Qiagen 小提试剂盒的说明书进行全血基因组 DNA 的提取。分别各取 1 μl DNA 样本,进行基因组 DNA 的纯度和浓度的检测。同时将提取后的约 5 μl DNA 样本,通过全自动核酸分析仪检测,根据分析所得的峰形图以及电泳图,判断检测所提取 DNA 样本的完整性。该方法将比传统的水平电泳跑胶更方便、快捷,尽量减少人为因素造成的误差,以求检测流程的标准化。
2 结果
2.1 血清中 miRNA 的相对定量表达情况
血浆标本提取 miRNA 后,运用核酸定量仪测定OD值,OD260/OD280的比值范围均在 1.2~1.5,(分别为1.30±0.12、1.29±0.09、1.37±0.12);浓度在 20~50 ng/μl(分别为20.31±5.17、17.25±2.83、19.93±4.86),溶解体系为20 μl。结果表明本研究中,按照试剂盒方法可获得一定纯度和浓度的 RNA(图1)。
同时将人工合成的 cel-miR-39 作为外参,cel-miR-39 基因 Q-PCR 产物的溶解曲线约在76.98℃(图2A),miR-21 基因 Q-PCR 产物的溶解曲线峰值约在 78.01℃(图2B),miR-378 基因Q-PCR 产物的溶解曲线峰值约在 79.06℃(图2C)。目的基因与内参基因的溶解温度较为均一,峰的形态明显,显示扩增的为特异性序列;图2D~2F 分别为cel-miR-39 基因、miR-21、miR-378 的扩增曲线图。其中,不同存储时间的血浆标本中 miR-21和 miR-378 的 Ct 值变化见图3。

图1 不同储存时间中血浆样本 miRNA 提取后的纯度和浓度(A:RNA 浓度;B:RNA 纯度)Figure 1 Purity and concentration of plasma samples after miRNA extraction in different storage time (A: RNA concentration; B:RNA purity)
2.2 血凝块 DNA 的完整性鉴定
将抽取的血凝块样本,分别提取基因组的DNA,通过全自动核酸分析仪对提取后 DNA 的峰形图进行完整性分析,发现所提取的 DNA 的片段大部分集中在 1000 bp 以外,同时对应的电泳图上可见 DNA 条带比较集中,没有呈现弥散状(图4),同时测得的 DNA 的纯度均在范围内(OD260/280=1.6~2.0),DNA 的浓度在 100~300 ng/μl。
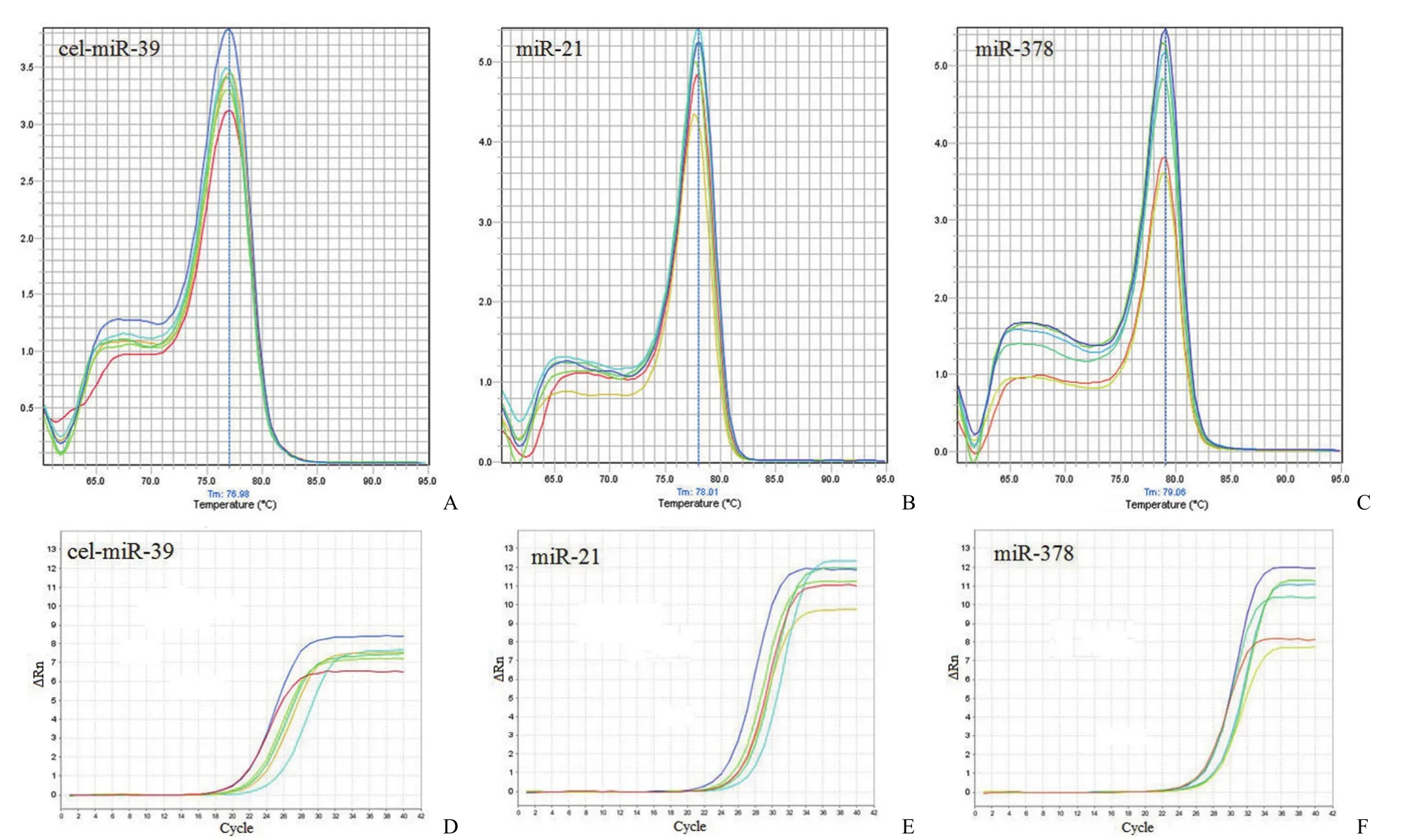
图2 血浆样本中 cel-miR-39、miR-21 和 miR-378 的溶解曲线图和扩增曲线图Figure 2 The dissolution curves and the amplification curves of miR-378, miR-21 and cel-miR-39 in plasma samples
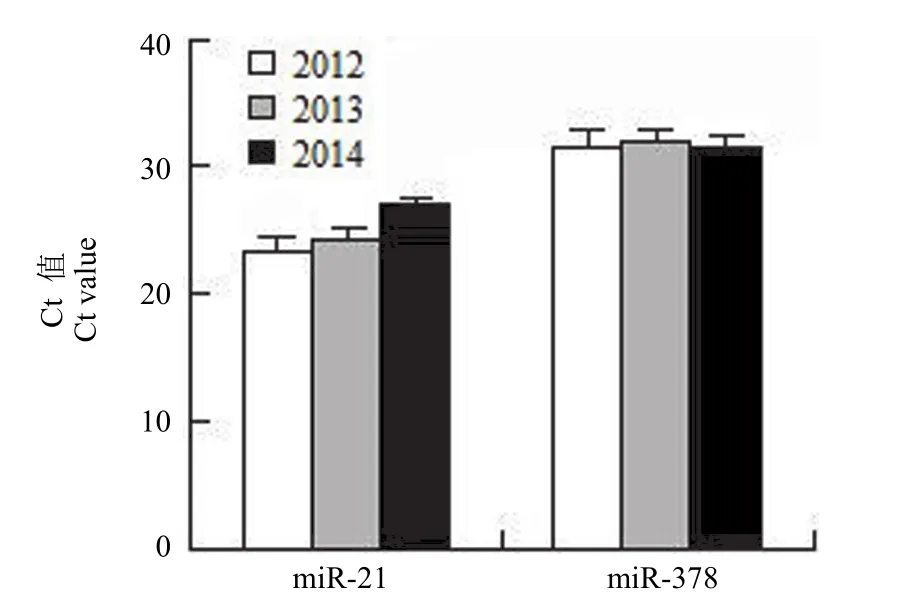
图3 不同存储时间的血浆标本中 miR-21 和 miR-378的表达Figure 3 Expression of miR-21 and miR-378 in plasma samples with different storage time
3 讨论
miRNA 是一类非编码小 RNA 分子,通常在转录后水平调控基因表达,诱导靶 miRNA 降解或阻遏其转录后翻译。从近年大量的研究发现,血浆中的 miRNA 很早就被用作于肿瘤疾病诊断的生物标记物[6-8]。目前,在大量的肿瘤基因研究中,血浆中 miRNA 的特异性表达越来越受到重视。因此作为肿瘤生物样本库中的重要组成部分,血样标本中 miRNA 的检测显得尤为重要。同时,基因组DNA 可以从冻存组织块或血液样本中提取,为后续个体遗传差异的研究提供了科学基础。
本研究提供了生物样本库从血样本的收集、处理、存储到 miRNA 的提取以及血凝块 DNA 的提取和鉴定流程。通过随机抽取存储 1、2 和 3年的肝癌和胃癌血浆样本进行 miRNA 的检测,发现基本都能检测出特异性的 miRNA 的表达。普通Trizol 方法提取的 RNA 核酸的OD260/OD280在1.8~2.0 是较为理想的。由于血浆中 RNA 的丰度低和种类少,所以提取后的 RNA 不可能达到细胞或组织中 RNA 的提取标准。但是通过后续的Q-PCR 实验的论证,基本都能扩增出对应的miRNA 的曲线。同时,本研究中使用的外对照是线虫的 cel-miR-39,表达量相对稳定。没有使用内参 U6,主要是因为U6 snRNA 在血浆中的表达不是很稳定,不适宜作为循环 miRNA 定量的内参[9-10]。血凝块 DNA 的提取采用 Qiagen 试剂盒的方法,步骤简单,同时能做到提取过程的标准化,可作为今后生物样本库中核酸质量控制的理论基础。实验结果也表明,本院生物样本库中存储的血样本的血凝块保存条件符合标准,在核酸质量方面基本能够满足后续临床研究的进一步深入。

图4 血凝块基因组 DNA 的完整性鉴定Figure 4 Complete identification of the genomic DNA of blood clot
[1]Knudsen ES, O'Reilly EM, Brody JR, et al.Genetic diversity of pancreatic ductal adenocarcinoma and opportunities for precision medicine.Gastroenterology, 2015.[Epub ahead of print]
[2]Printz C.Precision medicine initiative boosts funding for NCI efforts:Proposal would help broaden availability of targeted therapies.Cancer,2015, 121(19):3369-3370.
[3]Ahmad J, Hasnain SE, Siddiqui MA, et al.MicroRNA in carcinogenesis & cancer diagnostics: a new paradigm.Indian J Med Res, 2013, 137(4):680-694.
[4]Zhang Z, Li Z, Gao C, et al.miR-21 plays a pivotal role in gastric cancer pathogenesis and progression.Lab Invest, 2008, 88(12):1358-1366.
[5]Lee DY, Deng Z, Wang CH, et al.MicroRNA-378 promotes cell survival, tumor growth, and angiogenesis by targeting SuFu and Fus-1 expression.Proc Natl Acad Sci U S A, 2007, 104(51):20350-20355.
[6]Zhang YC, Xu Z, Zhang TF, et al.Circulating microRNAs as diagnostic and prognostic tools for hepatocellular carcinoma.World J Gastroenterol, 2015, 21(34):9853-9862.
[7]Taylor DD, Gercel-Taylor C.MicroRNA signature of tumor-derived exosomes as diagnostic biomarkers of ovarian cancer.Gynecol Oncol,2008, 112(1):13-21.
[8]Chen X, Ba Y, Ma L, et al.Charaeterization of microRNAs in serum:a novel elass of biomarkers for diagnosis of eaneer and other diseases.Cell Res, 2008, 18(10):997-1006.
[9]Jia B, Chang Z, Wei X, et al.Plasma microRNAs are promising novel biomarkers for the early detection of Toxoplasma gondii infection.Parasit Vectors, 2014, 7:433.
[10]Zhang XJ, Dong J, Ma HX, et al.Discussion and establishment of serum/plasma microRNA test method.Acta Univ Med Nanjing (Nat Sci), 2011, 31(4):529-531.(in Chinese)张晓娟, 董静, 马红霞, 等.血清/血浆microRNA检测方法探讨与建立.南京医科大学学报(自然科学版), 2011, 31(4):529-531.

