糖尿病肾病患者心血管钙化的发生率及特点
安 玉 张丽华 葛永纯 杨 柳 李 康 徐 峰 章海涛 刘志红
糖尿病肾病患者心血管钙化的发生率及特点
安 玉 张丽华 葛永纯 杨 柳 李 康 徐 峰 章海涛 刘志红
目的:观察糖尿病肾病患者心血管钙化的发生情况,并分析其影响因素。 方法:选取慢性肾脏病(CKD)2~5 期非透析糖尿病肾病患者270例(2期40例、3期121例、4期63例、5期46例),完善心血管钙化的相关实验室检查,选用螺旋CT评分冠状动脉钙化,腹部侧位平片评分腹主动脉钙化,心脏彩超观察心脏瓣膜钙化情况,并采用Logistic回归分析心血管钙化的相关危险因素。 结果:CKD 2~5期患者血磷逐渐升高,血钙逐渐降低,全段甲状旁腺激素逐渐升高,25羟维生素D逐渐下降(P<0.01)。所有患者心血管钙化发生率为70.3%,其中冠状动脉钙化、腹主动脉钙化和瓣膜钙化发生率分别为55.1%、43.4%和23.9%。CKD 2~5期心血管钙化的总发生率分别为72.5%、73.6%、66.7%和63.0%。心血管钙化与年龄、糖尿病病程、高血压病程、心血管疾病史、颈部血管粥样斑块等相关,而与性别、血脂异常、血钙、血磷、全段甲状旁腺激素及CKD分期无关。其中年龄、心脑血管疾病史和颈部血管粥样斑块是冠状动脉和腹主动脉钙化的独立危险因素,年龄是心脏瓣膜钙化的独立危险因素。 结论:糖尿病肾病患者心血管钙化发生率高,在CKD 2期钙磷代谢紊乱不明显时即已出现明显钙化。心血管钙化发生率与传统心血管疾病危险因素相关,而与钙磷代谢指标及CKD分期无显著相关。
糖尿病肾病 慢性肾脏病矿物质与骨异常 心血管钙化
心血管钙化是慢性肾脏病矿物质与骨异常(CKD-MBD)的重要组成部分,是心血管事件发生率和死亡率的重要预测因子[1]。除传统的心血管危险因素(如高龄、高血压、高血脂、吸烟、肥胖等)外[2-4],尚有多种与慢性肾脏病(CKD)相关的因素参与了心血管钙化的发生和发展[5~6]。糖尿病是引起终末期肾病的主要病因之一,也是引起血管钙化的主要危险因素[7-8]。目前国内尚无糖尿病肾病患者心血管钙化的系统性研究。本研究通过评估糖尿病肾病CKD 2~5期非透析患者心血管钙化发生情况及严重程度,分析相关危险因素。
对象和方法
研究对象 选取糖尿病肾病CKD 2~5期非透析患者共270例。入选标准:(1)年龄18~65岁;(2)2型糖尿病患者,且持续尿白蛋白定量≥30 mg/24h和(或)估计的肾小球滤过率(eGFR)<60 ml/(min·1.73m2),经肾活检诊断糖尿病肾病或临床符合糖尿病肾病特点;(3)符合2002年K/DOQI关于CKD 2~5期诊断标准[9],且均未进入维持性透析患者;(4)患者签署知情同意书。排除标准:(1)接受肾脏替代治疗者;(2)患者预期寿命<6个月;(3)存在急性肾损伤患者;(4)患者活动性炎症性疾病;(5)确诊肿瘤或原发性甲状旁腺功能亢进患者;(6)肾活检明确诊断为非糖尿病肾病者。
观察指标 患者空腹留血查血常规、肾功能、胆固醇、三酰甘油、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、血糖、糖化血红蛋白及血钙、血磷、碱性磷酸酶、血清全段甲状旁腺激素(iPTH)、25羟维生素D[25(OH)D],并完善24h尿蛋白检查,有条件者完善颈部血管彩超检查。记录患者年龄、性别、身高、体重、血压、糖尿病病程、高血压病程、吸烟史、既往有无心血管疾病(CVD)病史、近3个月内调节钙磷代谢的药物使用史等。
采用螺旋CT平扫冠状动脉,Siemens CaScoring钙化积分软件冠脉CT检测冠状动脉钙化评分(CAC评分)[10],采用侧位腹部平片检测腹主动脉钙化情况,应用Kauppila等描述的技术检测腹主动脉钙化评分(AAC评分)[11]。通过二维超声心动图检查,评价有无心脏瓣膜钙化。
相关指标定义 运用CKD-EPI公式计算eGFR[12]。CVD病史定义为冠脉事件(心肌梗死、心绞痛、不稳定型心绞痛、冠脉搭桥手术,经皮冠状动脉腔内成形术和充血性心力衰竭)及脑血管事件(脑卒中和短暂性脑缺血发作)。
钙磷达标情况根据中华医学会肾脏病学分会制定的“慢性肾脏病矿物质与骨异常诊治指导”[13],血磷达标定义为血磷0.87~1.45 mmol/L,血钙达标定义为血钙2.1~2.5 mmol/L。当血清白蛋白<40 g/L时,采用校正钙评价血清钙水平。
心血管钙化发生率定义为存在冠状动脉、腹主动脉、大动脉或瓣膜任一处钙化。心血管钙化严重程度通过积分表示。CAC评分:<5分:钙化不明显;5~100分:轻度钙化;101~400分:中度钙化;>400分:重度钙化。AAC评分:1~4分:轻度钙化;5~6分:中度钙化;≥7分:重度钙化。
统计方法 采用SPSS 18.0统计软件进行统计分析。计量资料以均数±标准差或中位数(四分位间距)表示,分类变量以百分比表示。正态分布的数据,组间比较采用t检验,率的比较采用卡方检验。利用Logistic回归分析判断各相关因素对心血管钙化及其严重程度的影响。所有检验均为双侧检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
研究结果
一般资料 本研究共纳入270例2型糖尿病患者,其中男性共214例(79.3%),平均年龄(51.4±8.6)岁,糖尿病病程为(9.93±5.78)年,平均eGFR(37.7±21.6) ml/(min·1.73m2)。其中9例患者尿检表现为微量白蛋白尿,261例患者均表现为显性蛋白尿[平均(4.54±3.41) g/24h]。263例患者取得CAC结果,265例患者取得AAC结果,234例患者取得瓣膜钙化结果,149例患者同时进行了颈部血管彩超评估。
钙磷代谢及心血管钙化的总体情况 本组患者平均血磷(1.30±0.25) mmol/L(0.78~2.74 mmol/L),血钙(2.23±0.14) mmol/L(1.79~2.82 mmol/L),血磷达标率76.7%,血钙达标率84.4%,高磷血症及低钙血症发生率分别为22.6%和13.7%,低磷血症和高钙血症发生率分别为0.7%和1.9%。iPTH(71.9±66.8) pg/ml(9.9~378.5 pg/ml),其中59.3%患者iPTH处于正常范围(15~65 pg/ml),22.1%患者iPTH超过正常范围,但在正常值2倍上限以内(65~130 pg/ml),14.1%患者iPTH处于正常上限2~6倍(130~390 pg/ml),无一例患者iPTH超出正常上限6倍。平均25(OH)D为(7.48±5.89) pg/ml(3.0~37.52 pg/ml)。
影像学可见任一部位钙化发生率为70.3%,其中冠状动脉、腹主动脉和心脏瓣膜钙化的发生率分别为55.1%、43.4%和23.9%(图1)。CAC评分中位数为3.9(四分位间距0,98.75),评分在5~100分的轻度钙化者占43.4%。AAC评分中位数为0(四分位间距0,2.5),评分在1~4分的轻度钙化者占70.4%。瓣膜钙化以主动脉瓣钙化为主(89.3%),其次为二尖瓣钙化(35.7%),其中两者联合钙化的患者占26.8%(图2)。

图1 典型病例的影像学表现A:冠状动脉钙化评分2 074分;B:腹主动脉钙化评分15分;C:主动脉瓣钙化
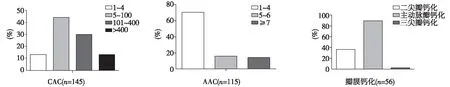
图2 根据钙化程度分层时CAC(A)、AAC(B)及瓣膜钙化(C)的分布CAC:冠状动脉钙化;AAC:腹主动脉钙化
不同CKD分期钙磷代谢及心血管钙化比较 本组患者中CKD 2~5期分别为40例,121例,63例和46例,各期在年龄、性别、体质量指数、糖尿病病程、高血压病程、心血管疾病病史、颈部血管粥样斑块及血脂代谢方面未发现差异。自CKD 2~5期,尿蛋白逐渐增加,血清肌酐逐渐升高,空腹血糖及糖化血红蛋白依次降低而收缩压升高(表1)。
自CKD 2~5期,患者血磷逐渐升高,血钙逐渐降低,iPTH逐渐升高,而25(OH)D逐渐下降(P<0.01)(表1),血磷、血钙达标率下降趋势明显(图3)。CKD 2期血磷及血钙达标率均为90.0%,CKD 3期血磷达标率为86.0%,血钙达标率为91.7%,而CKD5期患者血磷达标率仅为39.1%,血钙达标率为69.6%。但CKD各期患者血磷较正常值上升并不明显,CKD 5期平均血磷仅为(1.51±0.30) mmol/L,平均iPTH为(150.1±93.2) pg/ml,且均未超出正常上限6倍。
不同CKD分期患者心血管钙化发生率无显著统计学差异(表2),CKD 2~5期钙化的总发生率分别为72.5%、73.6%、66.7%和63.0%。根据CAC及AAC评分对血管钙化严重程度进行分层后,CKD各期在血管钙化的严重程度方面仍无统计学差异(Ptrend<0.05)。自CKD 2~5期,重度腹主动脉钙化的比例逐渐增加,分别为9.1%、11.1%、13.3%和19.0%,但差异无统计学意义(图4)。
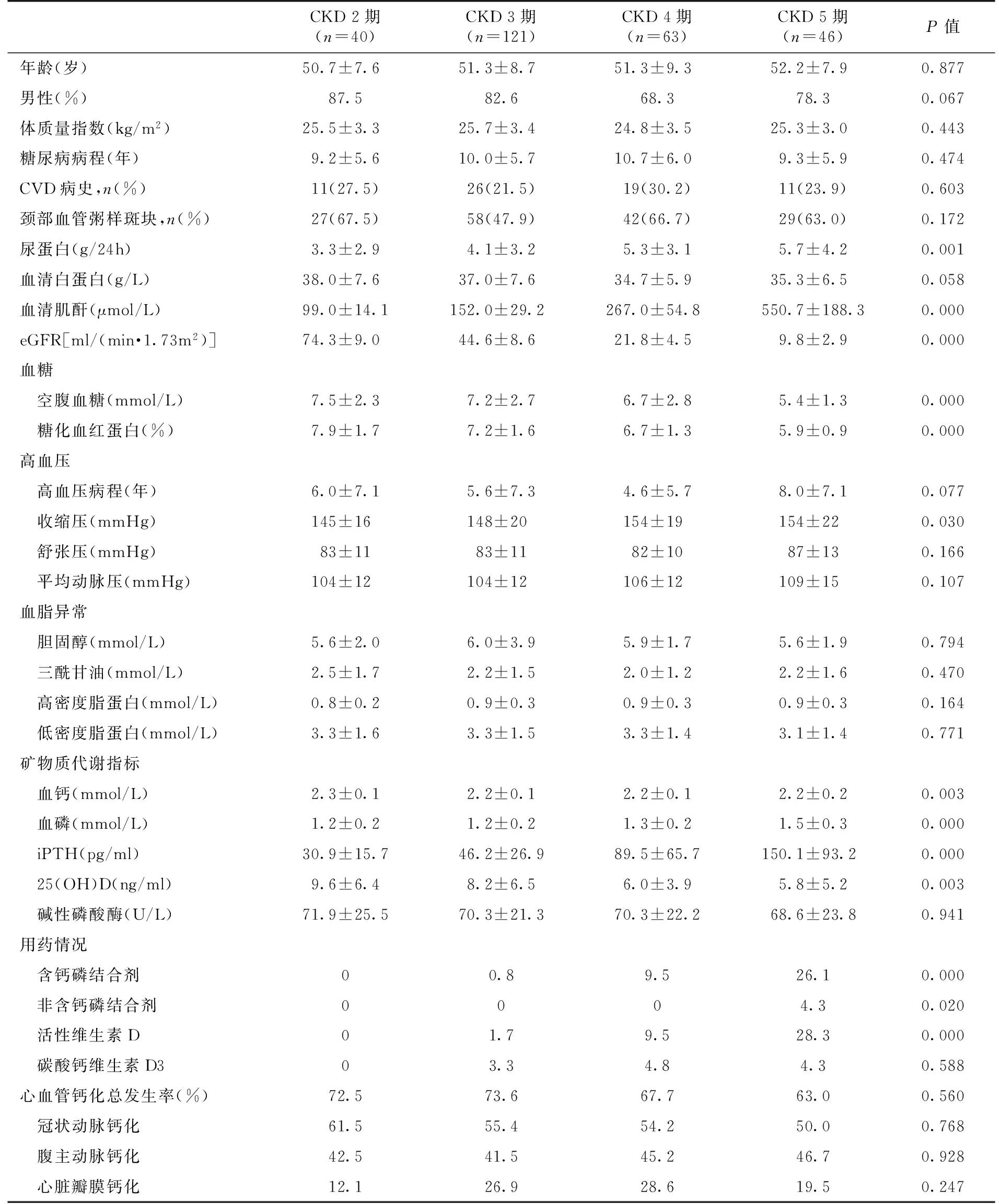
表1 不同CKD分期患者临床资料与心血管钙化比较
CKD:慢性肾脏病;CVD:心血管疾病;eGFR :估算的肾小球滤过率;iPTH:全段甲状旁腺激素;25(OH)D:25羟维生素D
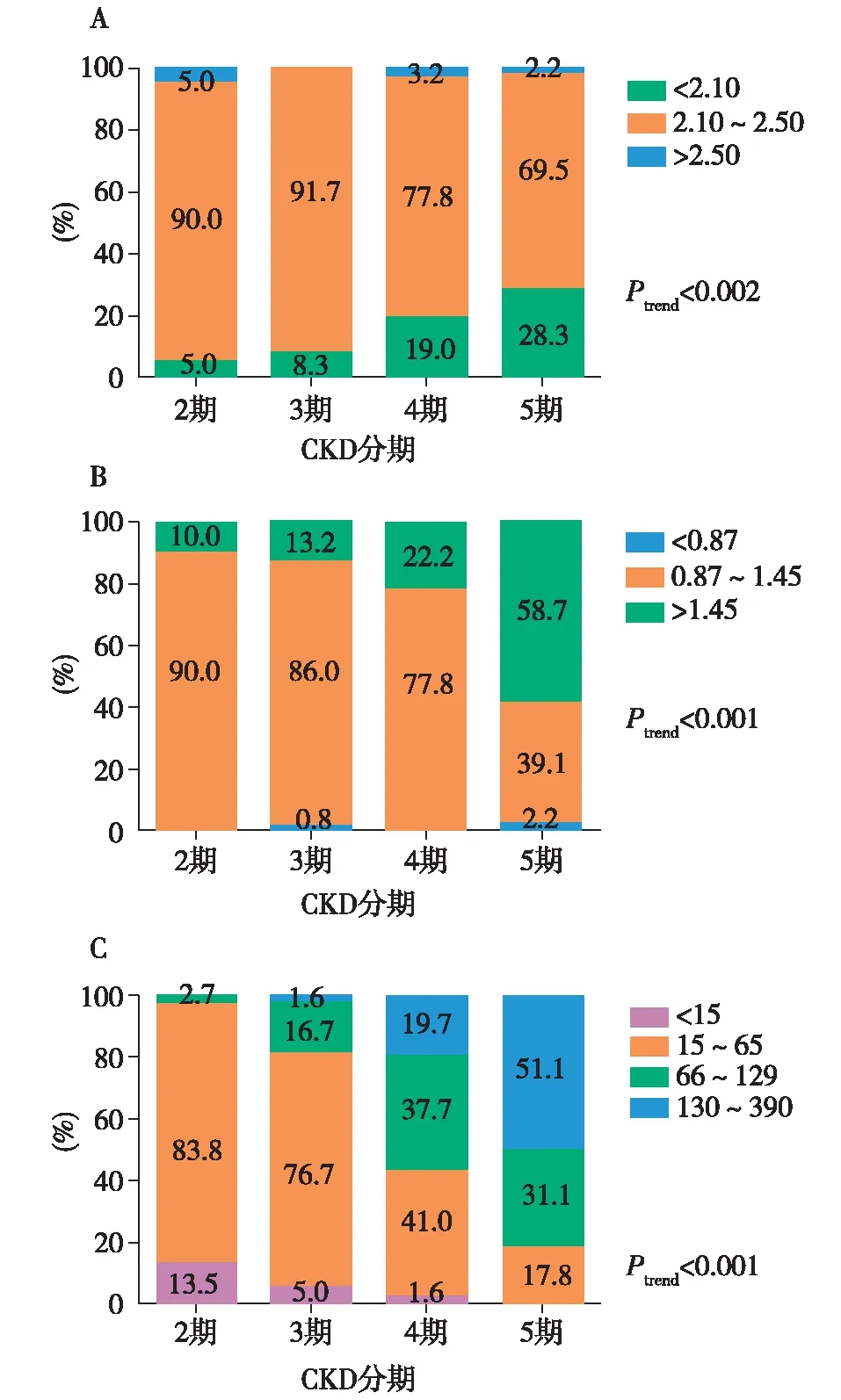
图3 不同CKD分期患者钙(A)、磷(B)及iPTH(C)分布情况比较CKD:慢性肾脏病;iPTH:全段甲状旁腺激素
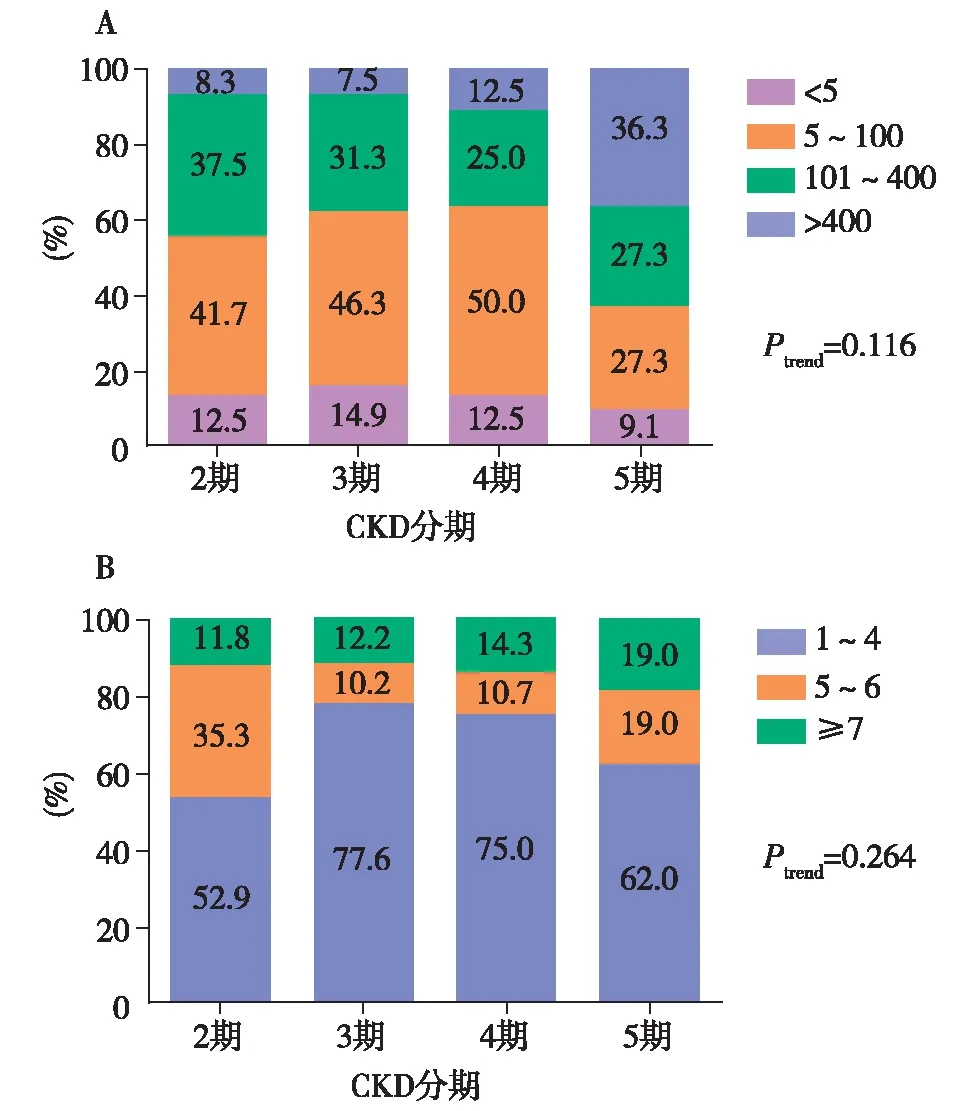
图4 不同慢性肾脏病(CKD)分期患者冠状动脉(A)及腹主动脉钙化(B)严重程度比较
心血管钙化的危险因素分析 以是否存在钙化为界点进行Logistic回归,结果显示年龄、糖尿病病程、高血压病程、CVD病史、颈部血管粥样斑块是冠状动脉及腹主动脉钙化的危险因素,而心脏瓣膜钙化则与年龄和高血压病程相关。性别、吸烟史、血脂异常、血钙、血磷、iPTH、25(OH)D、影响钙磷代谢药物及CKD分期等则与心血管钙化的发生无显著相关性。多因素分析显示年龄、CVD病史及颈部血管粥样斑块是冠状动脉和腹主动脉钙化的独立危险因素,而年龄是心脏瓣膜钙化的唯一的独立危险因素(表2)。

表2 糖尿病肾病(CKD 2~5期非透析)患者心血管钙化影响因素分析
CKD:慢性肾脏病;CAC:冠状动脉钙化;AAC:腹主动脉钙化;CVD:心血管疾病
讨 论
CKD-MBD是影响CKD患者生命和生活质量的主要因素之一。有证据表明,当GFR<60 ml/(min·1.73m2)时,肾脏对磷的清除下降,血磷升高,随之出现一系列病理生理反应,构成CKD-MBD发生和发展的恶性循环[14]。高磷血症是引发CKD继发性甲状旁腺功能亢进、矿物质与骨代谢异常及转移性钙化的始动因素,也是患者预后不良的主要危险因素[15-16]。目前KDIGO及中华医学会肾脏病学会的CKD-MBD指南均推荐从CKD 3期开始动态监测相关指标[1,13]。
本研究证实,10%的糖尿病肾病CKD 2期患者已存在高血磷。随CKD进展,血磷逐渐升高,血钙逐渐降低,iPTH逐渐升高,而25(OH)D及钙磷达标率逐渐下降,这与以往研究结果一致[17-18]。但本研究中糖尿病肾病CKD患者血磷较正常值上升并不明显,CKD 5期平均血磷仅为(1.51±0.30) mmol/L,平均iPTH为(150.1±93.2) pg/ml,均未超出正常上限6倍。
糖尿病肾病患者的心血管钙化发生率高于普通人群[19],且在CKD早期即已出现较明显的心血管钙化。以往研究表明,在<30岁和<40岁的1型糖尿病患者冠状动脉钙化比例分别为18%和50%,而非糖尿病者的比例为1%和27%[20,21]。病程超过20个月、平均年龄58岁的1型和2型糖尿病患者,重度冠状动脉钙化(CAC≥400分)的比例为25.9%,在随机选择的非糖尿病对照及年龄、性别、高血压等危险因素相匹配的非糖尿病对照人群,该比例分别为7.2%和14.4%[7]。平均年龄为(57±1.5)岁的2型糖尿病患者,当尿白蛋白排泄率>30 mg/min时,冠状动脉钙化发生率为94%,重度冠状动脉钙化比例为41%[22]。本研究中,糖尿病肾病合并肾功能损伤患者心血管钙化的总发生率为70.3%。CKD 2期心血管钙化发生率已达72.5%,提示对糖尿病肾病合并肾功能损伤患者,应更早进行心血管钙化的评估。
以往研究显示,血管钙化与高龄、高血压、高血糖、高脂血症、肥胖、吸烟等有关[2-4]。本研究证实了糖尿病肾病CKD患者心血管钙化的发生率与传统的心血管危险因素具有相关性,其中年龄是心血管钙化的独立危险因素,这和我们在维持性血液透析患者中观察的结果一致[23]。
一项纳入1 908例慢性肾功能不全患者的研究显示,GFR下降与冠状动脉钙化的发生率及严重程度线性相关[24]。与无白蛋白尿患者相比,合并白蛋白尿的糖尿病患者冠状动脉钙化的发生率更高,且程度更严重[22]。本研究未发现糖尿病肾病心血管钙化与CKD分期及钙磷代谢之间的相关性,可能与本研究仅为单中心、小样本的横断面研究,研究设计局限有关,更多糖尿病心血管钙化与CKD-MBD相关性的探讨有待多中心、大样本的研究进一步阐述。
此外,在本研究中随CKD进展,重度腹主动脉钙化的比例逐渐增加,但差异无统计学意义,这也可能和我们的样本量较小有关。目前对于血管钙化的具体机制仍不明了,其形成可能与遗传易感性、成骨细胞多样性、骨转化、氧化应激、炎症反应等多种病理生理机制有关[25]。我们推测在CKD早期糖尿病肾病患者的心血管钙化主要由传统的心血管危险因素参与,但随着CKD进展引发的病理生理反应可能加重了心血管钙化的进程。
本研究为单中心横断面研究,无远期随访资料,未观察药物干预对糖尿病合并CKD患者心血管钙化的影响。此外,本研究中纳入的CKD各期患者分布不均衡,以CKD 3期为主,CKD 2期及5期患者较少,由此造成了一定程度的样本偏倚。
小结:本研究结果显示,糖尿病肾病CKD患者钙磷代谢紊乱多发生在CKD 3期,但在CKD 2期就有72.5%患者发生心血管钙化,由此可见血管钙化发生早,且发生率高。心血管钙化发生率与传统心血管疾病危险因素相关,未发现与钙磷代谢异常及CKD分期显著相关性。
1 Kidney Disease:Improving Global Outcomes (KDIGO) CKD-MBD Work Group.KDIGO clinical practice guideline for the diagnosis,evaluation,prevention,and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD).Kidney Int Suppl,2009,(113):S1-130.
2 Honkanen E,Kauppila L,Wikström B,et al.Abdominal aortic calcification in dialysis patients:results of the CORD study.Nephrol Dial Transplant,2008,23(12):4009-4015.
3 Oyama N,Gona P,Salton CJ,et al.Differential impact of age,sex,and hypertension on aortic atherosclerosis:the Framingham Heart Study.Arterioscler Thromb Vasc Biol,2008,28(1):155-159.
4 Mizobuchi M,Towler D,Slatopolsky E.Vascular calcification:the killer of patients with chronic kidney disease.J Am Soc Nephrol,2009,20(7):1453-1464.
5 Goodman WG,Goldin J,Kuizon BD,et al.Coronary-artery calcification in young adults with end-stage renal disease who are undergoing dialysis.N Engl J Med,2000,342(20):1478-1483.
6 Goodman WG,Goldin J,Kuizon BD,et al.Impact of serum calcium and phosphate on coronary atherosclerosis detected by cardiac computed tomography.Eur Heart J,2012,33(22):2873-2881.
7 Schurgin S,Rich S,Mazzone T.Increased prevalence of significant coronary artery calcification in patients with diabetes.Diabetes Care,2001,24(2):335-338.
8 Erbel R,Lehmann N,Churzidse S,et al.Progression of coronary artery calcification seems to be inevitable,but predictable - results of the Heinz Nixdorf Recall (HNR) study.Eur Heart J,2014,35(42):2960-2971.
9 National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease:evaluation,classification,and stratification.Am J Kidney Dis,2002,39(2 Suppl 1):S1-266.
10 Agatston AS,Janowitz WR,Hildner FJ,et alQuantification of coronary artery calcium using ultrafast computed tomography.J Am Coll Cardiol,1990,15(4):827-832.
11 Kauppila LI,Polak JF,Cupples LA,et al.New indices to classify location,severity and progression of calcific lesions in the abdominal aorta:a 25-year follow-up study.Atherosclerosis,1997,132(2):245-250.
12 Levey AS,Stevens LA,Schmid CH,et al.A new equation to estimate glomerular filtration rate.Ann Intern Med,2009,150(9):604-612.
13 王莉,李贵森,刘志红,等.中华医学会肾脏病学分会《慢性肾脏病矿物质和骨异常诊治指导》.肾脏病与透析肾移植杂志,2013,22(6):554-559.
14 刘志红,李贵森.重视慢性肾脏病-矿物质和骨异常的诊断和治疗.肾脏病与透析肾移植杂志,2013,22(6):501-503.
15 Block GA,Klassen PS,Lazarus JM,et al.Mineral metabolism,mortality,and morbidity in maintenance hemodialysis.J Am Soc Nephrol,2004,15(8):2208-2218.
16 Palmer SC,Hayen A,Macaskill P,et al.Serum levels of phosphorus,parathyroid hormone,and calcium and risks of death and cardiovascular disease in individuals with chronic kidney disease:a systematic review and meta-analysis.JAMA,2011,305(11):1119-1127.
17 Levin A,Bakris GL,Molitch M,et al.Prevalence of abnormal serum vitamin D,PTH,calcium,and phosphorus in patients with chronic kidney disease:results of the study to evaluate early kidney disease.Kidney Int,2007,71(1):31-38.
18 Vassalotti JA,Uribarri J,Chen SC,et al.Trends in mineral metabolism:Kidney Early Evaluation Program (KEEP) and the National Health and Nutrition Examination Survey (NHANES) 1999-2004.Am J Kidney Dis,2008,51(4 Suppl 2):S56-68.
19 Kramer H,Toto R,Peshock R,et al.Association between chronic kidney disease and coronary artery calcification:the Dallas Heart Study.J Am Soc Nephrol,2005,16(2):507-513.
20 Dabelea D,Kinney G,Snell-Bergeon JK,et al.Effect of type 1 diabetes on the gender difference in coronary artery calcification:a role for insulin resistance? The Coronary Artery Calcification in Type 1 Diabetes (CACTI) Study.Diabetes,2003,52(11):2833-2839.
21 Starkman HS,Cable G,Hala V, et al.Delineation of prevalence and risk factors for early coronary artery disease by electron beam computed tomography in young adults with type 1 diabetes.Diabetes Care,2003,26(2):433-436.
22 Merjanian R,Budoff M,Adler S,et al.Coronary artery,aortic wall,and valvular calcification in nondialyzed individuals with type 2 diabetes and renal disease.Kidney Int,2003,64(1):263-271.
23 贾凤玉,徐斌,龚德华,等.维持性血液透析患者心血管钙化的发生率及分布特点.肾脏病与透析肾移植杂志,2014,23(5):401-406.
24 Budoff MJ,Rader DJ,Reilly MP,et al.Relationship of estimated GFR and coronary artery calcification in the CRIC (Chronic Renal Insufficiency Cohort) Study.Am J Kidney Dis,2011,58(4):519-526.
25 Evrard S,Delanaye P,Kamel S,etal.Vascular calcification:from pathophysiology to biomarkers.Clin Chim Acta,2015,438:401-414.
(本文编辑 律 舟 凡 心)
The incidence and characteristics of cardiovascular calcification in patients with diabetic nephropathy
ANYu,ZHANGLihua,GEYongchun,YANGLiu,LIKang,XUFeng,ZHANGHaitao,LIUZhihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210002,China
LIUZhihong(E-mail:liuzhihong@nju.edu.cn)
Objective:To evaluate the distribution of cardiovascular calcification and its risk factors in diabetic nephropathy patients with renal dysfunction. Methodology:Two hundred seventy diabetic nephropathy patients with renal dysfunction {chronic kidney disease (CKD) stages 2-5 and non-dialysis} were enrolled into this cross-sectional study.Coronary calcification score was detected by spiral computed tomography, abdominal aortic calcification score was detected by abdominal lateral radiographs, and the valve calcification was examined by cardiac ultrasound.Information about mineral disorder was collected.The related risk factors for cardiovascular calcification were evaluated by Logistic regression. Results:There were 40 patients in CKD stage 2, 121 in stage 3, 63 in stage 4 and 46 in stage 5.With the progression of CKD stages, the level of serum phosphorus was increased and serum calcium was decreased gradually, while the level of intact parathyroid hormone was increased and 25-Hydroxyvitamin D was decreased (P<0.01).The total calcification prevalence was 70.3% in these patients, and the prevalence of coronary calcification, abdominal aortic calcification and valve calcification was 55.1%, 43.4% and 23.9%, respectively.The total calcification prevalence in CKD stages 2~5 was 72.5%, 73.6%, 66.7% and 63.0%, respectively.The incidence of cardiovascular calcification was associated with the age, duration of diabetes, duration of hypertension, history of cardiovascular diseases and the present of carotid artery plaque.No significant correlations were observed between calcification and sex, dyslipidemia, serum phosphorus and calcium, intact parathyroid hormone or stages of CKD.Among those, age, history of cardiovascular diseases and the present of carotid artery plaque were independent risk factors for coronary and abdominal aortic calcification, while the age was the only independent risk factor for the valve calcification. Conclusion:The prevalence of cardiovascular calcification was high in diabetic nephropathy patients with renal dysfunction, even in early stage of CKD (stage 2) when mineral disorder was not obvious.The incidence of cardiovascular calcification was associated with traditional cardiovascular risk factors but not mineral disorder or stages of CKD.
diabetic nephropathy chronic kidney disease-mineral and bone disorder cardiovascular calcification
国家科技支撑计划课题(2013BAI09B04, 2015BAI12B05);江苏省临床医学中心项目(BL2012007);南京军区南京总医院院管课题(2014008)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 博士研究生(安 玉),国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
刘志红(E-mail:liuzhihong@nju.edu.cn)
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有
2015-04-20

