糖尿病肾病微量白蛋白尿患者肾脏组织损伤及病情变化的研究
葛永纯 谢红浪 徐 峰 汪 玲 钟永忠 安 玉 曾彩虹 刘志红
糖尿病肾病微量白蛋白尿患者肾脏组织损伤及病情变化的研究
葛永纯 谢红浪 徐 峰 汪 玲 钟永忠 安 玉 曾彩虹 刘志红
目的:观察影响2型糖尿病肾病(DN)患者尿微量白蛋白(MAU)进展和缓解的临床与病理因素,并分析其对肾小球滤过率(GFR)下降的影响。 方法:纳入尿白蛋白定量30~300 mg/24h,血清肌酐≤109.62 μmol/L,并愿意接受肾活检的2型DN患者61例。记录患者一般情况(基线年龄、糖尿病病程等)、临床指标(eGFR、血脂、血糖、尿白蛋白定量等)及病理指标(肾小球体积、系膜区面积百分比、基膜厚度、足细胞足突宽度等)。 结果:61例患者中失访7例,MAU进展组22例(40.74%),MAU稳定组25例(46.30%),MAU转阴组7例(12.96%)。MAU转阴组患者基线尿白蛋白定量显著低于稳定组和进展组[(103.05±53.88) mg/24hvs(139.58±76.88) mg/24hvs(192.58±97.64) mg/24h,P=0.025],高密度脂蛋白水平显著高于稳定组和进展组[(1.38±0.34) mmol/Lvs(0.94±0.23) mmol/Lvs(1.04±0.37) mmol/L,P=0.006],足细胞裂孔膜分布密度显著高于稳定组和进展组[(1.01±0.21) 个/μmvs(0.78±0.21) 个/μmvs(0.58±0.30) 个/μm,P=0.003]。多因素COX回归分析,显示足细胞裂孔膜分布密度(HR=0.029,P<0.001)和肾小球体积(HR=0.513,P=0.018)是MAU进展的独立影响因素;糖尿病病程(HR=0.925,P=0.012)、血尿酸(HR=1.012,P=0.034)、总胆固醇(HR=4.235,P=0.021)、ACEI/ARB使用(HR=311.451,P=0.006)是MAU转阴/缓解的独立影响因素。多因素Logistic回归分析显示,基线eGFR(HR=0.853,P=0.010)、血尿酸(HR=1.019,P=0.016)是eGFR下降的独立危险因素。 结论:临床表现MAU的2型DN患者基线临床病理指标能够预测MAU进展与缓解,基线eGFR和血尿酸能够预测eGFR下降。
糖尿病肾病 微量白蛋白尿 肾组织病理 肾小球滤过率 危险因素
糖尿病肾病(DN)是2型糖尿病的严重并发症,也是导致终末期肾病的主要病因[1,2]。尿白蛋白排泄增加是DN的早期临床表现,尿白蛋白增加不仅与肾小球滤过率(GFR)快速下降密切相关,而且是DN患者心血管并发症的重要风险因素[3]。
长期以来,DN被认为是一种不可逆的进展性疾病,尿微量白蛋白(MAU)逐渐进展至显性蛋白尿,进而出现肾功能不全。然而,近年研究发现21%~64%DN患者MAU可逆转为正常白蛋白尿[4]。de Boer等[5]对DCCT/EDIT研究数据统计发现,1型糖尿病患者10年进展至显性蛋白尿和逆转为正常白蛋白尿的累计发生率分别为28%和40%。Araki等[6]同样发现2型DN患者逆转为正常白蛋白尿的6年累计发生率为51%,而进展至显性蛋白尿的发生率仅为28%。因此,这些研究提示临床表现为MAU的2型DN患者逆转为正常白蛋白尿的发生率较进展至显性蛋白尿的发生率高。
尿白蛋白缓解对于延缓肾脏疾病进展和降低心血管事件发生具有重要临床意义。Gaede等[7]随访观察151例表现为MAU的2型DN患者,发现逆转为正常白蛋白尿组eGFR下降速率显著低于尿白蛋白进展组和稳定组。Araki等[8]同样发现尿白蛋白缓解能够显著降低2型糖尿病患者ESRD和心血管事件的发生风险。这些研究同时发现积极的血糖控制、血压控制、血脂控制及ACEI/ARB干预等是DN患者MAU逆转为正常白蛋白尿的独立影响因素。
肾活检病理指标较临床指标能更客观真实的反映DN患者肾脏损伤的程度,然而,由于2型DN的临床特点及肾活检风险等因素,目前尚缺乏关于糖尿病患者肾组织损伤与MAU进展与缓解的相关性研究。本研究旨在观察2型DN患者MAU进展和缓解的临床与病理影响因素,并分析其对GFR下降的影响。
对象与方法
病例选择 回顾性筛选 2004年3月至2013年12月南京军区南京总医院肾脏科2型DN患者61例,纳入标准包括:尿白蛋白定量30~300 mg/24h,血清肌酐(SCr)≤109.62 μmol/L,愿意接受肾活检病理检查的糖尿病患者。并满足以下入组条件:年龄 20~70岁,无肉眼血尿,可伴或不伴高血压、血脂代谢异常,对本研究知情同意;排除标准:1型糖尿病、合并心脏、肝胆、甲状腺疾病及肾功能不全(SCr>109.62 μmol/L)、肾活检证实合并其他肾小球肾炎。
临床资料及实验室检查 (1)记录患者基线年龄(肾活检时年龄)、性别、糖尿病病程、是否伴有高血压等一般情况;(2)基线及每个随访点测血压;(3)24h尿白蛋白定量采用免疫比浊法。(4)血清白蛋白、尿素氮、SCr、尿酸、总胆固醇、三酰甘油、空腹血糖、糖化血红蛋白(HbA1c)。eGFR采用EPI公式计算[9]。(5)糖尿病并发症筛查:眼底视网膜病变筛查,心电图,并记录有无手足麻木、感觉异常等外周神经病变表现。
肾活检病理学检查 所有患者均在B超引导下行经皮肾穿刺活检术,肾组织标本行常规光镜、免疫荧光及电镜检查。光镜组织经石蜡包埋,切片厚度1.5 μm,行常规HE、PAS、PASM-Masson及Masson三色染色;肾组织免疫荧光采用直接法,冰冻切片厚度4 μm,行IgG、IgA、IgM、C3、C1q和Fibrin染色。PAS染色下分别评价肾小球、肾小管间质及肾小血管病变程度:(1)计算肾小球硬化比例、测量正切肾小球直径并计算体积、肾小球系膜区占肾小球总面积的百分比[10];(2)间质纤维化与肾小管萎缩(IFTA)程度(0分:无IFTA;1分:病变范围<25%;2分:病变范围25%~50%;3分:病变范围>50%)[11,12]。电子显微镜下观察肾小球超微结构:(1)肾小球基膜厚度;(2)足突宽度;(3)裂孔膜分布密度。
随访与临床观察终点 MAU转阴定义为6个月内至少2次尿白蛋白定量<30 mg/24h,并持续至随访终点;MAU进展定义为6个月内至少2次尿白蛋白定量>300 mg/24h,或出现显性蛋白尿(尿蛋白定量>0.5 g/24h);随访中尿白蛋白波动于30~300 mg/24h者定义为MAU稳定,其中尿白蛋白下降≥50%者定义为MAU缓解。eGFR快速下降定义:随访中eGFR平均每年下降≥3.3%[13]。随访中需记录患者ACEI/ARB的用药情况,至少每6个月随访1次,随访至2014年11月,随访时间<12个月者定义为失访。
统计学分析 采用SPSS 18.0统计软件进行统计分析。计量资料以均数±标准差或中位数(范围)表示,分类变量以百分率表示。正态分布数据,组间比较使用t检验,多组间计量资料的比较采用单因素方差分析(One-Way ANOVA),非正态分布数据采用非参数检验;率的比较采用Fisher精确卡方检验。MAU进展、MAU转阴/缓解的相关危险因素分析采用COX回归分析。每位受试者eGFR变化斜率(eGFR slope)采用简单线性回归方程计算,每年eGFR下降百分率采用公式[(10eGFR slope)-1]×100%计算[13]。eGFR下降风险因素分析采用Logistic回归分析。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
基线临床病理特点 符合入组条件患者共61例,接受肾活检时的平均年龄(46.74±8.43)岁,男性41例(67.21%),中位糖尿病病程24月(0.25~240月),患者临床及病理特点见表1。
MAU进展与缓解/转阴的影响因素分析 随访中失访7例(11.48%),54例纳入统计分析,中位随访时间为54月(12~120月),随访患者中接受ACEI治疗11例, ARB治疗22例,ACEI联合ARB治疗4例,未接受ACEI或ARB治疗17例。
MAU转阴组、稳定组和进展组患者基线临床和病理指标的差异见表2、图1、2。

表1 2型DN微量白蛋白尿患者肾活检时基线临床特点
DN:糖尿病肾病;ACEI:血管紧张素转换酶抑制剂;ARB:血管紧张素Ⅱ受体拮抗剂
COX回归分析影响MAU进展的相关风险因素,单因素COX回归分析显示舒张压(HR=0.947,P=0.037)、尿白蛋白定量(HR=1.005,P=0.043)、视网膜病变(HR=2.752,P=0.026)是影响MAU进展的临床危险因素,肾小球体积(HR=0.590,P=0.007)、足细胞裂孔膜分布密度(HR=0.038,P<0.001)、足突宽度(HR=1.061,P=0.017)是影响MAU进展的病理危险因素;将单因素COX回归分析中P<0.10的临床和病理指标代入多因素COX回归分析,显示足细胞裂孔膜分布密度(HR=0.029,P<0.001)和肾小球体积(HR=0.513,P=0.018)是MAU进展的独立危险因素。
由于MAU转阴组仅7例患者,不适合行COX回归分析其临床病理影响因素,因此,将MAU稳定组中8例MAU下降≥50%的患者与MAU转阴组合并,定义为MAU转阴/缓解组,进行单因素COX回归分析显示总胆固醇、BMI、ACEI/ARB使用是MAU转阴/缓解的临床影响因素,足细胞裂孔膜分布密度是MAU转阴/缓解的病理影响因素;将单因素COX回归分析中P<0.10的临床和病理指标代入多因素COX回归分析显示,DM病程、血尿酸、总胆固醇、ACEI/ARB使用是MAU转阴/缓解的独立影响因素(表3)。
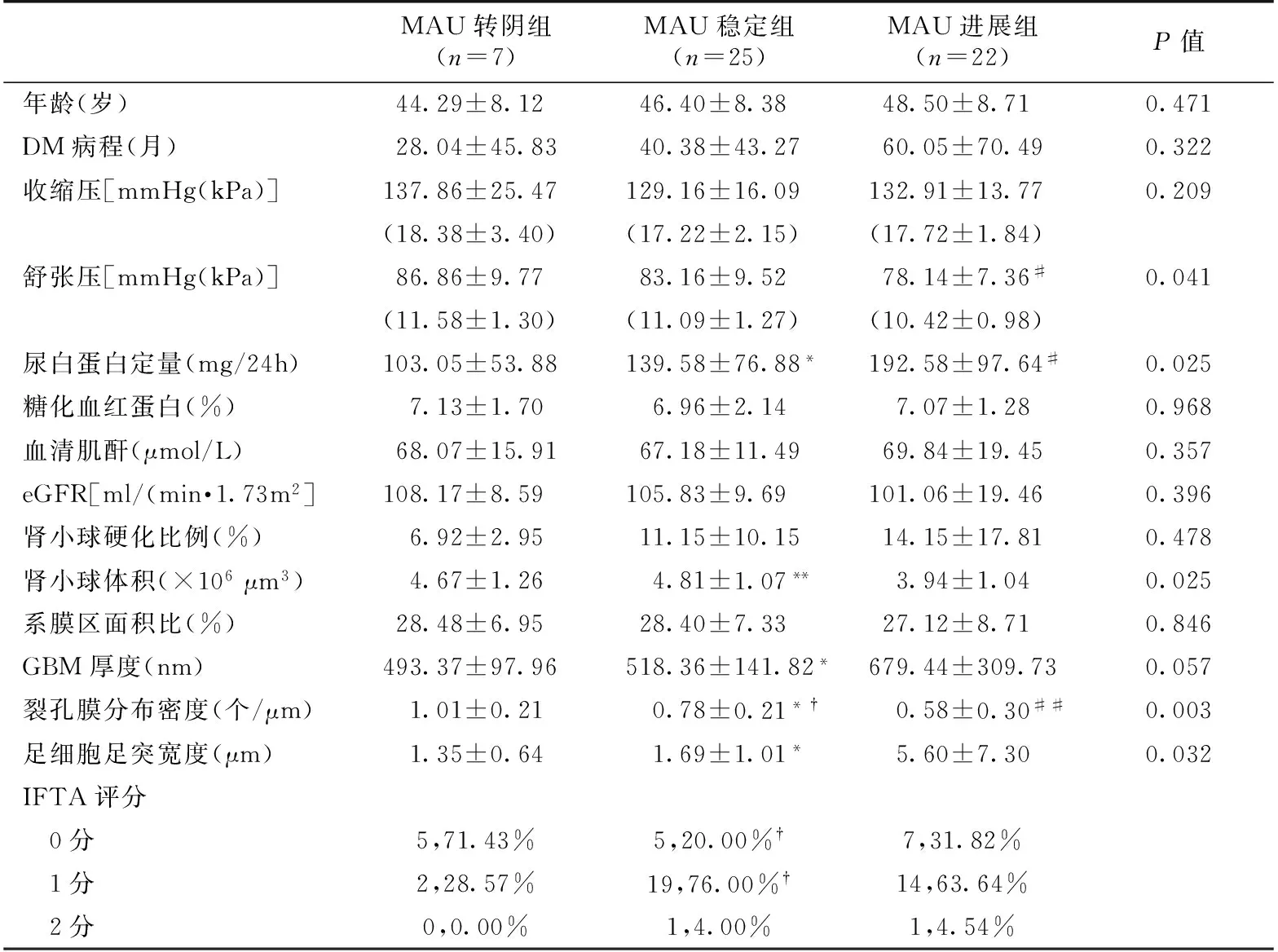
表2 MAU转阴组、稳定组、进展组患者基线临床和病理特点比较
MAU:尿微量白蛋白;eGFR:估算的肾小球滤过率;GBM:肾小球基膜;IFTA:肾间质纤维化与肾小管萎缩;*:稳定组vs进展组,P<0.05,**:稳定组vs进展组,P<0.01;†:稳定组vs缓解组,P<0.05 ,††:稳定组vs缓解组,P<0.01;#:进展组vs缓解组,P<0.05 ,##:进展组vs缓解组,P<0.01

图1 MAU转阴组、稳定组和进展组基线尿白蛋白定量及足细胞裂孔膜分布密度比较MAU:尿微量白蛋白
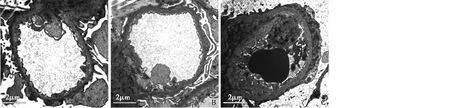
图2 MAU转阴组、稳定组和进展组肾小球超微结构比较(EM)MAU:尿微量白蛋白;A:MAU转阴组,足细胞足突基本正常;B:MAU稳定组,足细胞足突节段融合;C:MAU进展组,足细胞足突广泛融合

表3 影响尿微量白蛋白转阴/缓解的临床和病理风险因素的COX回归分析
ACEI:血管紧张素转换酶抑制剂;ARB:血管紧张素Ⅱ受体拮抗剂
影响eGFR下降的危险因素分析 54例随访患者中eGFR下降≥3.3%/年者24例(44.44%),eGFR下降<3.3%/年者30例(55.56%)。MAU稳定组、进展组和缓解组eGFR平均下降百分率分别为-5.30%、-7.39%和-2.67%,但无统计学差异。采用Logistic回归分析影响eGFR下降的危险因素,单因素Logistic回归分析结果显示,基线eGFR(HR=0.933,P=0.018)、血尿酸(HR=1.013,P=0.020)、肾小球硬化比例(HR=1.059、P=0.042)与eGFR下降相关,将单因素Logistic回归分析中P<0.10的临床和病理指标代入多因素分析显示,基线eGFR(HR=0.853,P=0.010)、血尿酸(HR=1.019,P=0.016)是eGFR下降的独立危险因素。
讨 论
随着2型糖尿病患病率显著升高,在美国及发达国家中,DN仍是导致ESRD的最主要病因,在我国DN占ESRD的比例约为16.4%[1]。MAU作为DN早期损伤的生物标志物,越来越多的研究证实1型和2型糖尿病患者MAU逆转为正常白蛋白尿的累计发生率高于MAU进展至显性蛋白尿的发生率[14,15]。而本研究观察发现,MAU逆转为正常白蛋白尿的发生率为12.96%,MAU缓解/转阴发生率为27.78%, 低于此前报道。其原因可能为(1)样本量小,可能存在抽样偏差;(2)观察时间相对短,中位随访时间54个月;(3)MAU转阴的定义有所区别,此前研究观察随访中MAU转阴的累计发生率,而本研究中MAU转阴定义为随访中6个月内至少2次尿白蛋白<30 mg/24h,并持续至随访终点,因此,可能低估了MAU转阴的发生率。
MAU与糖尿病患者心血管事件的死亡率密切相关[16-18],通过多因素干预使得MAU缓解/转阴,能够降低糖尿病患者心血管事件的发生率。良好的血糖控制(HbA1c<6.5%)[6,17]、血压控制[<130/80 mmHg(13.33/10.67 kPa)][19]是MAU缓解及延缓肾功能进展的独立危险因素。相反,血糖、血压控制不佳、基线尿白蛋白水平及吸烟是MAU进展的独立危险因素[20,21]。关于临床表现为MAU的2型DN患者肾组织病理损伤的研究发现,这些患者主要表现为肾小球体积增大,系膜增生及足细胞足细胞裂孔膜分布密度下降、足突增宽等[10,22],由于2型DN的临床特点及肾活检风险等因素,目前尚缺乏关于MAU糖尿病患者肾组织损伤与尿白蛋白进展与缓解的相关性研究。本研究分析了影响MAU进展与缓解的临床病理危险因素发现,足细胞裂孔膜分布密度和肾小球体积是影响MAU进展的独立风险因素,而DM病程、血尿酸、总胆固醇及ACEI/ARB使用是MAU转阴/缓解的独立影响因素。由于本研究为单中心探索性研究,入组患者需接受肾活检,因此样本量较小,可能会影响多因素COX回归分析的结果,我们并未得出血糖控制、血压控制影响MAU进展与缓解的结论,HbA1c<6.5%与≥6.5%的患者尿白蛋白进展与缓解的发生率无统计学差异。
DN早期表现为高灌注、高压力、高滤过,随之出现肾小球体积增大,与此前认识不同,本研究发现肾小球体积越大,MAU进展的发生风险越低(HR 0.513),提示肾小球体积增大可能为生理性改变,并未出现器质性病理损伤,因此,这种高灌注状态可通过积极治疗(如ACEI/ARB)得以逆转。既往研究证实,临床表现MAU的2型DN患者,已出现肾小球足细胞损伤,表现为足细胞相关分子表达下调,足突融合等[10,22]。本研究发现足细胞裂孔膜分布密度是MAU进展的独立风险因素(HR=0.029),提示足细胞损伤程度可以预测MAU进展至显性蛋白尿。
既往研究已经证实通过ACEI/ARB阻断肾素-血管紧张素系统能够延缓2型DN进展,减少尿白蛋白。本研究中67.21%的患者接受了ACEI和(或)ARB治疗,结果显示ACEI/ARB是MAU缓解/转阴的独立危险因素。
本研究随访中仅1例患者进展至ESRD,无法采用ESRD作为随访终点评价影响肾功能进展的危险因素。因此,为了评价该组DN患者肾功能下降的危险因素,我们采用平均年eGFR下降≥3.3%作为eGFR快速下降的标准[13],发现基线eGFR和血尿酸是eGFR快速下降的独立风险因素。近年研究显示,血尿酸在DN发生和发展中发挥重要作用[23],Hovind等[24]通过1型糖尿病队列研究发现,血清尿酸浓度是进展至持续蛋白尿的危险因素。 Bjornstad等[25]观察652例1型糖尿病患者,同样以eGFR下降≥3.3%/年作为GFR快速下降标准,发现血尿酸浓度是出现尿白蛋白进展和eGFR快速下降的独立危险因素。本研究还发现,eGFR下降百分比与基线时糖尿病病程、高血压病程、肾小球硬化比例及基线eGFR水平相关。随着DM病程和高血压病程的延长,肾小球及肾小血管病变加重,肾小球滤过功能下降,这些因素可能是造成eGFR快速下降的原因之一。
本研究首次随访观察了中国人群中2型DN患者MAU进展和转阴/缓解的临床与病理影响因素,并分析其对GFR下降的影响。由于本研究为单中心回顾性观察研究,仍存在诸多不足:(1)研究要求纳入患者接受肾活检,致使本研究样本量较少;(2)随访时间相对短,仅1例患者进展至ESRD,无法采用ESRD作为观察终点事件,因此,采用MAU进展与转阴/缓解和eGFR快速下降作为替代终点事件;(3)入组患者并未全部接受ACEI/ARB治疗,未限制降脂药物使用,因此,在影响因素分析中可能会低估治疗方案对MAU进展和eGFR下降的影响。
综上所述,本研究以临床表现为MAU的接受肾活检病理检查的2型DN患者为观察对象,发现足细胞裂孔膜分布密度和肾小球体积是MAU进展的独立危险因素,而糖尿病病程、血尿酸、总胆固醇及ACEI/ARB使用是MAU转阴/缓解的独立影响因素;基线eGFR和血尿酸是eGFR下降的独立危险因素。本研究为临床上预测2型DN患者MAU进展和eGFR下降提供了依据。由于样本量小,本研究的结论尚需扩大样本进行证实。
1 Liu ZH.Nephrology in china.Nat Rev Nephrol,2013,9(9):523-528.
2 de Boer IH,Rue TC,Hall YN,et al.Temporal trends in the prevalence of diabetic kidney disease in the United States.JAMA,2011,305(24):2532-2539.
3 Gerstein HC,Mann JF,Yi Q,et al.Albuminuria and risk of cardiovascular events,death,and heart failure in diabetic and nondiabetic individuals.JAMA,2001,286(4):421-426.
4 MacIsaac RJ,Ekinci EI,Jerums G.′Progressive diabetic nephropathy.How useful is microalbuminuria?:contra′.Kidney Int,2014,86(1):50-57.
5 de Boer IH,Rue TC,Cleary PA,et al.Long-term renal outcomes of patients with type 1 diabetes mellitus and microalbuminuria:an analysis of the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications cohort.Arch Intern Med,2011,171(5):412-420.
6 Araki S,Haneda M,Sugimoto T,et al.Factors associated with frequent remission of microalbuminuria in patients with type 2 diabetes.Diabetes,2005,54(10):2983-2987.
7 Gaede P,Tarnow L,Vedel P,et al.Remission to normoalbuminuria during multifactorial treatment preserves kidney function in patients with type 2 diabetes and microalbuminuria.Nephrol Dial Transplant,2004,19(11):2784-2788.
8 Araki S,Haneda M,Koya D,et al.Reduction in microalbuminuria as an integrated indicator for renal and cardiovascular risk reduction in patients with type 2 diabetes.Diabetes,2007,56(6):1727-1730.
9 Levey AS,Stevens LA.Estimating GFR using the CKD Epidemiology Collaboration (CKD-EPI) creatinine equation:more accurate GFR estimates,lower CKD prevalence estimates,and better risk predictions.Am J Kidney Dis,2010,55(4):622-627.
10 Weil EJ,Lemley KV,Mason CC,et al.Podocyte detachment and reduced glomerular capillary endothelial fenestration promote kidney disease in type 2 diabetic nephropathy.Kidney Int,2012,82(9):1010-1017.
11 Tervaert TW,Mooyaart AL,Amann K,et al.Pathologic classification of diabetic nephropathy.J Am Soc Nephrol,2010,21(4):556-563.
12 An Y,Xu F,Le W,et al.Renal histologic changes and the outcome in patients with diabetic nephropathy.Nephrol Dial Transplant,2015,30(2):257-266.
13 Pavkov ME,Knowler WC,Lemley KV,et al.Early renal function decline in type 2 diabetes.Clin J Am Soc Nephrol,2012,7(1):78-84.
14 Perkins BA,Ficociello LH,Silva KH,et al.Regression of microalbuminuria in type 1 diabetes.N Engl J Med,2003,348(23):2285-2293.
15 Giorgino F,Laviola L,Cavallo Perin P,et al.Factors associated with progression to macroalbuminuria in microalbuminuric Type 1 diabetic patients:the EURODIAB Prospective Complications Study.Diabetologia,2004,47(6):1020-1028.
16 Gaede PH.Intensified multifactorial intervention in patients with type 2 diabetes and microalbuminuria:rationale and effect on late-diabetic complications.Dan Med Bull,2006,53(3):258-284.
17 Gaede P,Vedel P,Parving HH,et al.Intensified multifactorial intervention in patients with type 2 diabetes mellitus and microalbuminuria:the Steno type 2 randomised study.Lancet,1999,353 (9153):617-622.
18 Gaede P,Vedel P,Larsen N,et al.Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes.N Engl J Med,2003,348(5):383-393.
19 Remuzzi G,Schieppati A,Ruggenenti P.Clinical practice.Nephropathy in patients with type 2 diabetes.N Engl J Med,2002,346(15):1145-1151.
20 Katayama S,Moriya T,Tanaka S,et al.Low transition rate from normo- and low microalbuminuria to proteinuria in Japanese type 2 diabetic individuals:the Japan Diabetes Complications Study (JDCS).Diabetologia,2011,54(5):1025-1031.
21 Araki S,Nishio Y,Araki A,et al.Factors associated with progression of diabetic nephropathy in Japanese elderly patients with type 2 diabetes:sub-analysis of the Japanese Elderly Diabetes Intervention Trial.Geriatr Gerontol Int,2012,12(Suppl 1):127-133.
22 Su J,Li SJ,Chen ZH,et al.Evaluation of podocyte lesion in patients with diabetic nephropathy:Wilms’ tumor-1 protein used as a podocyte marker.Diabetes Res Clin Pract,2010,87(2):167-175.
23 Hovind P,Rossing P,Johnson RJ,et al.Serum uric acid as a new player in the development of diabetic nephropathy.J Ren Nutr,2011,21(1):124-127.
24 Hovind P,Rossing P,Tarnow L,et al.Serum uric acid as a predictor for development of diabetic nephropathy in type 1 diabetes:an inception cohort study.Diabetes,2009,58(7):1668-1671.
25 Bjornstad P,Maahs DM,Rivard CJ,et al.Serum uric acid predicts vascular complications in adults with type 1 diabetes:the coronary artery calcification in type 1 diabetes study.Acta Diabetol,2014,51(5):783-791.
(本文编辑 律 舟 莫 非 凡 心)
Renal histological injury and the disease progression in diabetic nephropathy patients with microalbuminuria
GEYongchun,XIEHonglang,XUFeng,WANGLing,ZHONGYongzhong,ANYu,ZENGCaihong,LIUZhihong
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
LIUZhihong(E-mail:liuzhihong@nju.edu.cn)
Objective:To investigate the clinical and histological risk factors and to predict the progression to macroalbuminuria, remission to normoalbuminuira and eGFR decline in type 2 diabetic patients with microalbuminuria. Methodology:Sixty one type 2 diabetic patients with MAU (urinary albumin excretion 30~300 mg/24h) and serum creatinine ≤1.24 mg/dl who
renal biopsy were enrolled in this study.The clinical data such as baseline age, duration of diabetes mellitus, blood pressure, smoking history, ACEI/ARB prescription, serum creatinine, eGFR, serum lipid, HbA1c, urinary albumin, NAG and RBP were recorded.The histological data including the percentage of global sclerosis, glomerular volume, mesangial area ratio, glomerular basement membrane width, podocyte foot process width, slit diaphragm frequency were also measured.eGFR rapid decline was defined as a rate of eGFR loss of ≥3.3% per year. Results:54 patients were included for analyzing, and 7 patients were lost during follow-ups.40.7% (22/54) patients progressed to macroalbuminuria, 46.3% (25/54) were stable and 13.0% (7/54) were remission to normoalbuminuria.The urinary albumin at baseline was lower in remission group than that in progression and stable groups(103.05±53.88vs139.58±76.88vs192.58±97.64 mg/24h,P=0.025), and the SD frequence was higher in remission group than that in other two groups.Multivariate COX regression analysis indicated that SD frequence and glomrular volume were independent predictors of progression to macroalbuminuria, and DM duration, serum uric acid, cholesterol and ACEI/ARB prescription were independent infect factors of remission to normoalbuminuria.Multivariate Logistic regression analysis indicated that lower baseline eGFR and higher serum uric acid concentration were the independent predictors of eGFR decline in this cohort. Conclusion:Multiple clinical and histological indices can predict the progression and remission of MAU in type 2 diabetic nephropathy, and baseline eGFR and serum uric acid concentration can predict the decline of eGFR.
diabetic nephropathy microalbuminuria renal histological injury GFR risk factors
国家科技支撑计划课题(2013BAI09B04,2015BAI12B05);江苏省临床医学中心项目(BL2012007)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 博士研究生(葛永纯),国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
刘志红(E-mail:liuzhihong@nju.edu.cn)
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有
2015-03-07

