腹膜透析患者血清可溶性Klotho蛋白与腹主动脉钙化关联性的研究
贾瑞丽 吴晓磊 傅淑霞 田 莉 谭会斌
腹膜透析患者血清可溶性Klotho蛋白与腹主动脉钙化关联性的研究
贾瑞丽 吴晓磊 傅淑霞 田 莉 谭会斌
目的:了解腹膜透析(PD)患者腹主动脉钙化情况,并分析该人群血清可溶性Klotho蛋白(sKL)水平与腹主动脉钙化的关联性。 方法:选取持续不卧床腹膜透析(CAPD)>3个月的患者80例,收集其临床资料,应用侧位腹平片评价腹主动脉钙化情况,并计算腹主动脉钙化积分(AAC),采用ELISA法检测血清sKL及成纤维细胞生长因子23(FGF23)浓度。Logistic回归分析法分析PD患者发生腹主动脉钙化的危险因素,受试者工作特征曲线(ROC)评价sKL预测腹主动脉钙化的准确性与特异性。 结果:80例PD患者中,发生腹主动脉钙化患者41例(51.3%),钙化主要发生在第4腰椎节段,并随着节段的上升逐渐减少。血清sKL与AAC负相关,与FGF23无相关性。Logistic回归分析结果显示血清sKL浓度较低( OR=0.969,95%CI 0.947~0.991,P<0.01)和高龄(OR=1.115,95%CI 1.044~1.191,P<0.01)是PD患者发生腹主动脉中、重度钙化的独立危险因素。ROC曲线下面积(AUC)显示sKL预测腹主动脉中、重度钙化的AUC为0.800(截点为361.50 pg/mL,其准确性为71.4%,特异性为84.6%)。 结论:PD患者血清sKL浓度降低与发生腹主动脉钙化显著相关,血清sKL浓度可能在腹主动脉钙化机制中起重要作用。
腹膜透析 腹主动脉钙化 钙质沉着症 可溶性klotho
血管钙化是终末期肾病(ESRD)患者的常见并发症,而血管钙化与心血管疾病(CVD)高发病率及高死亡率密切相关[1]。Klotho基因是一种抗衰老基因,其编码的蛋白即Klotho蛋白,是单向跨膜蛋白,具有多种生物学效应,包括膜型和分泌型两种,其中膜型Klotho蛋白是成纤维细胞生长因子23(FGF23)的一个共受体,在肾远曲小管起作用,参与钙磷代谢调节等[2,3]。膜型Klotho蛋白的细胞外结构域上脱落下来的部分被称为可溶性Klotho(sKL)[4]。FGF23是近年新发现的一种调磷因子,它主要参与血磷代谢,是磷、维生素D代谢的重要调节激素[5]。Klotho蛋白是FGF23 发挥作用所必需的信号分子,是FGF23信号转导通路的关键因子[3]。既往已有相关研究探讨sKL与腹主动脉钙化的关系,但结论尚不一致。因此,本研究以腹膜透析(PD)患者为研究对象,分析影响血清sKL的相关因素,观察其与腹主动脉钙化的关系,为进一步探讨sKL在腹主动脉钙化发病中的作用及治疗方面提供帮助。
对象和方法
研究对象 选取2014年1月到2014年6月在河北医科大学第二医院肾内科行持续不卧床腹膜透析(CAPD)>3个月的患者。排除标准:(1)有精神疾患或行动无法配合者;(2)近1个月内感染或使用抗生素;(3)近1个月内使用激素或免疫抑制剂;(4)近1个月内有过手术或外伤史;(5)其他严重疾病,如恶性肿瘤、严重吸收不良、动脉瘤等。选取体检中心健康体检者55例为正常对照组。本研究经本院伦理委员会批准。所有患者均签署知情同意书。
收集患者一般资料,包括性别、年龄、吸烟史、活性维生素D及磷结合剂用药史,原发疾病、伴随疾病(高血压、糖尿病、CVD)等情况。记录患者的血压、透析龄、尿素清除指数(Kt/V)、残余肾功能(RRF)、尿量及身高和干体质量,计算体质量指数(BMI)值。所有患者均应用1.5%~4.25%低钙葡萄糖透析液每次2L,每日6~8L,透析液为广州百特公司生产的PD双联系统葡萄糖透析液。
研究方法
腹部侧位X线平片 X线平片检查部位包括第11、12节胸椎,第1~5腰椎和第1、2节骶椎骨。根据Kauppila等[6]报道的半定量积分法对患者第1节至第4节腰椎对应的腹主动脉钙化情况进行评分。评分方法如下:根据腹主动脉前壁和后壁钙化斑块的长度分别给予0~3分(0分:无钙化;1分:钙化范围<1/3的动脉壁长度;2分:钙化范围累及1/3~2/3动脉壁长度;3分:钙化范围>2/3的动脉壁长度)。每例患者的腹主动脉钙化积分(AAC)为0~24分。由两位放射科医师盲法、单独进行评分,最终取其平均值。采用CORD研究的分段方法[7],依据患者AAC的得分分为无或轻度钙化组(0~4分)、中度钙化组(5~15分)和重度钙化组(≥16分)。
血生化检查 所有患者于腹部侧位平片检查后1个月内检测血红蛋白(Hb)、白蛋白(Alb)、血清肌酐(SCr)、尿素氮(BUN)、尿酸(UA)、全段甲状旁腺激素(iPTH)、血磷(P)、校正钙、钙磷乘积(Ca×P)、碱性磷酸酶(ALP)、超敏C反应蛋白(hs-CRP)、总胆固醇(CH)、三酰甘油(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、空腹血糖。
血清sKL及FGF23检测 血清sKL和FGF23均采用ELISA双抗体夹心法测定,两者试剂盒均购自上海拜沃生物科技有限公司试剂盒。试剂配置、操作步骤均严格按照说明书完成。
CVD定义[8]心电图、心肌酶谱、冠脉造影、支架术或冠脉搭桥术后所证实的心绞痛及心肌梗死;充血性心力衰竭;短暂性脑缺血发作、脑梗死或脑出血;颈动脉超声检测有斑块形成;周围血管病变。
糖尿病诊断标准[9]凡具有典型糖尿病症状(多饮、多食、多尿和不能解释的体重减轻)者,且随机血糖≥11.1 mmol/L,或空腹血糖≥7.0 mmol/L,或餐后2h血糖≥11.1 mmol/L。
高血压诊断标准[10]在未使用降压药物的情况下,非同日3次测量血压,收缩压≥140 mmHg(18.7 kPa)和(或)舒张压≥90 mmHg(12 kPa)。收缩压≥140 mmHg(18.7 kPa)和舒张压<90 mmHg(12 kPa)为单纯性收缩期高血压。患者既往有高血压史,目前正在使用降压药物,血压虽然低于140/90 mmHg(18.7/12 kPa),也诊断为高血压。
残余肾功能(RRF)的计算方法[11]RRF=(肾尿素清除率+肾肌酐清除率)/2;肾尿素清除率(ml/min)=[尿尿素(mmol/L)/BUN(mmol/L)]×24h尿量(ml)/1 440;肾肌酐清除率(ml/min)=[尿肌酐(μmol/L)/SCr(μmol/L)]×24h尿量(ml)/1 440。
统计学方法 应用SPSS 13.0进行统计分析,将PD患者按血清sKL水平分布范围的四分位数分组,比较4组患者的血管钙化情况。对所有数据进行正态性及方差齐性检验。正态数据用均数±标准差。非正态数据应用M(1/4,3/4)表示,符合正态分布、方差齐的计量资料采用独立样本t检验或方差分析,非正态计量资料用秩和检验。计数资料采用χ2检验。相关性用pearson或spearman相关性分析。Logistic回归分析患者腹主动脉钙化的危险因素,受试者工作特征曲线(ROC)评价sKL预测腹主动脉钙化的准确性与特异性。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
一般情况 80例PD患者,其中男性38例,女性42例;平均年龄(46.90±13.60)岁;健康对照组55例,男性29例,女性26例,平均年龄(40.13±8.20)岁。两组间性别、年龄无统计学差异。PD组患者血清sKL明显低于健康对照组[(381.39±48.99) pg/mlvs(478.85±58.13) pg/ml,P<0.01]。
腹主动脉钙化情况 80例PD患者中,发生腹主动脉钙化患者41例(51.3%)(图1)。其中轻度钙化20例,中度钙化15例,重度钙化6例。其中12例(29.3%)患者L1水平存在钙化,14例(34.1%)患者L2水平存在钙化,22例(53.7%)患者L3水平存在钙化,24例(58.5%)患者L4水平存在钙化,钙化主要发生在第4腰椎节段,并随着节段的上升逐渐减少。
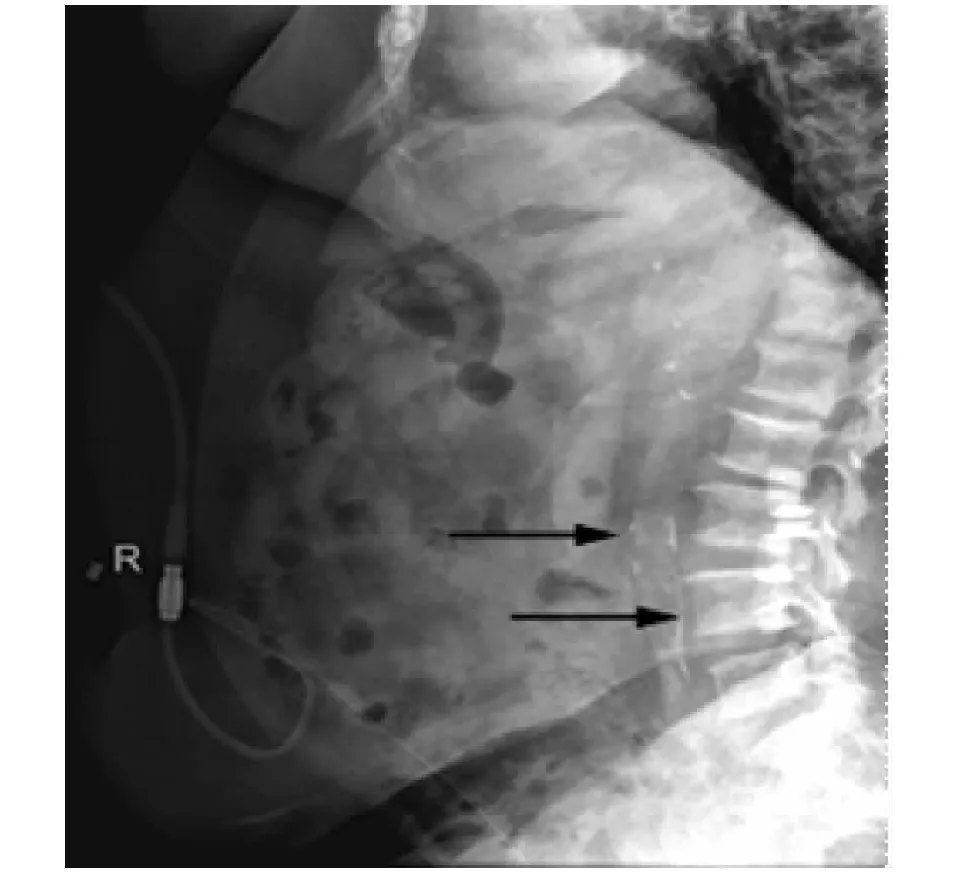
图1 腹部侧位X线平片见L3~L5腹主动脉壁明显钙化(↑)
按血清sKL水平分组后比较 组 Ⅰ:sKL≤351 pg/ml;组 Ⅱ:sKL 352~376 pg/ml;组 Ⅲ:sKL 377~415 pg/ml;组 Ⅳ:sKL≥416 pg/ml。四组患者临床资料,生化指标,透析指标,并发症,用药史及FGF23均无统计学差异。组Ⅰ、组Ⅱ患者的AAC积分高于组 Ⅳ,不同sKL浓度组间AAC积分差异有统计学意义(表1)。
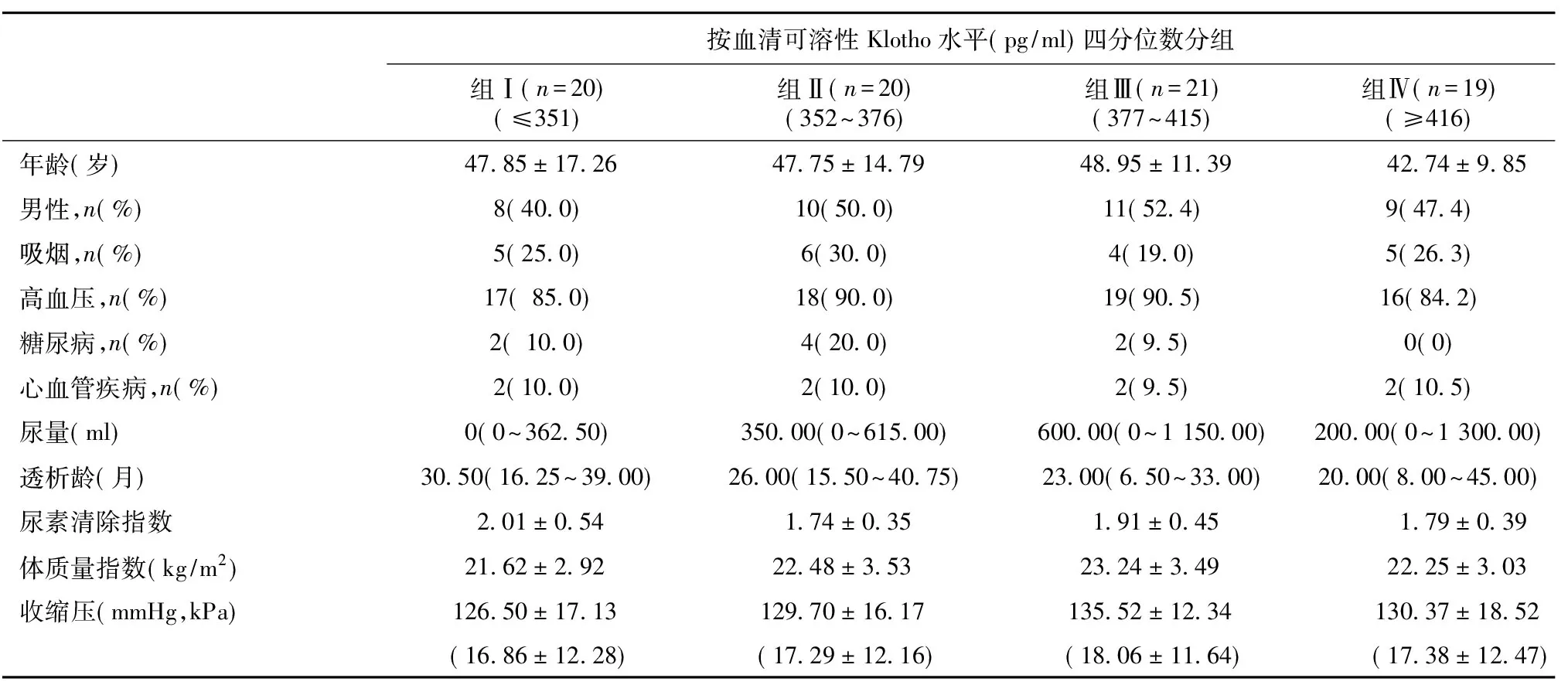
表1 80例腹膜透析患者临床资料及相关实验室检查
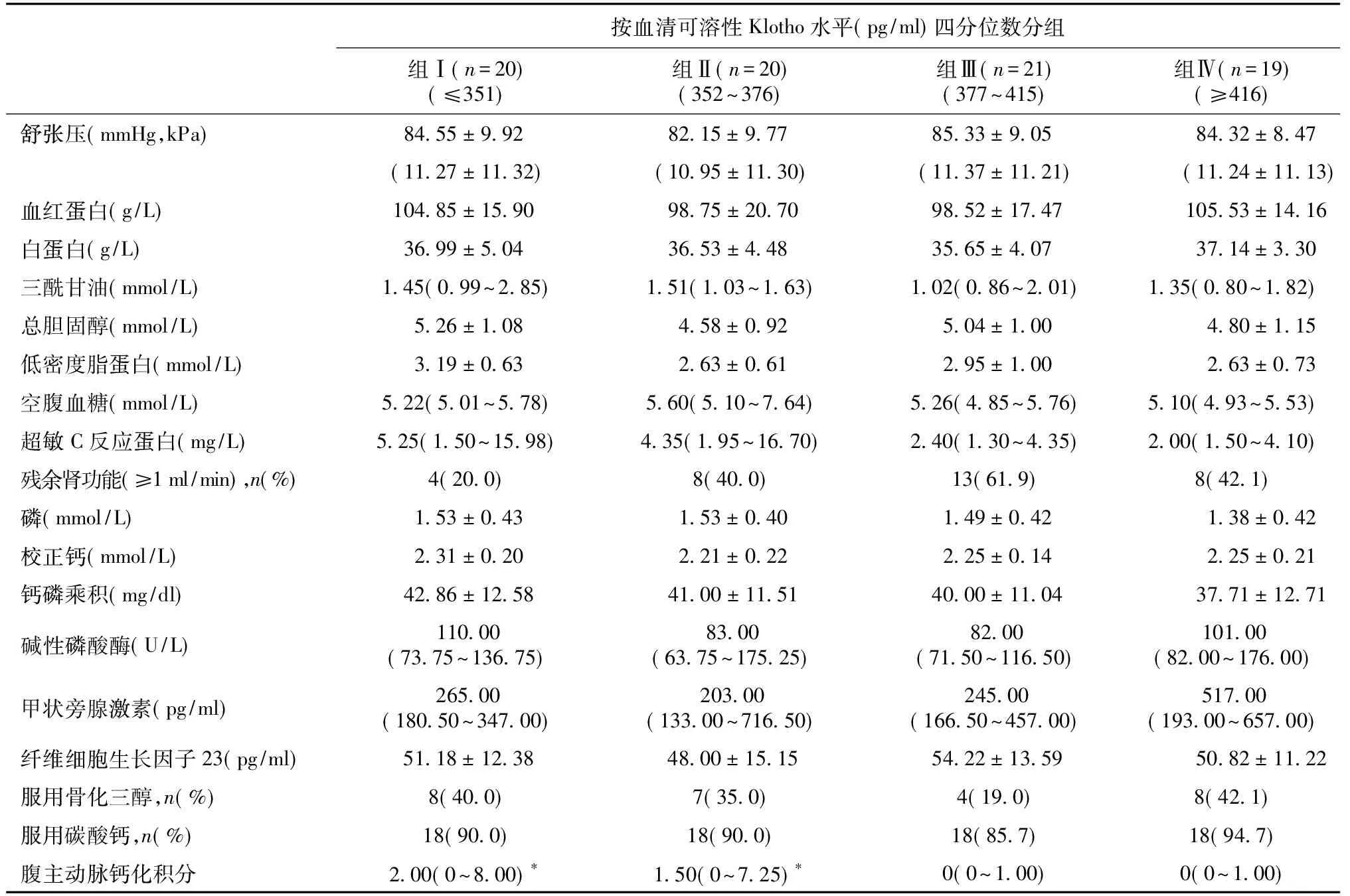
续表1
*:与组Ⅳ比较,P<0.05
血清sKL与AAC的关系 比较不同程度腹主动脉钙化组间的血清sKL水平发现,中度或重度钙化患者与轻度钙化患者相比,血清sKL更低,差异有统计学意义[(357.20±46.25) pg/ml、(319.33±48.64) pg/mlvs(382.85±44.12) pg/ml,P<0.05]。单因素直线相关分析显示sKL与AAC积分(r=-0.48,P<0.01)、空腹血糖(r=-0.22,P<0.05)、hs-CRP(r=-0.30,P<0.01)负相关,与尿量正相关(r=0.23,P<0.05),与其他因素无关。随着sKL水平的逐渐降低,高AAC评分患者的比例也显著增高,组Ⅳ患者的腹主动脉中、重度钙化的比例显著降低,而无钙化或轻度钙化患者的比例显著增加(P<0.05)(图2)。
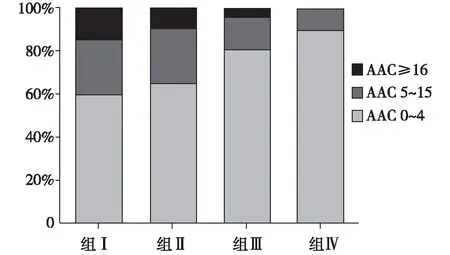
图2 四组患者不同腹主动脉钙化积分(AAC)所占比例
影响PD患者腹主动脉中重度钙化的危险因素分析 以是否存在腹主动脉中重度钙化(AAC≥5赋值为1)作为因变量。Logistic回归分析显示,校正个体一般状况和生化指标的影响后,血清sKL浓度降低( OR=0.969,95%CI 0.947~0.991,P<0.01)和年龄增加(OR=1.115,95%CI 1.044~1.191,P<0.01)是PD患者发生腹主动脉中、重度钙化的独立危险因素。(个体一般状况包括:年龄、性别、透析龄、高血压病史、糖尿病史、心血管疾病史、活性维生素D及磷结合剂用药史、RRF;生化指标包括:sKL、FGF23、Hb、Alb、Ca×P、hs-CRP)。
血清sKL预测腹主动脉中、重度钙化的准确性 血清sKL预测腹主动脉中、重度钙化的AUC为0.800(95%CI 0.678~0.922,P<0.01),提示血清sKL预测腹主动脉中、重度钙化的准确性较好。取sKL浓度 361.50 pg/ml作为截点时,其预测腹主动脉中、重度钙化的敏感度和特异度分别为71.4%和84.6%。
讨 论
CVD是ESRD患者高死亡率的重要原因之一,而血管钙化是CVD的主要危险因素之一[12]。研究显示CKD 3~5期患者,40%~60%存在主动脉和冠状动脉的钙化,而CKD 5期患者的钙化率高达80%~90%[13]。2009年,KDIGO指南建议使用侧位腹部X线片检测透析患者是否存在血管钙化作为替代CT为基础的成像检查[14]。本研究以PD患者作为研究对象,应用侧位腹部X线平片检测腹主动脉钙化情况,结果显示80例PD患者中发生腹主动脉钙化者41例(51.3%)。Honkanen等[15]报道,健康人群中腹主动脉钙化主要累及L4和L3节段;ESRD患者中主要累及L4节段,与本研究结果相符,其原因是否与腹主动脉远端开始分叉为髂总动脉,从而造成血流湍流尚不清楚。
Klotho蛋白是一种衰老因子,它是一种单向跨膜蛋白,主要为α-Klotho蛋白,具有多种生物学效应,除了参与矿物质代谢外,还具有调节离子通道的作用[16]。FGF23是一种调节人体磷酸盐平衡的重要激素,Klotho蛋白与纤维生长因子受体(FGFRs)结合形成二元复合物,FGF23与其复合物结合以调节磷酸盐代谢、1,25(OH)2及维生素D3。无Klotho参与,则FGF23不能结合并激活其同源性受体FGFRs。FGF23/Klotho轴系统在磷酸盐代谢等方面均有重要作用[17,18]。而有研究发现,Klotho蛋白可独立于FGF23调节磷酸盐代谢[16]。不同病因的CKD患者,如梗阻性肾病、移植排斥性肾病、肾小球微小病变、IgA肾病、慢性肾小球肾炎,肾脏Klotho蛋白水平明显降低[19]。本研究结果显示PD患者较对照组血清sKL低,差异有统计学意义。Klotho基因缺乏的小鼠钠-磷协同转运蛋白(Pitl和Pit2)活性增加,而高磷和尿毒症环境,平滑肌细胞也可上调Pitl/2的活性,两者共同作用可促进细胞外的磷进入细胞内,使细胞内磷浓度增加,从而促进细胞钙化[4]。动物模型表明,Klotho蛋白不仅可抑制PTH、活性维生素D的合成,还能直接作用于肾小管上皮细胞促进尿磷排泄,从而间接抑制血钙钙化[20]。蔡宏等[21]检测129例血液透析患者血清sKL,并应用腹部侧位平片计算AAC评估患者腹主动脉钙化情况,结果显示钙化率为67.4%,血清sKL浓度和腹主动脉钙化程度负相关。血清sKL测定可能有助于预测腹主动脉重度钙化。本研究显示腹主动脉钙化发生率为51.3%,血清sKL与AAC负相关。Logistic回归分析结果显示,血清sKL浓度较低和年龄较高是PD患者发生腹主动脉中、重度钙化的独立危险因素。这与上述研究基本一致,但本研究腹主动脉钙化发生率较低,部分原因可能与所有PD患者均使用的是低钙腹膜透析液有关。以上表明,即使PD患者有一些传统的导致血管钙化的危险因素(如年龄等),但患者体内sKL水平的降低依然是导致患者发生腹主动脉中、重度钙化的独立危险因素。FGF23是一种调节钙磷代谢并由骨细胞分泌的激素,是CKD钙磷代谢中的关键因子。 但也有研究表明,FGF23与动脉钙化无关[22],高水平的FGF23并不能引起血管钙化。本研究显示FGF23不是腹主动脉钙化的独立危险因素,临床需更多研究来探讨。
Golembiewska等[3]对35例尿量正常且RRF较好的PD患者进行研究,结果发现血清sKL与尿量及磷清除率负相关,与FGF23和PTH无关。国外另一些临床研究也证实血清sKL与FGF23无关[23-25]。本研究单因素直线相关分析显示sKL与FGF23无相关性,与以上研究一致,而sKL与空腹血糖、hs-CRP负相关,与尿量正相关,出现结果不同的原因可能是Golembiewska等[3]的研究对象均为RRF较好且尿量多的PD患者,临床需进一步探讨研究。
由于本研究的样本量少且未检测维生素D的水平,因此,本研究尚存在一定的局限。FGF23与Klotho结合,两者共同调节磷和维生素D的作用。PD患者中Klotho、FGF23和维生素D三者与钙磷代谢、血管钙化之间的关系有待进一步证实。本研究观察到PD患者sKL与血管钙化存在负相关,但其与PD患者发生CVD风险的相关性还需要进一步研究证实。
小结:血清sKL水平降低与PD患者腹主动脉钙化显著相关;是发生腹主动脉中、重度钙化的独立危险因素;血清sKL浓度检测可能有助于对PD患者腹主动脉中重度钙化的预测,具有广阔的研究前景。
1 Paloian NJ,Giachelli CM.A current understanding of vascular calcification in CKD.Am J Physiol Renal Physiol,2014,307(8):F891-F900.
2 Hu MC,Shi M,Zhang J, et al.Klotho deficiency is an early biomarker of renal ischemia-reperfusion injury and its replacement is protective.Kidney Int,2010,78(12):1240-1251.
3 Golembiewska E,Safranow K,Kabat-Koperska J,et al.Serum soluble Klotho protein level is associated with residual diuresis in incident peritoneal dialysis patients.Acta Biochim Pol,2013,60(2):191-194.
4 Hu MC,Kuro-o M,Moe OW.Secreted klotho and chronic kidney disease.Adv Exp Med Biol,2012,728:126-157.
5 Brandenburg VM,Kleber ME,Vervloet MG,et al.Fibroblast growth factor 23 (FGF23) and mortality:the Ludwigshafen Risk and Cardiovascular Health Study.Atherosclerosis,2014,237(1):53-59.
6 Kauppila LI,Polak JF,Cupples LA,et al.New indices to classify location,severity and progression of calcific lesions in the abdominal aorta:a 25-year follow-up study.Atherosclerosis,1997,132(2):245-250.
7 Verbeke F,Van Biesen W,Honkanen E,et al.Prognostic value of aortic stiffness and calcification for cardiovascular events and mortality in dialysis patients:outcome of the calcification outcome in renal disease (CORD) study.Clin J Am Soc Nephrol,2011,6(1):153-159.
8 Sarnak MJ,Levey AS,Schoolwerth AC,et al.Kidney disease as a risk factor for development of cardiovascular disease a statement from the American Heart Association Councils on kidney in cardiovascular disease,high blood pressure research,clinical cardiology,and epidemiology and prevention.Circulation,2003,108(17):2154-2169.
9 中国高血压防治指南修订委员会.中国高血压防治指南2010.中华心血管杂志,2011,39(7):579-616.
10 钱荣立.关于糖尿病的新诊断标准与分型.中国糖尿病杂志,2000,8(1):5-6.
11 陈香美,倪兆慧,袁伟杰,等.腹膜透析标准操作规程.北京:人民军医出版社,2011:160-161.
12 Paloian NJ,Giachelli CM.A current understanding of vascular calcification in CKD.Am J Physiol Renal Physiol,2014,307(8):F891-F900.
13 Karohl C,D’Marco Gascón L,Raggi P.Noninvasive imaging for assessment of calcification in chronic kidney disease.Nat Rev Nephrol,2011,7(10):567-577.
14 Kidney Disease:Improving Global Outcomes (KDIGO) CKD-MBD Work Group.KDIGO clinical practice guideline for the diagnosis,evaluation,prevention,and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD).Kidney Int Suppl,2009,(113):S1-130.
15 Honkanen E,Kauppila L,Wikström B,et al.Abdominal aortic calcification in dialysis patients:results of the CORD study.Nephrol Dial Transplant,2008,23(12):4009-4015.
16 Tan SJ,Smith ER,Hewitson TD,et al.The importance of klotho in phosphate metabolism and kidney disease.Nephrology (Carlton),2014,19(8):439-449.
17 Spichtig D,Zhang H,Mohebbi N,et al.Renal expression of FGF23 and peripheral resistance to elevated FGF23 in rodent models of polycystic kidney disease.Kidney Int,2014,85(6):1340-1350.
18 Sakan H,Nakatani K,Asai O,et al.Reduced renal α-klotho expression in CKD patients and its effect on renal phosphate handling and vitamin D metabolism.PloS one,2014,9(1):e86301.
19 Hu MC,Kuro-o M,Moe OW.The emerging role of Klotho in clinical nephrology.Nephrol Dial Transplant,2012,27(7):2650-2657.
20 de Oliveira RB,Okazaki H,Stinghen AE,et al.Vascular calcification in chronic kidney disease:a review.J Bras Nefrol,2013,35(2):147-161.
21 蔡宏,严玉澄,陆任华,等.血清可溶性 Klotho 水平与维持性血液透析患者腹主动脉钙化相关.中华肾脏病杂志,2013,29(2):103-107.
22 Scialla JJ,Lau WL,Reilly MP, et al.Fibroblast growth factor 23 is not associated with and does not induce arterial calcification.Kidney Int,2013,83(6):1159-1168.
23 Sugiura H,Tsuchiya K,Nitta K.Circulating levels of soluble α-Klotho in patients with chronic kidney disease.Clin Exp Nephrol,2011,15(5):795-796.
24 Yokoyama K,Imura A,Ohkido I,et al.Serum soluble α-klotho in hemodialysis patients.Clin Nephrol,2012,77(5):347-351.
25 Komaba H,Koizumi M,Tanaka H,et al.Effects of cinacalcet treatment on serum soluble Klotho levels in haemodialysis patients with secondary hyperparathyroidism.Nephrol Dial Transplant,2012,27(5):1967-1969.
(本文编辑 逸 沐)
The serum soluble Klotho protein and abdominal aortic calcification in peritoneal dialysis patients
JIARuili,WUXiaolei,FUShuxia,TIANLi,TANHuibin
RenalDivision,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,Hebei,China
TanHuibin(E-mail:tanhb@medmail.com.cn)
Objective:To investigate the clinic feature of peritoneal dialysis (PD) patients with abdominal aortic calcification, and to analyze the relationship between the levels of serum soluble Klotho protein (sKL) and abdominal aortic calcification. Methodology:Eighty patients with continuous ambulatory peritoneal dialysis(CAPD), who dialysis regularly for more than 3 months, were collected prospectively.The levels of serum sKL and Fibroblast growth factor 23 (FGF23) were detected by ELISA.Abdomen 1ateral plain was used as a criterion to determine the abdominal aorticcal cification.The abdominal aortic calcification score (AAC) was calculated.Logistic regression analysis was used to determine the risk factor of abdominal aortic calcification in PD patients.The ROC analysis was applied to evaluate the predict value of sKL in abdominal aortic calcification. Results:The abdominal aortic calcification was found in 41(51.3%)patients, which was most severe in front of the fourth lumbar segment and ameliorated in higher lumbar levels.The sKL concentration was negatively correlated with AAC, and no correlation with FGF23.Logistic regression analysis showed that lower serum sKL level(OR=0.969, 95%CI 0.947~0.991,P<0.01)and higher age(OR=1.115, 95%CI 1.044~1.191,P<0.01)were independent risk factors for moderate to severe calcification of the abdominal aorta.ROC-AUC of serum sKL for moderate to severe abdominal aortic calcification was 0.800 (cut off 361.50 pg/ml,accuracy 71.4%,specificity 84.6%). Conclusion:The lower serum sKL is significantly associated with abdominal aorta calcification.Serum sKL may play an important role in the mechanism of abdominal aortic calcification in PD patients.
peritoneal dialysis abdominal aortic calcification calcinosis soluble klotho
河北医科大学第二医院肾内科(石家庄,050000)
谭会斌(E-mail:tanhb@medmail.com.cn)
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有
2015-02-25

