维持性血液透析患者亚临床甲状腺功能异常与心脏结构的关系
何 萍 王维平 季 玲 毛慧娟
维持性血液透析患者亚临床甲状腺功能异常与心脏结构的关系
何 萍1王维平1季 玲1毛慧娟2
目的:探讨维持性血液透析(MHD)患者亚临床甲状腺功能异常和心脏结构的变化及其之间的关系。 方法:选择MHD患者100例,透析时间>3个月且病情稳定。排除临床甲状腺功能亢进或甲状腺功能减退。电化学发光仪检测甲状腺功能,包括游离三碘甲状腺原氨酸(FT3)、游离四碘甲状腺原氨酸(FT4)、促甲状腺激素(TSH),并测定同型半胱氨酸(Hcy)和C反应蛋白(CRP)。收集患者临床资料和血清生化指标。根据甲状腺功能分为亚临床甲状腺功能异常组和正常组。并应用心脏超声心动图测定患者左房内径(LAD)、左室舒张末内径(LVEDd)、左室收缩末内径(LVEDs)、左室后壁厚度(LVPWT)、室间隔厚度(IVST)、左心室质量指数(LVMI)、LVEF和相对室壁厚度(RWT)等。分析甲状腺功能和心脏结构的关系。 结果:100例MHD患者中检出甲状腺功能异常者49例(49%)。甲状腺功能异常组Hcy、CRP高于正常组(P<0.05),甲状腺功能异常组患者LAD,LVEDd,LVEDs,LVPWT,IVST,LVMI、RWT均高于甲状腺功能正常组(P<0.05),而LVEF低于正常组(P<0.01)。多因素Logistic回归分析显示FT3与左心室肥厚的发生呈负相关。 结论:MHD患者常伴甲状腺功能异常,主要表现为FT3下降。FT3下降与左心室肥厚密切相关。
终末期肾病 血液透析 甲状腺功能 C反应蛋白
慢性肾脏病(CKD)的患病率及发病率在全球范围内呈增高趋势。心血管疾病仍是终末期肾病(ESRD)患者死亡的首要原因,在ESRD患者中,多数患者伴甲状腺激素合成、分泌、代谢异常,心脏是甲状腺激素重要的靶器官之一,甲状腺激素与心血管系统疾病预后的意义重大。然而,关于ESRD患者甲状腺功能与心脏结构间关系的相关研究的报道,笔者未检索到,本研究通过探讨ESRD患者甲状腺功能异常及对心血管系统的影响,旨在提高临床工作者对它们的认识,为临床诊疗提供一定参考。
对象与方法
一般资料 选取2012年8月至2014年4月在扬州市江都人民医院肾内科住院的慢性肾衰竭维持性血液透析(MHD)患者100例,所有患者均维持透析≥3个月。排除标准:(1)有原发性甲状腺疾病,或合并严重感染、糖尿病酮症酸中毒、恶性肿瘤、心力衰竭等;(2)临床型甲状腺功能减退或亢进者;(3)服影响甲状腺功能的药物。所有患者均签署知情同意书,并经医院伦理委员会批准。
检测指标 禁食12h后于次日清晨(透析当日)抽取静脉血,检测血常规、血糖、糖化血红蛋白、尿素、肌酐、总胆固醇、三酰甘油、肝功能、同型半胱氨酸(Hcy)、C反应蛋白(CRP),计算Kt/V,并测定甲状腺功能包括促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离四碘甲状腺原氨酸(FT4)。甲状腺功能采用自动电化学发光仪检测,正常值为:FT3 3.1~6.8 pmol/L,FT4 12.0~22.0 pmol/L,TSH 0.27~4.2 mIU/L,同时予甲状腺彩超检查,排除甲状腺肿大和甲状腺结节患者。
分组方法 根据甲状腺功能检测结果,将患者分为正常组和异常组,分组标准:(1)正常组:TSH 0.27~4.2 mIU/L,FT3 3.1~6.8 pmol/L、FT4 12.0~22.0 pmol/L,(2)异常组:TSH、FT3、FT4中任一指标异常。临床甲状腺功能亢进指:TSH<0.27 mIU/L,FT3>6.8 pmol/L和(或)FT4>22.0 pmol/L。临床甲状腺功能减退:TSH>4.2 mIU/L,FT3<3.1 pmol/L和(或)FT4<12.0 pmol/L。将未达到临床甲状腺功能减退或亢进者称为亚临床甲状腺功能异常。
心脏结构和功能检测 由固定专职医师完成,检测左房内径(LAD)、左室舒张末内径(LVEDd)、左室收缩末内径(LVEDs)、室间隔厚度(IVST)、左室后壁厚度(LVWPT)、射血分数(EF)。左心室质量指数(LVMI)和相对室壁厚度(RWT)应用公式计算。Devereux公式计算左心室心肌质量(LVM),并用体表面积(BSA)计算LVMI和RWT。左心室肥厚(LVH)诊断标准:男性LVMI >115 g/m2,女性LVMI>110 g/m2。
LVMI(g/m2)=LVM/BSA。
LVM(g)=0.8×1.04×[(LVEDd+IVST+LVPWT)3-LVDd3]+0.6。
BSA(m2)=0.006 1×身高(cm)+0.012 8×体重(kg)-0.1529。
RWT=(IVST+LVPWT)/LVEDd。
统计方法 应用SPSS 17.0统计软件进行数据处理。所有数据均以均数±标准差表示,计量资料成组比较采用t检验,计数资料采用卡方检验,用非条件Logistic回归进行多因素的逐步回归分析,计算相应的比值比(OR值)及其95%可信区间(95%CI),显著性检验采用最大似然比检验方法。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
患者一般情况 男性62例,女性38例,年龄18~82岁,平均(56.8±16.2)岁。透析龄3.5~66个月,平均(33.82±16.65)月,原发病:慢性肾小球肾炎66例,糖尿病肾病10例,梗阻性肾病3例,痛风性肾病3例,多囊肾5例,不明原因13例。45例合并高血压,10例合并糖尿病。
ESRD患者亚临床甲状腺功能异常患病率 100例MHD患者中检出甲状腺功能异常者49例,甲状腺功能异常率49%,其中单纯FT3降低者31例(31%),单纯FT4降低者7例(7%),单纯TSH升高者2例(2%),FT3、FT4同时下降而TSH正常者4例(4%);5例表现为临床甲状腺功能减退,其中FT3下降而TSH升高者4例(4%),FT3、FT4下降而TSH升高者1例(1%),未见甲状腺激素水平升高的病例。排除临床甲状腺功能异常的5例患者后将44例患者作为亚临床甲状腺功能异常组(异常组),其余51例作为甲状腺功能正常者(正常组)。
MHD患者亚临床甲状腺功能异常组和正常组临床指标比较 异常组糖化血红蛋白、Hcy和CRP高于正常组(P<0.05),两组年龄、透析时间、Kt/V、平均动脉压、血红蛋白、白蛋白、钙、磷及血脂差异无统计学意义(表1)。

表1 MHD患者亚临床甲状腺功能异常组与正常组临床指标的比较
MHD:维持性血液透析;Kt/V:尿素清除指数;Hcy:同型半胱氨酸;HCL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇
两组患者心室结构及功能比较 亚临床甲状腺功能异常组患者LAD,LVEDd,LVEDs,LVPWT,IVST,LVMI、RWT均高于甲状腺功能正常组(P<0.05),亚临床甲状腺功能异常组LVEF低于正常组(P<0.05)(表2)。亚临床甲状腺功能异常组与正常组左心室肥厚发生率分别为为88.64%(39/44),51.0%(26/51),差异有统计学意义(χ2=15.5017,P=0.000 1)。LVEF<50的发生率两组分别为11.4%(5/44),5.9%(3/51),差异无统计学意义(P>0.05)。
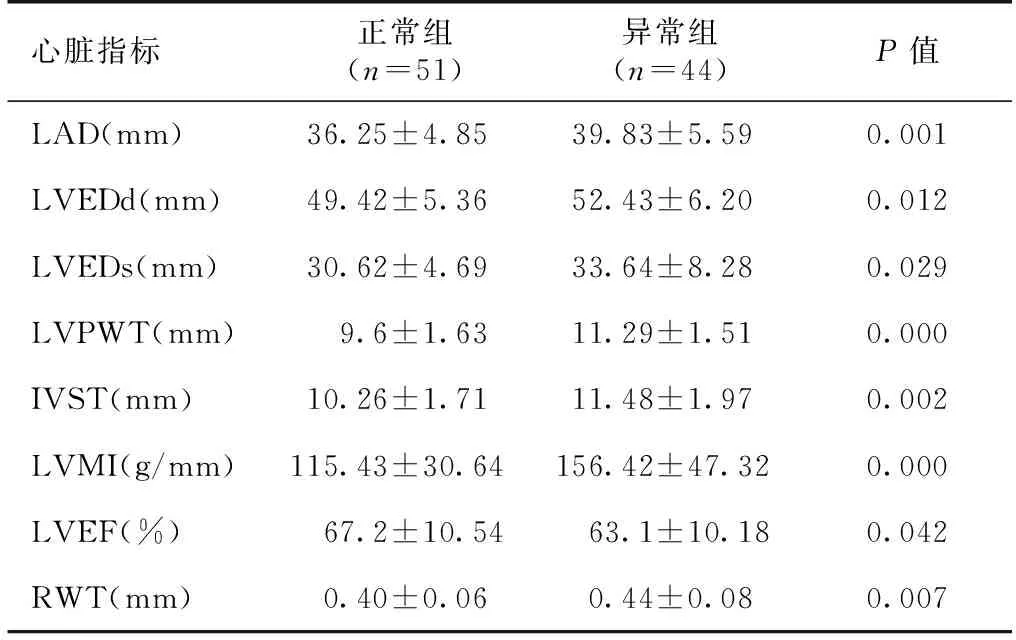
表2 MHD患者亚临床甲状腺功能异常组和正常组心脏结构和功能的比较
LAD:左房内径;LVEDd:左室舒张末内径;LVEDs:左室收缩末内径;LVPWT:左室后壁厚度;IVST:室间隔厚度;LVMI:左心室质量指数;LVEF:左室射血分数;RWT:相对室壁厚度
MHD患者左心室肥厚相关因素分析 建立回归方程,以左心室肥厚为因变量,血红蛋白、白蛋白、总胆固醇、三酰甘油、高密度脂蛋白、低密度脂蛋白、钙、磷、FT3、FT4、TSH、CRP、Hcy、平均动脉压及糖化血红蛋白为自变量进行Logistic回归分析,最终Hcy、CRP、FT3进入回归方程(表3)。回归分析显示,Hcy、CRP升高、FT3下降是左心室肥厚的危险因素; CRP与左心室肥厚发生呈正相关(P<0.05)而FT3与左心室肥厚发生呈负相关(P<0.05)。
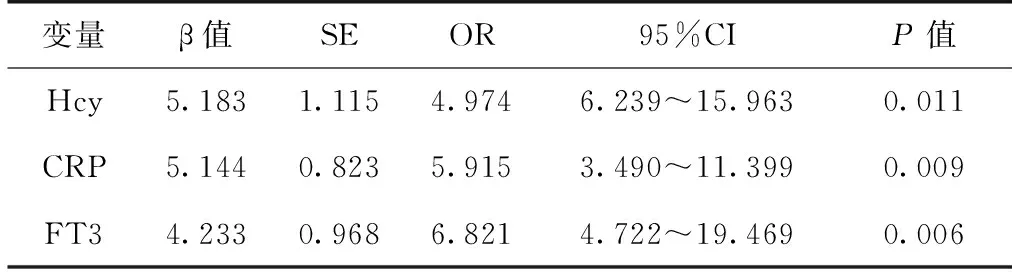
表3 左心室肥厚相关危险因素的多因素Logistic回归
Hcy:同型半胱氨酸;CRP:C反应蛋白;FT3:游离三碘甲状腺原氨酸
讨 论
CKD常伴发心血管疾病,心血管疾病已成为CKD患者死亡的重要原因之一,因此,防治心血管疾病尤为重要。导致CKD患者心血管疾病的病因中,除年龄、吸烟、高血压、糖尿病、高脂血症等传统因素外,微炎症状态、胰岛素抵抗、凝血功能异常因素均参与其中。近年来CKD与甲状腺功能异常之间关系得到进一步研究,两者发病机制和联系也备受重视。
甲状腺主要功能是分泌甲状腺激素及降钙素,而甲状腺激素在调节机体生长、发育和代谢方面具有重要作用。肾脏具有代谢、降解、排泄多种激素的作用,在甲状腺激素的代谢、排泄中发挥重要作用。国外研究结果显示,CKD患者与普通人群相比,甲状腺功能异常患病率较高[1-2]。有研究指出,在ESRD患者中,TSH与甲状腺激素异常较常见[3],仅16.8%患者甲状腺功能指标均在正常范围,非甲状腺疾病综合征(NTIS)占56.3%,低T3非常普遍(44.3%),其与6个月和12个月的死亡率相关。国内相关研究显示ESRD患者FT3、FT4下降发病率可达48.77%和1.85%[4]。亦有研究显示肾移植受者术前血清T3、T4均低于正常人水平,且T3、T4水平与移植后肾功能有相关性[5]。本研究显示,MHD患者甲状腺功能异常率为49%,与上述报道相接近。
MHD患者出现甲状腺功能异常的具体机制尚不清楚,可能与下列因素有关:(1)甲状腺激素合成异常,MHD患者由于肾小球滤过率下降,碘排除减少,可引起甲状腺激素合成抑制,另外碘潴留可损伤甲状腺细胞;(2)MHD患者体内尿毒素蓄积,抑制T4向T3的转变;(3)下丘脑-垂体-甲状腺轴受到影响,CKD患者TSH的释放反应通常是迟缓的,需很长时间才能达到基线水平[5],并可危及TSH生物活性;(4)蛋白质营养不良和分解代谢增加导致T3下降。
本研究提示,亚临床甲状腺功能异常组左心室肥厚发生率高于正常组,差异有统计学意义,而左心室肥厚是ESRD患者发生心力衰竭的重要危险因素。有学者在非糖尿病肾病及透析合并动脉硬化的患者体内发现,FT3的下降与血管内皮功能障碍粥样硬化相关[6-7],认为血清FT3可预测临床结果,且其预测能力独立于其他传统危险因素。研究发现,甲状腺机能正常的病态综合征在MHD患者中与心源性死亡相关,评价甲状腺功能可预测心血管事件,而甲状腺功能减退的MHD患者死亡率增加,进一步需要明确给予这些患者甲状腺激素替代治疗能否降低患者的死亡风险[8-9]。Ng等[10]研究表明,在MHD患者中,伴有甲状腺功能减退或亚临床甲状腺功能减退者达到目标血红蛋白水平所需的促红细胞生成素(EPO)明显超过甲状腺功能正常者。而EPO用量过大又可导致心血管不良事件发生的可能性增加。
ESRD患者甲状腺功能异常导致心血管疾病可能机制:(1)甲状腺功能异常影响血脂的合成与分解,导致心血管疾病的发生。(2)甲状腺功能异常时由于甲状腺激素缺乏引起贫血、营养不良,导致心肌耗氧量增加,导致心室重构。(3)甲状腺功能异常导致机体氧化剂清除下降,过氧化产物增加,同时TSH合成增加,激活氧化应激,参与心室重构。(4)甲状腺功能异常可通过心肌细胞和血管平滑肌细胞的基因及非基因效应导致心血管异常[11]。大型流行病调查研究显示亚临床甲状腺功能减退患者心血管事件发生率及由此造成的死亡率增加[12]。(5)甲状腺素具有促血管生成作用,促进血管内皮细胞形成突起及伪足,进一步促进血管内皮细胞的增殖、迁移,甲状腺功能异常时血管内皮损伤,血管内皮的损伤及功能障碍被认为是动脉硬化形成的起始和关键环节[13]。
本研究通过多因素Logistic回归分析表明,Hcy、CRP升高、FT3下降为左心室肥厚的危险因素,在校正其他危险因素后,FT3水平与左心室肥厚呈负相关。CRP是反映机体炎症状态的一个敏感可靠的指标,各种甲状腺功能减退时CRP升高[14,15],在ESRD中,低T3可能是炎症状态的一个未知表达方式,且在MHD患者中T3与CRP之间存在明显相关性[16]。导致CRP升高除与肾衰竭本身、透析治疗和感染性疾病有关外,血清中游离甲状腺激素和炎症细胞因子间存在一个互相影响的负反馈机制[17],细胞因子可通过多途径作用于下丘脑-垂体-甲状腺轴,影响甲状腺激素的合成、分泌、代谢和反馈,另外炎症细胞因子参与了多个脱碘酶表达的改变,抑制了T4 向T3转化。Hcy与遗传因素、生理状况和生活方式影响有关,研究表明,甲状腺功能减退时高Hcy血症与肾清除率下降、尿排泄减少有关[18],即使亚临床甲状腺功能减退者Hcy亦减少[19]。Hcy与T3呈负相关,其可能机制与Hcy代谢过程中关键酶活性改变和肾小球滤过率变化有关。研究显示,Hcy和CRP升高是引起氧化应激、动脉粥样硬化的关键因素[20]。
针对MHD患者亚临床甲状腺功能异常的可能机制及其对心脏结构和功能的影响,可采取一系列干预措施,如提高透析的充分性,予高通量透析,以减少尿毒症毒素对T4向T3转化的抑制,改善患者营养不良、炎症、动脉粥样硬化综合征,纠正CKD矿物质和骨代谢异常等,对MHD患者的甲状腺功能异常均有改善作用;对于表现为临床甲状腺功能减退患者,可予甲状腺素替代治疗。但对ESRD亚临床甲状腺功能异常的患者有无替代治疗的必要性,目前相关研究较少。有研究认为甲状腺替代治疗可减少肾功能的进一步恶化[21-22],但临床医师在治疗低T3合并TSH升高时应慎重,因为会导致负氮平衡[23]。
总之,ESRD患者甲状腺功能异常发生率较高,且甲状腺功能异常与左心室肥厚相关,ESRD患者应注意监测其甲状腺功能。本文分析了MHD患者甲状腺功能异常发生率,并进一步分析甲状腺功能与心脏结构和功能之间的关系。然而,对于ESRD亚临床甲状腺功能异常的患者有无替代治疗的必要性,这类患者甲状腺功能异常与长期心血管预后的关系及相关危险因素,均有待大样本、多中心联合随机对照和较长期随访观察进一步阐明。
1 Chonchol M,Lippi G,Salvagno G,et al.Prevalence of subclinical hypothyroidism in patients with chronic kidney disease.Clin J Am Soc Nephrol,2008,3(5):1296-1300.
2 Dousdampanis P,Trigka K,Vagenakis GA,et al.The thyroid and the kidney:a complex interplay in health and disease.Int J Artif Organs,2014,37(1):1-12.

4 王彤,涂阳科,吕文琦,等.终末期肾功能衰竭患者甲状腺功能的调查与分析.山东医药,2009,49(24):84-85.
5 刘娟,刘伟,李代红,等.甲状腺激素水平与移植肾功能关系的临床研究.中华器官移植杂志,2013,34(1):9-12.
6 Yilmaz MI,Sonmez A,Karaman M,et al.Low triiodothyronine alters flow-mediated vasodilatation in advanced nondiabetic kidney disease.Am J Nephrol,2011,33(1):25-32.
7 Tatar E,Kircelli F,Asci G,et al.Associations of triiodothyronine levels with carotid atherosclerosis and arterial stiffness in hemodialysis patients.Clin J Am Soc Nephrol,2011,6(9):2240-2246.
8 Drechsler C,Schneider A,Gutjahr-Lengsfeld L,et al.Thyroid function,cardiovascular events,and mortality in diabetic hemodialysis patients.Am J Kidney Dis,2014,63(6):988-996.
9 Rhee CM,Alexander EK,Bhan I,et al.Hypothyroidism and mortality among dialysis patients.Clin J Am Soc Nephrol,2013,8(4):593-601.
10 Ng YY,Lin HD,Wu SC,et al.Impact of thyroid dysfunction on erythropoietin dosage in hemodialysis patients.Thyroid,2013,23(5):552-561.
11 Danzi S,Klein I.Thyroid disease and the cardiovascular system.Endocrinol Metab Clin North Am,2014,43(2):517-528.
12 Yang LB,Jiang DQ,Qi WB,et a1.Subclinical hyperthyroidism and the risk of cardiovascular events and a11.cause mortality:an updated meta-analysis of cohort studies.Eur J Endoerinol,2012,167(1):75-84.
13 Valentina VN,Marijan B,Chedo D,et a1.Subclinical hypothyroidism and risk to carotid atherosclerosis.Arq Bras Endocrinol Metabol,2011,55(7):475-480.
14 Czarnywojtek A,Owecki M,Zgorzalewicz-Stachowiak M,et al.The role of serum C-reactive protein measured by high-sensitive method in thyroid disease.Arch Immunol Ther Exp (Warsz),2014,62(6):501-509.
15 Hajje G,Saliba Y,Itani T,et al.Hypothyroidism and its rapid correction alter cardiac remodeling.PLoS One,2014,9(10):e109753.
16 Zeraati AA,Layegh P,Famili Y, et al.Serum Triiodothyronine Level as an Indicator of Inflammation in Patients Undergoing Dialysis.Iran J Kidney Dis,2011,5(1),38-44.
17 Rozing MP,Westendorp RG,Maier AB,et al.Serum triiodothyronine levels and inflammatory cytokine production capacity.Age (Dordr).2012,34(1):195-201.
18 Zhou Y,Chen Y,Cao X,et al.Association between plasma homocysteine status and hypothyroidism:a meta-analysis.Int J Clin Exp Med,2014,7(11):4544-4553.
19 Vayá A,Giménez C,Sarnago A,et al.Subclinical hypothyroidism and cardiovascular risk.Clin Hemorheol Microcirc,2014,58(1):1-7.
20 Singh S,Dey Sarkar P.Serum lipids,tHcy,hs-CRP,MDA and PON-1 levels in SCH and overt hypothyroidism:effect of treatment.Acta Biomed,2014,85(2):127-134.
21 Shin DH,Lee MJ,Lee HS,et al.Thyroid hormone replacement therapy attenuates the decline of renal function in chronic kidney disease patients with subclinical hypothyroidism.Thyroid,2013,23(6):654-661.
22 Rhee CM, Alexander EK,Bhan I,et al.Hypothyroidism and mortality among dialysis patients.Clin J Am Soc Nephrol,2013,8(4):593-601.
23 Mohamedali M,Reddy Maddika S,Vyas A,et al.Thyroid disorders and chronic kidney disease.Int J Nephrol,2014,2014:520281.
(本文编辑 律 舟)
Subclinical thyroid dysfunction and cardiac structure in patients with maintenance hemodialysis
HEPing1,WANGWeping1,JILing1,MAOHuijuan2
1DepartmentofNephrologyandRadiology,JiangduPeople’sHospitalofYangzhou,Yangzhou225200,China2DepartmentofNephrology,theFirstAffiliatedHospital(JiangsuProvinceHospital),NanjingMedicalUniversity,Nanjing210029,China
MAOHuijuan(E-mail:huijuanmao@126.com)
Objective:To investigate the changes of thyroid function and cardiac structure in patients on maintenance hemodialysis (MHD). Methodology:One hundred patients with end-stage renal disease (ESRD), who had been on hemodialysis for more than three months, were enrolled into this study.According to the thyroid function, they were divided into thyroid dysfunction group and euthyroidism group.Their clinical data and biochemical indicators were collected.The concentrations of serum free-T3 (FT3), free-T4 (FT4) and thyrotropin (TSH) were measured by electrochemiluminescence.The left atrial diameter (LAD), left ventricular end-diastolic diameter (LVEDd), left ventricular end-diastolic dimension (LVEDs), interventricular septal thickness (IVST), left ventricular posterior wall thickness (LVPWT) ,left ventricular ejection fraction (LVEF), left ventricular mass index (LVMI), and relative wall thickness (RWT) were measured by ultrasonic cardiography.The associations between the changes of cardiac structure and thyroid function were analyzed.The levels of plasma homocysteine (Hcy) and C-reactive protein (CRP) were also detected. Results:Among these 100 patients, 49(49%) had thyroid dysfunction.The concentration of Hcy and CRP were significantly higher in thyroid dysfunction group than those in euthyroidism group (P<0.05).LAD, LVEDd, LVEDs, LVPWT, IVST, RWT and LVMI were higher (P<0.05), while LVEF was lower (P<0.01) in thyroid dysfunction group than those in euthyroidism group.Multivariate logistic regression analysis showed that the lower serum FT3 1evel was an independent risk factor for left ventricular hypertrophy. Conclusion:Thyroid dysfunction with low serum FT3 was frequently found in MHD patients.FT3 of patients with MHD was negatively correlated to their left ventricular mass index.
end-stage renal disease hemodialysis thyroid function C-reactive protein
“十二五”国家科技支撑计划课题(2011BAI10B08);江苏省卫生厅科研基金(Z201002)
南京医科大学 硕士研究生(何 萍);1扬州市江都人民医院 肾内科(扬州,225200);2南京医科大学第一附属医院肾内科
毛慧娟(E-mail:huijuanmao@126.com)
ⓒ 2015年版权归《肾脏病与透析肾移植杂志》编辑部所有
2014-12-27

