自噬在肿瘤发生、发展和治疗中的作用研究进展
孔蕴源综述 李蓉审校
(1、南昌大学第一附属医院;2、南昌大学基础医学院,江西 南昌 330001)
细胞自噬(autophagy)是细胞中细胞中降解的通路,是将细胞中受损、衰老、变性以及失去功能的蛋白质和细胞器运输到溶酶体内,并在溶酶体内一系列酶的作用下进行消化、降解的过程[1]。自噬现象广泛存在于各种真核细胞生物中,是细胞中高度保守的过程。其在正常的生理和病理过程中都发挥重要作用。在正常细胞中,细胞自噬在代谢调控、细胞内质量平衡,以及发育和分化过程更新中扮演的角色。细胞中存在多种自噬调节因子,使得细胞中自噬水平保持平衡状态,继而有利于细胞正常生理过程。但是当细胞中自噬水平发生紊乱,会导致细胞生物学功能的异常甚至导致疾病的产生。研究表明,肿瘤、神经退行性疾病、自身免疫性疾病等多种疾病与细胞自噬异常有关[2]。近年来研究表明,自噬在肿瘤发生、发展过程中存在双重效应,既可以促进肿瘤的发生,又可以抑制肿瘤的发生,如同一把“双刃剑”。因此,本文就自噬及其在肿瘤的发生、发展和治疗中的作用做一综述。
1 细胞自噬形成
自噬是细胞利用溶酶体降解自身细胞器和大分子物质的过程.在哺乳动物细胞中,主要存在3种不同的自噬方式:巨自噬(macroautophagy)[3]、微自噬(microautophagy)[4]和分子伴侣介导自噬(chaperone-mediated autophagy,CMA)[5]。巨自噬是指待降解物由内质网膜包绕形成自噬体,然后与溶酶体融合并降解其内容物;微自噬是指被降解物直接被溶酶体包裹并降解的过程;而CMA为胞浆内蛋白结合到分子伴侣后转运到酶体腔中,被溶体酶消化过程。由于微自噬和CMA并没有形成自噬囊泡的过程,而巨自噬在细胞中需要形成独立的自噬囊泡,并且自噬囊泡的形成可以受到药物的干预等,因此通常认为的自噬主要是指能够形成自噬囊泡的巨自噬。
当细胞处于饥饿、高温、低氧、激素、化疗和放疗等危险环境或细胞内细胞器损伤、基因突变、蛋白变性时,来源于细胞膜、内质网、高尔基体等膜结构相互聚集(起始过程);通过成核作用与细胞内大分子相结合,将细胞质或细胞器包裹形成开放的半囊泡 (囊泡延伸过程);然后在溶酶蛋白LAMP1、LAMP2、Rab7、UVRAG 等的作用下形成封闭的自噬体(成熟过程);最终,在溶酶体膜受体的介导作用下,自噬体与溶酶体相互融合形成自噬溶酶体(自噬体-溶酶体融合),并通过溶酶体降解内含物(自噬体降解过程),其降解产物然后被细胞再利用,以实现细胞本身的代谢需要和细胞器的更新(图 1)[2]。
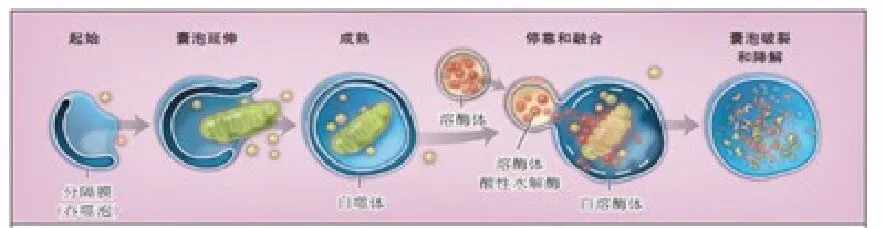
图1 自噬形成的过程:起始→囊泡延伸→成熟→自噬体-溶酶体融合→自噬体降解。
2 调控自噬的主要信号通路
随着对自噬研究的深入,发现多种信号通路可以调节细胞内自噬水平,目前研究比较清楚的自噬调控方式主要包括:(1)mTOR依赖的信号通路:如PI3K-ATK-mTOR信号通路[6]、LKB1-AMPK-mTOR信号通路[7,8]等;(2)mTOR非依赖的信号通路[9,10]:如Beclin1和III型PI3K形成复合物调控自噬,也可以通过Bcl2抗凋亡蛋白家族相互作用调节自噬等等。
2.1 mTOR依赖的信号通路 哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一个高度保守的丝氨酸/苏氨酸蛋白激酶,其为PI3K相关激酶家族成员,具有调节靶蛋白磷酸化的作用。mTOR在细胞中主要以两种复合物的方式存在:分别是对雷帕霉素敏感的mTOR复合物1(mTORC1)和不敏感的mTORC2,其中mTORC1与细胞自噬关系比较密切。研究表明,mTOR是细胞中氨基酸、ATP和激素的感应器,mTOR是自噬体的形成,成熟过程中关键,也是多种自噬调控信号通路的汇合点[12]。研究表明,生长因子受体和配体结合后,导致蛋白激酶PI3K活化,活化的PI3K磷酸化磷脂肌醇(PI)的肌糖环D3位点从而产生PI(3,4,5)P3。PI(3,4,5)P3结合到PDK1和AKT的PH结构域并使它们转位到细胞质膜,继而导致AKT磷酸化,磷酸化的AKT具有激酶活性,可以是mTOR蛋白磷酸化从而激活mTORC1复合物,活化的mTORC1复合物通过激活一系列下游信号通路继而抑制细胞自噬的产生,这一信号通路被称为PI3K-ATK-mTOR信号通路[11]。而抑制PI3K-ATK-mTOR信号通路的任何环境都可以促进细胞自噬的产生。
另外,细胞能级状态也可调控mTORC1复合物的活性。研究表明,蛋白细胞处于饥饿状态时,细胞中的ATP含量明显减少,导致ATP/AMP的比值会下降。ATP/AMP的比值下降可以通过LKB1激酶活化AMP活化蛋白激酶(AMPK),AMPK的下游底物为mTOR[12]。因此LKB1-AMPK通路也可以调控mTOR的活性继而调控细胞中自噬的水平,被称为LKB1-AMPK-mTOR信号通路。
2.2 mTOR非依赖的信号通路 研究表明,在细胞还还存在绕过mTOR调控细胞自噬的方式,被称为mTOR非依赖的信号通路。其中最主要的mTOR非依赖的信号通路为beclin1-Hvps34通路,有实验发现,Mst1(mammalian Ste20-like kinase 1)可使Beclin1 BH3结构域N-端的Thr108磷酸化,增强Beclin1与Bcl-2和/或Bcl-xL疏水沟α3螺旋间的互作,使Beclin1同源二聚体稳定,减弱Atg14L与Beclin1的结合,降低Beclin1-P13K-Atg14L复合体脂激酶Vps34的活性以抑制自噬[13],而死亡相关蛋白激酶DAPK1可以通过磷酸化Beclin1蛋白使得 Beclin1与Bcl-2和/或 Bcl-xL解离,继而与Atg14L形成Beclin1-P13K-Atg14L-Vps34复合体脂激酶,从而达到起始自噬体形成的目的[14,15]。
3 自噬在肿瘤中的作用
在正常生理情况下,自噬可以及时清除细胞中破损或衰老的细胞器、合成错误或折叠错误的蛋白质等大分子物质,防止细胞出现异常的病态(如癌变等),同时自噬的产生的氨基酸、脂肪酸等小分子物质也可以被细胞从新利用。因此,自噬就是细胞的“备用仓库”,对维持细胞正常生物学功能具有非常重要的作用。近年来在多种肿瘤中发现自噬的增强或减弱:一方面,自噬水平的下降也导致肿瘤的恶化和进展;另一方面,自噬增强使肿瘤细胞免受饥饿、化疗、放疗所导致的损伤而持续生存。因此自噬在肿瘤发生、发展过程中可能存在双重效应,如同一把“双刃剑”。
3.1 自噬抑制肿瘤的发生 大量研究表明,多种促进细胞自噬的相关基因在多种肿瘤细胞中缺失,或表达下降,并且在多种肿瘤细胞中也发现自噬能力低于正常细胞,表明自噬减弱与肿瘤的发生明确相关。例如有研究发现促进自噬的分子 (如Beclin1等)在人类乳腺癌、前列腺癌等细胞中缺失或表达下降[16],而在小鼠中敲除Beclin1等位基因导致小鼠多种细胞自噬水平减弱,同时癌症发生率明显高于Beclin1基因正常的小鼠[17]。还有实验证明在正常组织中长期慢性地抑制细胞自噬,会激活肿瘤生成过程:比如化学致癌物诱导形成的肝癌细胞,在癌变前期的肝结节时就已经出现了自噬能力下降的现象[18,19]。由此不难看出,细胞自噬扮演了一个对抗肿瘤生成的角色。
3.2 自噬促进肿瘤的发生 自噬作为细胞本能的防卫武器,在细胞处于恶劣环境中,细胞会启动自噬程序,使得细胞代谢降到最低,维持细胞的生存。在肿瘤细胞中,由于肿瘤细胞快速分裂增殖,需要的营养和能量比正常细胞多,但是肿瘤发生初期时的血管网络没有完全建立,导致营养和能量不能运输到肿瘤组织中,这时,肿瘤细胞通过提高自噬活性防止细胞因缺乏营养而死亡。另外,当肿瘤长大发生血管崩塌时、肿瘤细胞脱离原发灶游走时等都会出现营养不足或供应中断时,也需要肿瘤细胞增强自噬防止细胞死亡[20]。因此,很多肿瘤细胞如结肠癌、肺癌细胞及人宫颈癌细胞等均有较高的自噬潜能,这对肿瘤细胞在对抗恶劣环境过程中起到了一定的保护作用[21,22]。此外,还有实验发现,在乳腺癌、睾丸癌、结肠癌等细胞中抑制细胞自噬后,可以观察到了由环境压力导致的细胞凋亡的增多[23]。
另外,在肿瘤化疗、放疗过程中,细胞会通过提高自噬活性及时清除大量的破损细胞器、损坏的蛋白质等有害成分,以便提供应急的底物和能量为修复受损DNA赢得时间和条件[24]。另外,自噬也使一些抗肿瘤药物的作用减弱:例如恶性神经胶质瘤细胞经替莫唑胺处理3d后,细胞中自噬明显增强,同时细胞的增殖受到抑制;但当药物作用细胞7天后,细胞有开始增殖,同时自噬能力减弱,表明细胞自噬在细胞中的动态改变与细胞所处的环境有关,而这种动态变化可以防止其死亡,保护肿瘤细胞生存[25]。Wu等发现,用于前列腺癌治疗的SFK(Src family kinase)抑制剂临床疗效往往不太理想,这可能与此类药物会诱导高水平的自噬有关[26]。因此,自噬在特定情况下具有保护肿瘤细胞的作用,从而达到促进肿瘤发生、进展的目的。
4 自噬作为肿瘤的治疗靶点
随着自噬在肿瘤发生、发展中作用及其机制研究的深入。研究人员发现多种调控自噬的药物,包括促进自噬和抑制自噬的药物。其中部分药物已近进入临床实验阶段。
4.1 促进自噬的药物 研究表明,促进自噬可以抑制细胞增殖,导致细胞凋亡,因此,靶向促进自噬的药物具有抗肿瘤的作用。目前,最常用的抗肿瘤药物为雷帕霉素(Rapamycin),雷帕霉素最初是作为治疗移植排斥反应和抗真菌治疗一种免疫抑制剂和真菌抑制药物。近年来研究发现,雷帕霉素是一种自噬诱导剂。研究表明,雷帕霉素作用细胞短时间后,细胞自噬相关分子LC3-Ⅱ/LC3-Ⅰ比值会明显升高,提示雷帕霉素具有促进自噬的作用。分子机制研究发现,雷帕霉素细胞中的靶蛋白为mTOR,通过与免疫亲和蛋白FKBP12相结合,依附于mTOR的C末端,阻止mTOR激活,从而抑制mTORC1。由于mTORC1复合物的活化可以促进自噬,因此,雷帕霉素可以通过抑制mTORC1达到促进自噬的作用[27]。目前,雷帕霉素具有抑制多种肿瘤细胞的作用,并且其作为自噬诱导剂用于肿瘤治疗的临床实验已经开始。另外,多种肿瘤抑制剂或分化诱导剂具有诱导细胞自噬的作用。近年来研究发现,中草药姜黄的有效成分姜黄素可以通过多种途径诱导细胞自噬,并能抑制细胞增殖[28]。另外,治疗急性早幼粒细胞白血病的分化诱导剂全反式维甲酸可有通过诱导自噬的方式,促进癌蛋白PML/RARa蛋白的降解,继而促进细胞分化,而抑制自噬可以抑制ATRA介导的PML/RARa蛋白的降解,并能抑制APL细胞分化。这些结果提示促进自噬具有抗肿瘤作用[29]。而靶向促进自噬的药物可能将来可能单独或联合其它药物用于肿瘤治疗。
4.2 抑制自噬的药物 有研究人员发现,在有些肿瘤细胞中,自噬诱导剂不仅不能促进肿瘤细胞死亡,还能抑制其它化学治疗或放疗诱导的细胞凋亡,表明抑制细胞自噬也可能用于肿瘤的治疗。近年来研究发现,多种自噬抑制剂可以增强化疗药物抗肿瘤作用。抗疟疾药物氯喹(chloroquine)可以联合多种化疗药物治疗肿瘤。机制学研究发现,多种化疗药物如环磷酰胺、紫杉醇等具有诱导肿瘤细胞自噬的作用,而氯喹可以选择性地进入溶酶体,通过中和溶酶体酸性环境,并能破坏后溶酶体等方式抑制细胞自噬,从而提高化疗药物对肿瘤细胞的杀伤作用[30,31]。也有研究发现组蛋白去乙酰化酶曲古抑菌肽(TSA)和伏立诺他(SAHA)具有改善笨肾上腺素诱导心肌肥大并可以通过抑制自噬达到抗肿瘤的作用[32]。还有研究发现自噬抑制剂去甲基丙咪嗪(DCMI)除了具有治疗精神疾病外,还可以通过抑制自噬体和溶酶体的融合抑制化疗药物诱导的高水平自噬通路,继而达到增强化疗药物细胞毒性的作用[33]。除此之外,现在还发现其它自噬抑制剂如3甲基腺苷(3-MA),渥曼青霉素(wortmannin),LY294002等多种自噬抑制剂,这些药物都有可能与化疗药物联合治疗,达到增强抗肿瘤效果的作用[34,35]。
5 结语
自噬作为细胞中普遍存在的降解途径之一,其在正常生理和病理过程中发挥重要作用。自噬在肿瘤发生、发展中具有双重效应,一方面具有维持细胞稳态,促进衰老的细胞、病态细胞死亡多作用,另一方面自噬可以防止细胞在恶劣环境中死亡,并具有导致多种药物治疗耐药的作用。因此,探讨肿瘤中细胞中自噬的作用,并通过自噬诱导剂和自噬抑制剂干预肿瘤细胞的自噬水平,继而达到治疗肿瘤的目的,为肿瘤治疗提供新的治疗靶点。
[1]丁渭,张玉林,陈德喜.自噬-凋亡之后的新概念[J].中国生物化学与分子生物学报,2012,28(5):419-423.
[2]Arroyo DS,Gaviglio EA,Peralta Ramos JM,et al.Autophagy in inflammation,infection,neurodegeneration and cancer[J].Int Im-munopharmacol,2014,18(1):55-65.
[3]Feng Y,He D,Yao Z,et al.The machinery of macroautophagy[J].Cell Res,2014,24(1):24-41.
[4]Sahu R,Kaushik S,Clement CC,et al.Microautophagy of cyto solic proteins by late endosomes[J].Dev Cell,2011,20(1):131-139.
[5]Schneider JL,Suh Y,Cuervo AM.Deficient chaperone-mediated autophagy in liver leads to metabolic dysregulation[J].Cell Metab,2014,20(3):417-432.
[6]Heras-Sandoval D,Pérez-Rojas JM,Hernández-Damián J,et al.The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J].Cell Signal,2014,26(12):2694-2701.
[7]Hsu JL,Liu SP,Lee CC,et al.A unique amidoanthraquinone derivative displays antiproliferative activity against human hormone-refractory metastatic prostate cancers through activation of LKB1-AMPK-mTOR signaling pathway[J].Naunyn Schmiedebergs Arch Pharmacol,2014,387(10):979-990.
[8]Han D,Li SJ,Zhu YT,et al.LKB1/AMPK/mTOR signaling pathway in non-small-cell lung cancer[J].Asian Pac J Cancer Prev,2013,14(7):4033-4039.
[9]Dai JP,Zhao XF,Zeng J,et al.Drug screening for autophagy inhibitors based on the dissociation of Beclin1-Bcl2 complex using BiFC technique and mechanism of eugenol on anti-influenza A virus activity[J].PLoS One,2013,8(4):e61026.
[10]Castino R,Bellio N,Follo C,et al.Inhibition of PI3k class III-dependent autophagy prevents apoptosis and necrosis by oxidative stress in dopaminergic neuroblastoma cells [J].ToxicolSci,2010,117(1):152-162.
[11]Furuta S,Hidaka E,Ogata A,et al.Ras is involved in the negative control of autophagy through the class I PI3-kinase[J].Oncogene,2004,23(22):3898-3904.
[12]Gwinn DM,Shackelford DB,Egan DF,et al.AMPK phosphorylation of raptor mediates a metabolic checkpoint[J].Mol Cell,2008,30(2):214-226.
[13]Maejima Y,Kyoi S,Zhai P,et al.Mst1 inhibits autophagy by promoting the interaction between Beclin1 and Bcl-2[J].Nat Med,2013,19(11):1478-1488.
[14]Levin-Salomon V,Bialik S,Kimchi A.DAP-kinase and autophagy[J].Apoptosis,2014,19(2):346-356.
[15]Eisenberg-Lerner A,Kimchi A.PKD is a kinase of Vps34 that mediates ROS-induced autophagy downstream of DAPk[J].Cell Death Differ,2012,19(5):788-797.
[16]Laddha SV,Ganesan S,Chan CS,et al.Mutational landscape of the essential autophagy gene BECN1 in human cancers[J].Mol Cancer Res,2014,12(4):485-490.
[17]Brech A,Ahlquist T,LotheRA,et al.Autophagy in tumour suppression and promotion[J].Mol Oncol,2009,3(4):3366-3375.
[18]Cuervo AM,Autophagy:In sickness and in health[J].Trends Cell Biol,2004,14(2):70-77.
[19]Jin S,p53,Autophagy and tumor suppression [J].Autophagy,2005,1(3):171-173.
[20]Lock R,Debnath J.Extracellular matrix regulation of autophagy[J].Curr Opin Cell Biol, 2008,20(5):583-588.
[21]Kanazawa T,Germano IM,Komata T,et al Role of autophagy in temozolomide-induced cytotoxicity for malignant glioma cells[J].Cell Death Differ,2004,11(4):448-457.
[22]Wu Z,Chang PC,Yang JC,et al.Autophagy blockade seneitizes prostate cancer cells towards Src family kinase inhibitors[J].Genes Cancer 2010,1(1):40-49.
[23]Maiuri MC,Zalckvar E,Kimchi A,et al.Self-eating and selfkilling:crosstalk between autophagy and apoptosis[J].Nat Rev Mol Cell Biol,2007,8(9):741-752.
[24]Li X,Fan Z.The epidermal growth factor receptor antibody cetuximab induces autophagy in cancer cells by downregulating HIF-1alpha and Bcl-2 and activating the beclin 1/hVps34 complex[J].Cancer Res,2010,70(14):5942-5952.
[25]潘强.替莫唑胺耐药的恶性胶质瘤细胞系耐药特性演变的研究[D],硕士研究生学位论文,2010.
[26]Wu Z,Chang PC,Yang JC,et al.Autophagy Blockade Sensitizes Prostate Cancer Cells towards Src Family Kinase Inhibitors[J].Genes Cancer,2010,1(1):40-49.
[27]Chiarini F,Evangelisti C,McCubrey JA,et al.Current treatment strategies for inhibiting mTOR in cancer[J].Trends Pharmacol Sci,2015,36(2):124-135.
[28]Xiao K,Jiang J,Guan C.Curcumin induces autophagy via activating the AMPK signaling pathway in lung adenocarcinoma cells[J].J Pharmacol Sci,2013,123(2):102-109.
[29]Isakson P,Bjoras M,Boe SO,et al.Autophagy contributes to therapy-induced degradation of the PML/RARA oncoprotein[J].Blood,2010,116(13):2324-2331.
[30]Tang MC,Wu MY,Hwang MH,et al.Chloroquine enhances gefitinib cytotoxicity in gefitinib-resistant nonsmall cell lung cancer cells[J].PLoS One,2015,10(3):e0119135.
[31]Duffy A,Le J,Sausville E,et al.Autophagy modulation:a target for cancer treatment development[J].Cancer Chemother Pharmacol,2015,75(3):439-447.
[32]Cao DJ,Wang ZV,Battiprolu PK,et al.Histone deacetylase(HDAC)inhibitors attenuate cardiac hypertrophy by suppressing autophagy[J].PNAS,2011,108(10):4123-4128.
[33]RossiM1,Munarriz ER,BartesaghiS,etal.Desmethylclomipramine induces the accumulation of autophagy markers by blocking autophagic flux[J].J Cell Sci,2009,122(Pt18):3330-3339.
[34]Coker-Gurkan A,Arisan ED,Obakan P,et al.Inhibition of autophagy by 3-MA potentiates purvalanol-induced apoptosis in Bax deficient HCT 116 colon cancer cells[J].Exp Cell Res,2014,328(1):87-98.
[35]Ren Y,Huang F,Liu Y,et al.Autophagy inhibition through PI3K/Akt increases apoptosis by sodium selenite in NB4 cells[J].BMB Rep,2009,42(9):599-604.
——雷帕霉素

