ARTP诱变选育高温蛋白酶高产菌株及其酶学性质研究
薛 刚,陈利娟,吴 斌,何冰芳
(南京工业大学生物与制药工程学院,江苏南京 211816)
ARTP诱变选育高温蛋白酶高产菌株及其酶学性质研究
薛 刚,陈利娟,吴 斌,何冰芳*
(南京工业大学生物与制药工程学院,江苏南京 211816)
以高温环境土样中筛选的产高温蛋白酶菌为出发菌株,利用常压室温等离子体诱变技术选育出一株高产突变株BacilluslicheniformisTP1-5,产酶活力达到33200U/mL,为出发菌株的1.56倍。通过乙醇沉淀和阴离子交换层析两步纯化,获得电泳纯的高温蛋白酶。酶学性质研究表明,该蛋白酶为高温碱性丝氨酸蛋白酶,酶的最适pH为10.0,最适反应温度为60℃,具有较好的pH稳定性和热稳定性;对离子型和非离子型表面活性剂均具有很高的耐受性,为进一步开发应用奠定了基础。
高温蛋白酶,诱变选育,纯化,酶学性质
蛋白酶是一类存在于动物、植物及微生物中的蛋白质水解酶类,广泛地应用于食品、医药、洗涤剂、纺织及皮革处理等行业[1]。普通蛋白酶往往热稳定性差,催化温度低,因此其在实际应用上受到较大的限制。而高温蛋白酶是一类最适催化温度为60~80℃的蛋白酶,对高温、酸碱、有机溶剂、蛋白变性剂具有良好的抗性,可作为高效工业生物催化剂,拓宽蛋白酶制剂的应用范围[2]。
分离自如温泉、火山、堆肥等高温环境的极端微生物是高温蛋白酶的重要来源[3-4]。通常从自然界所筛选菌种的产酶能力难以达到实际生产所需要的水平,因此人们采用对野生菌种进行诱变选育,以及目标酶类的高效异源表达等手段来进一步提高其产酶能力。常压室温等离子体诱变是一种新型的育种技术,该技术可以快速高效地突变各类微生物,已成为获取高产菌株的有效方法[5]。
本研究通过对自行筛选的产高温蛋白酶菌株BacilluslicheniformisTP1进行常温室压等离子体诱变选育,获得了一株遗传性状稳定的高产菌株,并对其所产高温蛋白酶进行纯化和酶学性质的研究,为进一步的研究与开发高温蛋白酶奠定了基础。
1 材料与方法
1.1 材料与仪器
地衣芽孢杆菌(BacilluslicheniformisTP1) 由本实验室分离筛选获得;酵母粉、蛋白胨 英国Oxoid公司;酪蛋白 Sigma Aldrich公司;其他试剂 均为化学纯,采购自国药集团化学试剂有限公司。
APTP生物育种机 北京思清源生物技术公司;AKTA prime plus蛋白纯化系统 美国GE公司;紫外分光光度计UV-2102C 尤尼柯仪器有限公司;冷冻离心机CR21G 日立工机有限公司。
1.2 培养基配方
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10(固体LB培养基则再加20g/L的琼脂粉)。
蛋白酶筛选培养基(g/L):葡萄糖10,酵母粉5,NaCl 5,营养琼脂20,10%(v/v)脱脂奶粉溶液(10g/L,单独灭菌,108℃,30min)。
产酶发酵培养基(g/L):葡萄糖40,豆粕粉30,Na2HPO44,MgSO40.2,CaCl20.2,pH自然。
1.3 蛋白酶活力测定
采用紫外分光光度法,参照文献[6],略有改动。缓冲液是50mmol/L,pH10.0的Gly-NaOH缓冲液,反应温度为60℃。蛋白酶活力单位的定义:在相应条件下,每分钟水解酪蛋白产生1μg酪氨酸所需要的酶量。
1.4 ARTP诱变方法
按照ARTP生物诱变育种机的操作流程,以氦气作为工作气体,设定功率为100W,通气量为10L/min,等离子体发射源与样品之间距离为2mm[5]。为了寻找最佳诱变条件,设定不同的处理时间(20,40,60,80s),然后将处理后的样品稀释涂布至LB平板,通过平板菌落计数以未处理样品为对照计算致死率。
1.5 突变菌株选育
初筛:将最适处理时间处理后的样品稀释后涂布至含脱脂牛奶的筛选平板,37℃培养48h后测定水解圈直径与菌落直径之比(HC比值),根据HC比值的大小初步衡量该菌株产酶能力的高低。
复筛:接具有较高HC比值突变株至LB液体培养基中,于37℃、180r/min培养过夜得到种子液,按2%接种量接入至发酵培养基中,在相同条件下振荡培养60h,发酵液离心(10000r/min,10min)后取上清测定蛋白酶活力。
1.6 高温蛋白酶的分离纯化
1.6.1 乙醇沉淀 取20mL粗酶液上清,分别按30%、40%、50%、60%、70%及80%的乙醇浓度依次加入预冷的乙醇进行分级沉淀,每级沉淀结束后4℃静置2h,离心(12000r/min×15min,4℃)取上清进行下一级沉淀。沉淀蛋白分别用等量的pH10.0、50mmol/L的Gly-NaOH缓冲液溶解并测定酶活力。
1.6.2 DEAE-Sepharose FF阴离子交换层析 将上述乙醇沉淀纯化所得酶液进行DEAE弱阴离子层析,平衡缓冲为50mmol/L、pH9.5的Gly-NaOH缓冲液,洗脱缓冲是平衡缓冲液中加入1mol/L的NaCl,流速设定为1mL/min,上样后收集穿透峰及洗脱峰,检测各收集峰的酶活力及蛋白浓度。
1.6.3 SDS-PAGE电泳分析 采用浓度为12.5%的十二烷基磺酸钠(SDS)—聚丙烯酰胺凝胶(PAGE)垂直板电泳[7]。
1.6.4 蛋白含量测定 采用Brandford法[8],标准蛋白为牛血清白蛋白(BSA)。
1.7 蛋白酶性质的研究
1.7.1 蛋白酶的最适反应pH及pH稳定性 配制pH6.0~12.0的缓冲液,并用各种缓冲配制相应pH的酪蛋白底物溶液,纯化后的蛋白酶在pH6.0~12.0条件下进行酶活力测定以确定最适pH。将适当稀释的酶液分别与不同pH缓冲混合,40℃保温60min后,取样测残余酶活力,由此确定蛋白酶的pH稳定性。
1.7.2 蛋白酶的最适反应温度及热稳定性 为考察纯化后的蛋白酶的最适反应温度,在最适pH条件下,于不同温度(30~70℃)测定纯酶的酶活力。在热稳定性实验中,纯化的酶液经不同温度处理60min后,在标准条件下检测蛋白酶活力。
1.7.3 抑制剂和表面活性剂对蛋白酶活力的影响 纯化后的酶液与不同浓度的各种抑制剂或表面活性剂混合,30℃下放置30min后检测蛋白酶残余酶活力,以不加抑制剂的为对照。
2 结果与分析
2.1 等离子体处理时间对BacilluslicheniformisTP1的致死率
诱变处理剂量或时间不仅影响致死率,同时能显著影响突变效率,在一个合适的突变效率区间进行有效的筛选是菌种选育的关键之处。本研究首先对出发菌株TP1进行不同时间的等离子体射流处理,其致死率曲线见图1。常温室压等离子体对TP1菌株的损伤作用效果明显,随着等离子体射流处理时间的增加,其致死率逐渐增大。处理40s杀死约60%的菌体;处理时间达到80s以上时,菌株致死率接近100%。据文献报道,当致死率在90%左右时,诱变处理对细胞的诱变效应较强[9-10],所以本研究采用60s处理时间(致死率约为92%)对菌株BacilluslicheniformisTP1进行诱变。
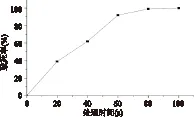
图1 等离子体处理Bacillus licheniformis TP1的致死率曲线Fig.1 The lethal rate of Bacillus licheniformis TP1 treated by ARTP
2.2 ARTP诱变选育蛋白酶高产突变株
出发菌株TP1经ARTP诱变处理,通过初筛和复筛选育出7株产酶活力相对较高的菌株(表1)。由表1可以看出,水解圈与菌落直径比(HC值)与复筛所测酶活力大小呈正相关,所以初筛使用的水解圈指示标记能够排除大量的负突变菌株,大大提高了筛选的效率。其中TP1-5菌株的酶活力最高且遗传性状稳定(传代20次产酶能力无下降),通过初步发酵优化其酶活力达到33200U/mL,是出发菌株酶活力的1.56倍。目前国内已报道的产高温蛋白酶菌株产酶能力大都比较低,例如彭素萍等[11]筛选到的耐热菌BY25产高温蛋白酶活力为4170U/mL;唐兵等[12]报道的嗜热脂肪芽孢杆菌WF146高温蛋白酶产量为600U/mL;黄光荣等[13]分离到的嗜热芽孢杆菌HS08产高温蛋白酶活力为6754U/mL。本研究通过诱变选育获得的高温蛋白酶高产菌株,具有产酶活力高且遗传性状稳定的特点,为实现高温蛋白酶的产业化生产奠定了基础。

表2 蛋白酶TP1纯化结果Table 2 Purification of the protease from Bacillus licheniformis TP1-5

表1 菌株TP1诱变选育的筛选结果Table 1 The screening result of mutant strains TP-1
2.3 蛋白酶的分离纯化
由于有机溶剂沉淀法方便快捷的特点,本研究采用乙醇沉淀法对高温蛋白酶进行初步纯化。当乙醇浓度达到60%时,目的蛋白开始大量沉淀,当乙醇浓度为70%时,目的蛋白基本沉淀完全,故选取50%~70%沉淀部分回收,并用pH10.0的Gly-NaOH缓冲溶解用于下一步的纯化。通过乙醇沉淀,目的蛋白酶得到初步纯化及浓缩,酶活回收率为71%,纯化倍数为1.9倍(表2)。
将乙醇沉淀回收的酶液上样至pH9.5 Gly-NaOH缓冲平衡好的阴离子交换层析柱,收集穿透峰及洗脱峰。酶活力测定表明,目的蛋白在pH9.5的条件下不能吸附到柱上,而杂蛋白绝大部分被吸附,从而通过收集穿透峰获得了电泳纯的目的蛋白(图2)。由此推断该蛋白酶的等电点较高,在pH9.5条件下仍不能带有足够的负电荷吸附至填料。本研究通过两步纯化获得了电泳纯的蛋白酶,该酶的表观分子量约为30ku,最终酶活回收率为53%,纯化倍数为3.1倍(表2)。

图2 SDS-PAGE分析蛋白纯化结果Fig.2 SDS-PAGE analysis of the purified protease注:Line 1:标准蛋白;Line 2:粗酶液; Line 3:乙醇沉淀产物;Line 4:柱层析穿透峰。
2.4 蛋白酶TP1的酶学性质
2.4.1 蛋白酶TP1的最适反应pH以及pH稳定性 催化体系pH对蛋白酶活力的影响见图3(a),该酶在pH8.0~11.0范围内具有较高的水解活力,最适pH10.0~11.0,pH7时仅为最适pH时活力的一半,表明该酶为典型的碱性蛋白酶。蛋白酶TP1的pH稳定性测定结果如图3(b),该酶在pH8.0~10.0范围内未观察到酶活损失,显示了很高的稳定性。当pH达到11时,酶活力损失较大,表明该酶的最适催化pH并非其稳定pH,所以该酶应保存在pH8.0~10.0的体系中,并宜在pH10.0以下实现其高效催化。
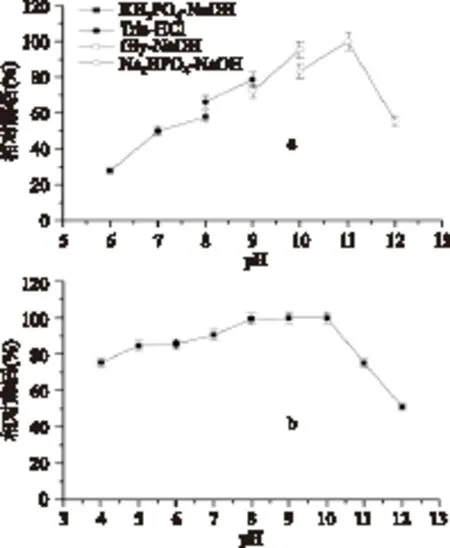
图3 蛋白酶TP1的最适反应pH(a)及pH稳定性(b)Fig.3 The optimum pH and the pH stability of protease TP1
2.4.2 蛋白酶TP1的最适反应温度以及热稳定性 催化反应温度对蛋白酶TP1的酶活力影响见图4。图4(a)表明,蛋白酶TP1在50~60℃范围内具有较高活力,该酶的最适反应温度为60℃,属于高温蛋白酶的范畴。该酶的稳定性如图4(b)所示,蛋白酶TP1在30~50℃保温1h后,酶活残留95%以上,在最适温度60℃条件下剩余酶活70%左右,但当保温温度达到70℃时,蛋白酶TP1变性失活较快,基本检测不到剩余酶活,这表明该酶在40~60℃范围内具有较高的热稳定性。
目前已报道的高温蛋白酶主要来源于芽孢杆菌,如BacillusstearothermophilusWF146[12],BacilluslicheniformisMIR29[5],BacillussubtilisPE-11[14]等,这些蛋白酶最适温度通常都在60~80℃,并且在高温条件下具有较强的稳定性,在高温洗涤、制革工业、食品高温处理等行业领域具有广阔的应用前景[13]。

图4 蛋白酶TP1的最适反应温度(a)及热稳定性(b)Fig.4 Effects of temperatures on the activity and thermal stability of protease TP1
2.4.3 抑制剂和表面活性剂对蛋白酶活力的影响 本研究进一步考察了蛋白酶抑制剂苯、表面活性剂、变性剂等对蛋白酶的影响,结果如表3所示。EDTA对蛋白酶TP-1-5无抑制作用,表明该蛋白酶不属于金属酶,常见金属离子(Ca2+、Mg2+、Zn2+、Cu2+、Mn2+)对该酶活力影响较小(数据未列出)。该蛋白酶被典型的丝氨酸蛋白酶抑制剂PMSF强烈抑制,由此可判断该酶属于丝氨酸蛋白酶。其他的蛋白抑制剂(β-巯基乙醇)和变性剂(Urea)对蛋白酶
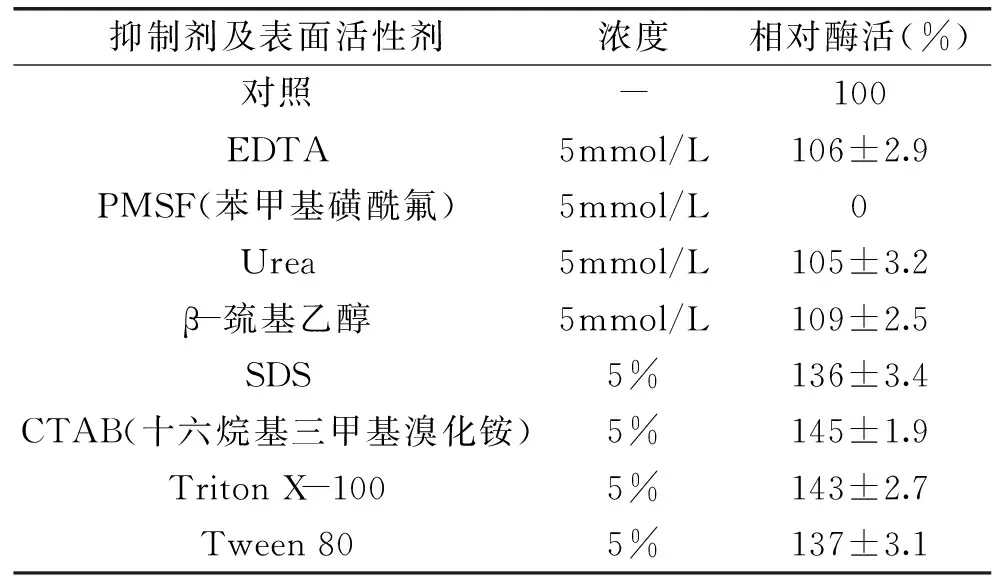
表3 抑制剂和表面活性剂对蛋白酶活性的影响Table 3 Effect of inhibitors and surfactants on protease activity
TP1均无显著影响,说明该酶具有较强的稳定性。此外离子型表面活性剂(CTAB、SDS)与非离子型表面活性剂(TritonX-100、Tween-80)对蛋白酶TP1均无抑制作用,甚至有一定的激活作用,这一性质与已报道的BacilluslicheniformisXG12[15]所产的表面活性剂稳定性碱性蛋白酶相似。高温蛋白酶TP1对多种变性剂和表面活性剂有比较强的耐受性,可望应用于高温洗涤等用途。
3 结论
本研究通过对自行筛选的高温蛋白酶产生菌进行常压室温等离子体诱变,获得高产突变株TP1-5,其酶活达到33200U/mL,相比原始菌株提高了56%,其酶活产量显著高于国内已报道的产高温蛋白酶菌株。
通过乙醇沉淀和DEAE柱层析纯化,获得了电泳纯的高温蛋白酶,酶学性质研究表明,该酶属于碱性丝氨酸蛋白酶,最适pH为10.0,最适反应温度为60℃,同时该酶对抑制剂和表面活性剂有较强的抗性。以上优良特性,预示高温蛋白酶在高温洗涤、制革工业及饲料行业的角蛋白水解等领域具有广阔的应用前景。
[1]Rao M B,Tanksale A M,Ghatge M S,etal. Molecular and biotechnological aspects of microbial proteases[J]. Microbiology and Molecular Biology Reviews,1998,62(3):597-635.
[2]王国惠. 常温环境中产嗜热蛋白酶菌资源[J]. 生态学杂志,2007,26(1):21-24.
[3]张燕新,赵印,许敬亮,等. 3 株高温蛋白酶产生菌的分离与鉴定[J]. 应用与环境生物学报,2007,13(4):561-564.
[4]Ferrero M A,Castro G R,Abate C M,etal. Thermostable alkaline proteases ofBacilluslicheniformisMIR 29:isolation,production and characterization[J]. Applied Microbiology and Biotechnology,1996,45(3):327-332.
[5]柏中中,孙家铎,吴斌. 基于常压室温等离子体技术诱变选育D-乳酸高发酵速率菌株[J]. 食品工业科技,2013,34(24):173-176.
[6]Shimogaki H,Takeuchi K,Nishino T,etal. Purification and properties of a novel surface-active agent-and alkaline-resistant protease fromBacillussp. Y[J]. Agricultural and biological chemistry,1991,55(9):2251-2258.
[7]汪家政,范明. 蛋白质技术手册[M]. 北京:科学出版社,1999,42-47.
[8]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical biochemistry,1976,72(1):248-254.
[9]Hua X,Wang J,Wu Z,etal. A salt tolerant Enterobacter cloacae mutant for bioaugmentation of petroleum-and salt-contaminated soil[J]. Biochemical Engineering Journal,2010,49(2):201-206.
[10]Laroussi M. Low temperature plasma-based sterilization:overview and state-of-the-art[J]. Plasma Proc Polym,2005,2:391-400.
[11]彭素萍,林先贵,王一明. 一株产高温蛋白酶耐热菌BY25的产酶条件与酶学性质研究[J]. 土壤,2010,42(3):410-414.
[12]唐兵,周林峰,陈向东,等. 嗜热脂肪芽孢杆菌高温蛋白酶的产生条件及酶学性质[J]. 微生物学报,2000,40(2):187-192.
[13]黄光荣,应铁进,戴德慧,等. 嗜热芽孢杆菌蛋白酶HS08的分离纯化研究[J]. 食品科学,2007,28(4):179-182.
[14]Adinarayana K,Ellaiah P,Prasad D S. Purification and partial characterization of thermostable serine alkaline protease from a newly isolatedBacillussubtilis PE-11[J]. Aaps Pharmscitech,2003,4(4):440-448.
[15]高兆建,李超,候进慧. 表面活性剂稳定性碱性蛋白酶纯化及性质研究[J]. 食品科学,2011,32(5):211-216.
Selection of high-yield thermostable protease producing strain by ARTP and the study on its enzymological properties
XUE Gang,CHEN Li-juan,WU Bin,HE Bing-fang*
(College of Biotechnology and Pharmaceutical Engineering,Nanjing University of Technology,Nanjing 211816,China)
In order to obtain an industrial strain with higher thermostable protease production,the original strain ofBacilluslicheniformisTP1 was mutated by atmospheric and room temperature plasmas. A good genetic stability strain TP1-5 was screened from the mutants,which produced 33200U/mL from initial 21300U/mL of the thermostable protease. The protease was purified by ethanol precipitation and anion exchange chromatography to electrophoretic homogeneity. The purified protease had a good pH stability and thermal stability,with optimal temperature and pH was 60℃ and 10.0. The protease also exhibited high stability towards surfactants such as SDS,Tween-80,TritonX-100etal.
thermostable protease;atmospheric and room temperature plasmas(ARTP);purification;enzyme characterization
2014-04-01
薛刚(1988-),男,硕士研究生,研究方向:微生物学。
*通讯作者:何冰芳(1962-),女,博士,教授,研究方向:酶工程。
国家863计划(2012AA022205);国家973计划(2011CB710800)。
TS201.3
A
1002-0306(2015)01-0177-05
10.13386/j.issn1002-0306.2015.01.028

