消化道重建术后维生素D研究进展
罗金龙综述,姜淮芜审校
(1泸州医学院附属医院普通外科,四川泸州646000;2绵阳四0四医院腹部外科,四川绵阳621000)
消化道重建术后维生素D研究进展
罗金龙综述,姜淮芜审校
(1泸州医学院附属医院普通外科,四川泸州646000;2绵阳四0四医院腹部外科,四川绵阳621000)
维生素D是一种人体必需的脂溶性维生素,为固醇类衍生物,主要以两种形式存在:维生素D2(麦角钙化醇)和维生素D3(胆钙化醇)。人体维生素D主要有两种来源:一是人皮肤中的7-脱氢胆固醇在紫外线照射下,转变为胆钙化醇,即维生素D3;二是通过饮食摄入,包括动物肝脏、蛋类、乳类,而植物中的麦角固醇经过紫外线照射后转变为维生素D2,其主要与脂肪一起在空肠、回肠被吸收,胆汁、胰液等消化液有助于维生素D吸收。维生素D2及维生素D3均无生物活性,两者在血液中与维生素D结合蛋白相结合(vitamin D binding proteins,VDBP),经血流作用转运至肝脏,经过25-羟化酶作用转化为25-羟胆骨化醇[25(OH)D],后者在肾脏经1-α-羟化酶作用,转变为具有很强生物活性的1α,25-二羟胆骨化醇[1α,25(OH)2D],并通过血液循环运送至全身发挥生物学作用[1]。
血清25(OH)D是目前公认衡量人体维生素D状况的生物学指标[2]。多数专家认为,血清25(OH)D水平<20 ng/ mL为维生素D缺乏,血清25(OH)D在20~29 ng/ml为维生素D不足、25(OH)D≥30 ng/mL为维生素D充足[3]。维生素D不足发生率大约在30%~50%,全球约10亿人存在维生素D缺乏或不足[4]。Michel等调查估计,肥胖手术后,维生素D缺乏发生率甚至可能达到96.7%[5]。可见人群中维生素D缺乏普遍存在,特别是消化道手术后,维生素D缺乏明显增加。本文将就维生素D生物学作用及其在消化道手术后维生素D代谢情况作一综述。
1 维生素D生物学作用
1.1 调节钙、磷代谢
维生素D的主要作用是调节钙、磷代谢,促进肠道钙磷吸收,维持血钙和血磷的平衡[6]。研究显示,没有维生素D,人体只能从食物中吸收10%~15%的钙和60%的磷。相反1,25(OH)2D能够使肠道吸收钙、磷提高至30%~40%,80%[7]。研究认为,维生素D调节钙、磷吸收的主要机制包括:1,25(OH)2D通过与肠道壁内VDR结合,促使钙、磷在肠道的主动吸收、转运;促进近曲小管对钙、磷的重吸收,升高血钙、血磷;刺激破骨细胞,使骨盐溶解,重吸收钙、磷,维持血钙、血磷正常[8]。
1.2 促进骨骼生长
维生素D在促进骨骼生长,维持骨骼健康中的作用已得到公认。儿童时期维生素D缺乏,会导致佝偻病,成年后维生素D缺乏可能导致骨软化及骨质疏松。维生素D促进骨骼生长,维持骨骼健康的主要机制:维生素D3能够通过增加钙磷在小肠吸收从而促进骨的钙化[6-8];1,25(OH)2D可通过增加成骨细胞数量、提高成骨细胞活性从而促进骨骼生长[9];另外,1,25(OH)2D对甲状旁腺激素(PTH)的直接抑制作用及胃肠道钙吸收增加对PTH的间接抑制,减少骨丢失[10];使Ca2+通过骨细胞膜进入骨组织,促进骨盐沉积,促进骨的钙化[11]。
1.3 调节免疫功能
长期以来,人们对于维生素D的认识主要集中在钙、磷及骨代谢方面。随着研究深入,在淋巴细胞、胸腺、甲状腺等免疫细胞中发现维生素D受体(vitamin D receptor,VDR),开阔了维生素D在免疫调节中的认识。研究发现,维生素D主要通过调节免疫细胞的增殖、分化,诱导炎症因子及免疫球蛋白表达实现对免疫系统的调节[12]。维生素D对免疫系统的起到双向调节作用:一方面可以通过促进免疫细胞抗菌肽和防御素合成增强免疫功能[13];另一方面,还可以通过调节免疫细胞表面的模式识别受体表达和免疫细胞合成CYP24,抑制炎症因子表达,防止过度炎症反应[14]。其主要作用机制为:1, 25(OH)2D促进外周血中单核细胞向巨噬细胞分化,同时可加强单核/巨噬细胞的结合、吞噬、杀灭病原维生素的作用,同时也可刺激巨噬细胞生成免疫抑制剂前列腺素E2,并且能抑制巨噬细胞分泌炎症因子和趋化因子,调节免疫平衡[15];维生素D可以通过上调toll样受体(toll-like receptor,TLR)2/1,诱导抗菌肽的表达,进而增强吞噬细胞杀死病原菌的作用,同时也可通过下调TLR2、TLR4、TLR9表达,抑制单核-巨噬细胞的抗原提呈作用[15-16];1,25(OH)2D可通过抑制辅助型T细胞(help T cell,Th)1产生,促进Th2的产生,抑制淋巴细胞增殖,降低免疫反应;也可抑制IL-17基因转录,降低血清IL-17水平,抑制其活性,减轻免疫反应;增加血液中调节性T细胞(regulatory T cell,Treg)数量,抑制过度的免疫反应;抑制B细胞增殖和免疫球蛋白的生成,延迟B细胞前体向浆细胞的分化,调节免疫反应[17]。
1.4 抑制肿瘤生长
研究显示,维生素D缺乏与多种肿瘤发生显著相关,如前列腺癌、卵巢癌、乳腺癌、肺癌、鳞状细胞癌等[18]。进一步研究发现,1,25(OH)2D及维生素D类似物还具有显著抗癌作用[19]。1α,25(OH)2D及维生素D类似物发挥抗肿瘤作用主要通过VDR介导的信号通路实现:通过调控肿瘤细胞的细胞周期进行的,抑制GO/G1期向S期转化,抑制肿瘤细胞增殖;抑制肿瘤血管生成,调节多种参与肿瘤侵袭和转移的分子,抑制肿瘤侵袭、转移;诱导肿瘤细胞自噬,抑制肿瘤细胞生长通过多种途径诱导肿瘤细胞凋亡[20]。
至2007年,Kristin[21]等提出维生素D信号通路可能是潜在的抗肿瘤治疗途径之一的观点以来,越来越多的研究致力于维生素D作为预防和治疗肿瘤药物的开发。也有大量研究显示,在联合化疗药物抗肿瘤治疗中的积极作用。但对于其作为药物运用及其类似物在使用剂量、药物代谢动力学、药物效应动力学研究仍较少。但不可否认其作为抗肿瘤治疗中的应用前景,图1。
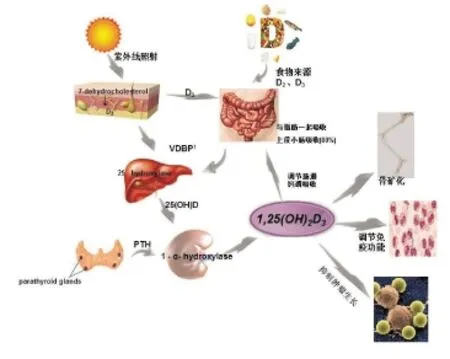
图1 维生素D代谢及作用
2 减肥手术消化道重建方式与患者维生素D变化的研究
消化道重建术后患者存在不同程度营养不良,主要以维生素D、蛋白质、钙、铁、维生素B12尤为明显[22]。而目前对于术后维生素D缺乏仍未取得足够重视,使较多患者疏于治疗,甚至导致严重的并发症。
2.1 不同消化道重建术后维生素D代谢中的初步分析
Hamoui发现[23]维生素D缺乏与消化道重建术式选择明显相关。相同的是,帕纳拉斯等总结行腹腔镜可调节胃束带术(laparoscopic adjustable gastric banding,LAGB)和sleeve胃切除术(sleeve gastrectomy,SG)患者术后维生素D缺乏情况明显低于Roux-en-Y胃旁路术(Roux-en-Y gastric bypass, RYGB)、胆胰分流术(Biliopancreatic Diversion,BPD)和十二指肠开关术(Duodenal Switch,DS)[24],以BPD/DS尤为明显。而在BPD患者术后维生素D缺乏情况的分析中发现,保留较长共同通路的患者术后维生素D缺乏情况相对于短共同通路者更轻(100 cm vs 75 cm)。Michel等比较45例RYGB术后、55例SG术后患者维生素D状况,发现术后1、3、6、12月,经十二指肠重建的SG术后患者明显高于旷置十二指肠功能的RYGB术后患者,其差异有统计学意义[5]。而Moore等在对消化道重建术后患者维生素有效补充量分析显示,11例保留十二指肠功能重建术后患者外源性维生素D需求也明显低于12例旷置十二指肠功能的重建术后患者[25]。
众所周知,维生素D的吸收主要在小肠,尤以小肠上端吸收最多(80%)。经十二指肠的重建方式,由于保留了消化道顺应性,故食物仍经过小肠上端,较大程度的发挥了上段小肠的功能,促进维生素D在上段小肠的吸收,减轻术后维生素D的缺乏。且食物通过十二指肠,保留了食物对十二指肠的刺激作用,反射性的引起消化液的分泌及胃肠道蠕动,使食物更充分的分解,促进维生素D的消化、吸收,故术后维生素D缺乏相对较轻。而未保留十二指肠功能的BPD/DS手术,胆胰支与距离回盲瓣50 cm处的回肠吻合,旷置了大部分胃、十二指肠、空肠和部分近端回肠,故术后维生素D缺乏较严重。提示保持消化道解剖及生理结构的连续性,可以减轻术后维生素D缺乏,图2。
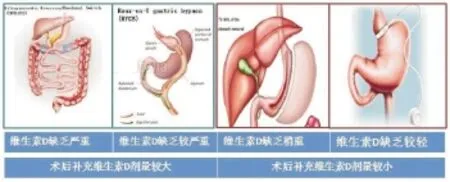
图2 不同消化道重建术后维生素D缺乏情况及补充剂量
2.2 不同消化道重建术后影响维生素D代谢的可能机制
目前消化道重建术后维生素D的研究主要集中在减肥手术中。减肥手术主要有两大类:一类为限制性手术,包括胃束带术、袖状胃切除术等,其主要通过缩小胃容量减少进食量而达到减肥目的;另一类为吸收不良手术,如胃旁路术、胆胰分流术等,其主要通过人为改变消化道结构,减少营养吸收达到减肥效果。可见两类手术均可能导致维生素D等营养物质吸收减少[5]。研究认为术后维生素D缺乏可能机制:限制性手术后,患者进食量减少,维生素D补充不足;吸收不良性手术导致小肠吸收面积减少,维生素D在肠道吸收减少;消化道生理结构改变,导致胆盐与摄入脂肪不能充分混合,使脂肪吸收减少,导致维生素D吸收减少;胃肠道术后可能存在脂肪泻,影响维生素D吸收;胃迷走神经损害,使胆、胰液分泌减少,限制维生素D吸收;肥胖或者术后,皮下脂肪减少,维生素D贮藏减少;术后患者体弱,户外活动不足,7-脱氢胆固醇转化减少。
3 消化道重建方式评价及期望
维生素D在人体生理病理过程中扮演着重要作用,维生素D应作为评价消化道重建术后患者生存及生活质量的重要指标。且应该对消化道重建术后患者维生素D情况进行密切监测,并给予合理的补充。
胃癌切除术后,在达到肿瘤根治的基础上,较好的消化道重建方式可有效提高患者生存质量[26]。而至Billroth式手术至今的100多年时间里,消化道重建术式已达70余种。但目前仍无一种公认的标准术式。究其原因,受限于科技发展水平,对于消化道重建方式对于胃肠道生理、病理功能的改变未完全认识,术后也无统一、全面及合理的评价方式。而对于在我院行胃癌根治术的患者,经不同消化道重建术后维生素D缺乏情况前期研究,以及对于今年来相关文献总结发现,经十二指肠行消化道重建的患者术后维生素D的缺乏明显较低,切术后需要维生素D的补充剂量明显较少。故我们认为胃癌切除术后行消化道重建的患者应该尽量保留十二指肠的生理作用,以及上段小肠的吸收功能。
1.Levi M.nuclear receptor in renal disease[J].Biochim Biophys Acta,2011,1812(8):1061-1067.
2.El-Khoury JM,Reineks EZ,Wang S.Progress of liquid chromatography-mass spectrometry in measurement of vitamin D metabolites and analogues[J].Clinical Bilchem, 2011,44(1):66.
3.Ginde AA,Liu MC,Camargo CA.Demographic differences and trends of vitaminD insufficiency in US population,1988-2004[J].Arch Inter Med,2009,169:626-632. 4.Holick MF.Vitamin D deficience[J].N Engl J Med, 2007,357(3):266-281.
5.Michel Vix,Keng-Hao Liu,Michele Dianna,et al.Impact of Roux-en-Y gastric bypass versus sleeve gastrectomy on vitamin D metabolism:short-term result from a prospective randomized clinical trail[J].Surg Endosc,2014,28:821-826.
6.Takeyama K,Kato S.The vitamin D3 1 alpha-hydroxylase gene and its regulation by active vitamin D3[J].Bioscience,Biotechnology,and Biochemistry,2011,75(2): 208-213.
7.李水军,王思合,周建烈,等.维生素D代谢及25-羟基维生素D测定方法研究进展[J].国际检验医学杂志, 2012,33(24):3028-3030.
8.Wacker M,Holick MF.Vitamin D:Effects on skeletal and extra skeletal health and the need for supplementation[J]. Nutrients,2013,5(1):111-148.
9.Richer SP,Pizzimenti JJ.The importance of vitamin D in systemic and ocular wellness[J].J Optom,2013,6:124-133.
10.Alwis G,Rosengren B,Nilsson JA,et al.Normative calcaneal quantitative ultrasound data as an estimation of skeletal development in Swedish children and adolescents [J].Calcif Tissue Int,2010,87:493-506.
11.Reddy PY,Harinarayan CV,Sachan A,et al.Bone disease in thyrotoxicosis[J].Indian J Med Res,2012,135:277-286.
12.Hewison M.Vitamin D and immune function:an overview [J].Proc Nutr Soc,2012,71:50-61.
13.Hewison M.An update on vitamin D and human immunity[J].Clin Endocrinol,2012,76:733-743.
14.Zhao H,Zhang H,Wu H,et al.Protective role of 1,25(OH)2titamin D3in the mucosal injury and epithelial barrier disruption in DSS-induce acute colitis in mice[J]. BMC Gastroenterol,2012,12:57.
15.Dickie LJ,Church LD,Coulthard LR,et al.Vitamin D down-regulates intracellular Toll-like receptor 9 expression and Toll-like receptor 9-induced IL-6 production in human monocytes[J].Rheumatology,2010,49(8):1466-1471.
16.Khoo A L,Chai LY,Koenen HJ,et al.1,25-dihydroxyvitamin D3 modulates cytokine production induced by Candida albicans:impact of seasonal variation of immune responses[J].Journal of Infectious Diseases,2011,203(1): 122-130.
17.朱莉,曲书强.维生素D与免疫应答相关性的研究进展[J].中国儿童保健杂志,2014,22(7):721-723.
18.Laura H,Taylor F.Vitamin D and GI cancers:shedding some light on dark diseases[J].Ann Transl Med,2014,2 (1):1-9.
19.Lohmann AE,Goodwin PJ.Hype versus hope:metformin and vitamin D as anticancer agents[J].Am Soc Clin Oncol Educ Book,2014:e69-74.
20.李绵,陈培战,李晓光,等.维生素D与癌症:研究现状和展望[J].生命科学,2013,25(2):218-230.
21.Kristin KD,Donald LT,Candace SJ.Vitamin D signalling pathways in cancer:potential for anticancer therapeutics[J]. Nat Rev Cancer,2007,7(9):684-700.
22.LarissaSilveiraLEIRO,MarianaSilvaMelendez-ARAúJO.Diet micronutrient adequacy of women after 1 year of gastric bypass.ABCD Arq Bras Cir Dig,2014,27 (1):21-25.
23.Hamoui N,Anthone U,Crookes PF.Calcium metabolism in the morbidly obese[J].Obes Surg,2004,(14):9-12.
24.帕纳拉斯,辛宁,赵志刚.肥胖手术后,我们需要关注维生素[J].糖尿病天地?临床刊,2010,4(3):120-123.
25.Moore CE,Sherman V.Vitamin D.Supplementation Efficacy:Sleeve astrectomy Versus Gastric Bypass Surgery[J]. Obes Surg,2014,24:2055-2060.
26.姜淮芜.胃癌消化道重建手术的应用与进展[J].四川肿瘤防治,2007,20(2):89-91.
(2014-11-20收稿)
作者投稿系统http∶//xb.lzmc.edu.cn/
R730
A
10.3969/j.issn.1000-2669.2015.02.026
罗金龙(1987-),男,硕士研究生,E-mail:royism@163.com

