消旋聚乳酸-左氧氟沙星骨植入缓释片抗感染的体外实验研究*
曹洪张磊钱炜肖庆芳邹海兵*
消旋聚乳酸-左氧氟沙星骨植入缓释片抗感染的体外实验研究*
曹洪张磊钱炜肖庆芳邹海兵*
目的 探讨消旋聚乳酸-左氧氟沙星骨植入缓释片体外抗骨感染效果。方法 应用溶剂混悬挥发法制备骨植入缓释片,观察其对金黄色葡萄球菌标准菌株(S.aureus ATCC 25923)、大肠埃希菌标准菌株(Escherichia coli ATCC 25922)、铜绿假单胞菌标准菌株(Pseudomonas aeruginosa ATCC 27853)的抑菌效果。结果消旋聚乳酸-左氧氟沙星骨植入缓释片在46天实验时间内对S.aureus ATCC25923、EscherichiacoliATCC25922、Pseudomonas aeruginosa ATCC 27853有良好的抑菌效果。结论消旋聚乳酸可作为药物缓释系统的一种可降解材料载体,为可降解材料治疗骨感染提供了新的思路。
消旋聚乳酸;左氧氟沙星;缓释;骨髓炎
化脓性骨髓炎(Suppurative osteomyelitis)是由化脓性细菌感染引起的病变,包括骨膜、骨密质、骨松质及骨髓组织的炎症。文献报道,根据创伤及其处理的不同,其发病率可达2%~15%[1,2]。由于骨组织血供差,加之死骨、死腔的形成,全身应用抗生素往往难以在局部形成有效抗菌浓度,且长时间静脉用药还会增加抗生素的全身毒、副作用[3]。因此,骨髓炎的抗生素治疗一直是棘手的问题。虽然庆大霉素-骨水泥珠链作为骨髓炎局部治疗的经典一直在沿用,但其亦有明显的缺点。例如药物释放完以后需二次手术拔链等[4]。为解决这一矛盾,人们研究、开发了一系列生物可降解材料来作为抗生素局部释放载体,以期避免上述缺点。消旋聚乳酸(Poly-D,L-lactide)就是其中研究、应用非常成熟的一个突出代表[5,6]。本课题组在前期工作中已经在体内实验证实其抗骨感染的有效性[7],本实验拟在体外实验证实其抗感染作用。
1 材料和方法
1.1 材料
消旋聚乳酸购自山东省医疗器械研究所(分子量80 kDa,=0.7),左氧氟沙星原料药由浙江新华制药有限公司能提供(国药准字H20094174)。金黄色葡萄球菌、大肠埃希菌和铜绿假单胞菌菌株由湖北医药学院附属人民医院检验科提供,分别为:S.aureusATCC25923、EscherichiacoliATCC25922、PseudomonasaeruginosaATCC27853。分光光度仪Nanodrop 2000c(Thermo Fisher Scientific,US)。
1.2 制备方法
按前期工作溶剂混悬挥发法制备消旋聚乳酸-左氧氟沙星骨植入缓释片[7,8]:将消旋聚乳酸剪碎,称取相应重量的消旋聚乳酸置四氢呋喃溶液中缓慢加热溶解,至完全溶解后按消旋聚乳酸:左氧氟沙星重量比3:1再加入相应重量的左氧氟沙星粉末,将二者的混合物充分研匀后放入烤箱中60℃加热1小时促四氢呋喃挥发,取出后常温下再放置8小时使残余的四氢呋喃完全挥发(注意使四氢呋喃充分挥发)。将完全干燥的混合物从容器上刮下,适当剪碎。称取混合物120mg(左含氧氟沙星30mg)加入预制的金属模具中,将模具连同其中的混合物置烤箱中90℃加热10分钟,取出模具置于压片机中300 kg压力下压模,取出模具放入乳胶手套中,再将乳胶手套置自来水中快速冷却,冷却后脱模,制成消旋聚乳酸-左氧氟沙星骨植入缓释片。塑料袋封装,60Co 25 KGy消毒备用。
1.3 体外释放实验
配制0.02%w/v、pH值为7.3的等渗磷酸盐缓冲液(Phosphate buffer solution,PBS),分别将不含消旋聚乳酸的左氧氟沙星粉末和消旋聚乳酸-左氧氟沙星骨植入缓释片置于PBS缓冲液中24小时,24小时后取样,在分光光度仪 Nanodrop2000c下,先激发左氧氟沙星粉末悬液,读取峰值,再读取消旋聚乳酸-左氧氟沙星骨植入缓释悬液的峰值。
1.4 体外抑菌实验
将制备好的消旋聚乳酸-左氧氟沙星骨植入缓释片9枚,每3枚为一组,分别置于接种有金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌的琼脂糖培养基中央(一个培养皿中只放置1枚药片),37℃培养24小时后测量抑菌圈大小。然后将药片转入新的培养基中每3天更换新的培养基并测量一次抑菌圈,如此重复至实验后46天。另取与含药药片同样大小、形状及共混比例的不含左氧氟沙星的消旋聚乳酸缓释片于上述各菌种培养基中做为空白对照。
2 结果
2.1 溶剂混悬挥发法制备骨植入缓释片的结果
加热条件下四氢呋喃能够将消旋聚乳酸充分溶解,随后加入的左氧氟沙星粉末也能溶于四氢呋喃。左氧氟沙星粉末在搅拌、研磨过程中可均匀地分散于消旋聚乳酸、四氢呋喃溶液中。随着四氢呋喃室温下的快速挥发,消旋聚乳酸-左氧氟沙星共混物呈贴附于容器壁上并逐渐干燥。共混材料在模具中加热至90℃后,两者间无分相现象发生。在300kg的压力下,模具中的消旋聚乳酸和左氧氟沙星共混材料相互紧密粘结,迅速冷却后顺利脱模,制成所需形状的圆形药片。药片淡黄色、表面光滑、质地均匀,质硬、有韧性,不易碎裂(图1),其直径为6mm,厚度为2.36mm。

图1 制备成的消旋聚乳酸-左氧氟沙星骨植入缓释片。图A,D消旋聚乳酸-左氧氟沙星骨植入缓释片正面观;图B消旋聚乳酸-左氧氟沙星骨植入缓释片侧面观;图C不含左氧氟沙星的聚乳酸缓释片正面观
2.2 体外释放实验结果
在分光光度仪Nanodrop2000c下,左氧氟沙星粉末悬液的最大吸收峰值为287nm,消旋聚乳酸-左氧氟沙星骨植入缓释悬液的最大吸收峰值也为287nm,见图2(彩图见插页)。
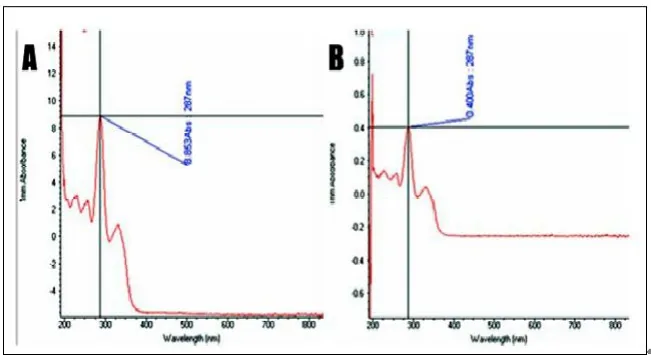
图2 消旋聚乳酸-左氧氟沙星骨植入缓释片体外释放实验。图A左氧氟沙星粉末在分光光度仪下最高吸光峰为287nm;图B消旋聚乳酸-左氧氟沙星骨植入缓释片在分光光度仪下最高吸光峰也为287nm
2.3 体外抑菌实验结果
消旋聚乳酸-左氧氟沙星骨植入缓释片在体外抑菌实验46天的时间范围内,分别对金黄色葡萄球菌、大肠埃希菌和铜绿假单胞菌产生了抑菌圈,对各菌抑菌圈的最大值都出现在抑菌实验的第一天,抑菌圈直径分别为(30.2±2.4)mm,(36.3±1.7)mm和(27.1±2.1)mm。不含氧氟沙星的片对上述各菌种均未形成抑菌圈。(图3彩图见插页)
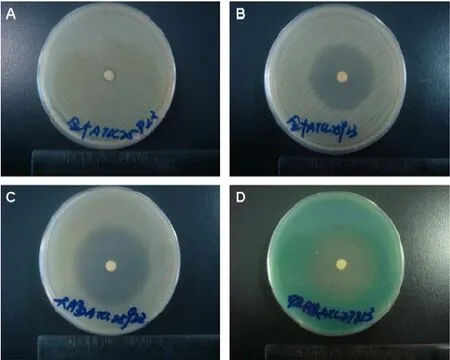
图3 消旋聚乳酸-左氧氟沙星骨植入缓释片体外抑菌实验。图A不含左氧氟沙星粉末的缓释片不形成抑菌圈;图B消旋聚乳酸-左氧氟沙星骨植入缓释片对S.aureus ATCC 25923产生了抑菌圈;图C消旋聚乳酸-左氧氟沙星骨植入缓释片对Escherichia coli ATCC 25922产生了抑菌圈;图D消旋聚乳酸-左氧氟沙星骨植入缓释片对Pseudomonas aeruginosa ATCC 27853产生了抑菌圈
3 讨论
常见的骨科非特异性感染包括骨髓炎和人工关节置换术后感染,时代的不同赋予了骨科感染不同的特点。据统计,闭合性骨折感染率为0~1%;开放性骨折感染率为0~11%[9],其中尤以开放性骨折、内固定失当、急性骨髓炎归转、低毒性细菌感染或来自炎性病灶细菌血源性播散等原因造成的非明显大块死骨形成的慢性骨感染在临床上较为常见。虽然手术技术不断创新,抗菌素不断更新换代,但是对其治疗仍没有满意的解决方案,因为软组织经过创伤和炎症的双重毁损,清创后很难满足足够的软组织覆盖以达到良好的血管化作用,全身使用抗菌素通过血源性播散无法有效到达感染的骨间室部位[10]。局部应用植入型抗生素缓释系统,具有在病变部位容易产生有效的抗生素治疗浓度、药物释放时间长、全身毒副作用小等优点,是目前较为理想的治疗骨感染的方法。抗生素骨水泥为目前临床应用最多的局部植入型抗生素释放系统[11],为非生物降解型[12]。上世纪年代应用于临床以来,对骨关节感染的治疗起到积极的作用,但随着其长期应用人们发现作为抗生素载体存在许多缺陷[13],如药物释放不完全不能降解吸收,需二次手术取出链珠等[14]。因此,人们致力于新的抗生素释药系统-可生物降解材料抗生素释药系统的研究,以期避免载体的缺点,更好地发挥局部抗生素释药系统的作用[15,16]。
消旋聚乳酸(Poly-D,L-lactide)是以乳酸为主要原料聚合得到的聚合物,可生物降解,已广泛用于骨科内固定和手术缝合线等,并有学者将其做为药物的载体[17]。引起慢性骨髓炎的常见病原菌为葡萄球菌类如金黄色葡萄球菌和革兰氏阴性杆菌类如大肠杆菌、铜绿假单胞菌,结合目前常用的局部释放抗生素包括氨基甙类、喹诺酮类和 内酰胺类[18],我们选用左氧氟沙星(levofloxacin)作为共混材料之一,左氧氟沙星是喹诺酮类抗菌药,具有广谱抗菌作用,抗菌作用强,其体外抗菌活性约为氧氟沙星的两倍。作用机制是通过抑制细菌DNA旋转酶的活性,阻止细菌DNA的合成和复制而导致细菌死亡,在临床抗感染治疗中表现出多方面的优越性,发挥了重要的作用。
体外释放实验中,左氧氟沙星粉末悬液的最大吸收峰值为287nm,消旋聚乳酸-左氧氟沙星骨植入缓释悬液的最大吸收峰值也为287nm,这说明消旋聚乳酸-左氧氟沙星骨植入缓释片能释放左氧氟沙星,仔细观察峰谱,除287nm外,没有多余峰谱,这也从另一方面证明消旋聚乳酸是一种良好的可降解生物材料,在降解过程中,不会产生其它异物。
金黄色葡萄球菌是化脓性骨髓炎的最常见致病菌。一般来说,对骨感染的治疗已被证实需要使用抗生素4~6周[19],本实验中,消旋聚乳酸-左氧氟沙星骨植入缓释片在体外抑菌实验46天的时间范围内,分别对金黄色葡萄球菌、大肠埃希菌和铜绿假单胞菌产生了抑菌圈,达到了连续给药4~6周的要求,并且适用范围广泛。后续实验中我们会进一步开展体内实验以验证其有效性。
总之,本实验证明消旋聚乳酸可作为药物缓释系统的一种可降解材料载体,消旋聚乳酸-左氧氟沙星骨植入缓释片在体外抑菌实验中表现出良好的抗感染效果,并且达到了连续给药4~6周的要求,这些为可降解材料治疗骨感染提供了新的思路。
[1] Browner BD.Skeletal trauma basic science,management,and reconstruction.In:Browner BD,ed.MDConsult(ed 4).Philadelphia,PA:Saunders/Elsevier,2009.
[2] Zhang X,Liu Y,Peng A,et al.Clinical efficacy and prognosis factors of open calcaneal fracture:a retrospective study[J].Int J Clin Exp Med.2015,(83):3841-3847.
[3] J.D Hayes,C.R Wolf.Mechanism of drug resistance[J].Biochem J, 1990,272:281-295.
[4] L Bunetel,A Segui,M Cormier,et al.Comparative study of gentamicin release from normal and low viscosity acrylic bone cement[J].Clin Pharmacokinet,1990,19(4):333-340.
[5] Takahashi M,Onishi H,Machida Y.Development of implant tablet for a week-long sustained release[J].J Controlled Release,2004, 100:63-64.
[6] Chen L,Wang H,Wang J,et al.Ofloxacin-delivery system of a polyanhydride andpolylactideblend used inthe treatmentof boneinfection[J].J Biomed Mater Res B Appl Biomater,2007,83(2):589-595.
[7] Pan ZX,Zhang HX,Wang YX et al.Effect of recombinant human bone morphogenetic protein 2/poly-lactide-co-glycolic acid(rh BMP-2/PLGA)withcoredecompression onrepair of rabbit femoral head necross[J].Asian Pac J Trop Med,2014,7(11):895-899.
[8] Cao H,Chen LB,Liu YS,et al.Poly-D,L-Lactide and Levofloxacin-Blended Beads:A sustained local releasing system to treat osteomyelitis[J].J Appl Polym Sci,2012,124(5):3678-3684.
[9] Giavaresi G,Borsari V,Fini M,et al.Preliminary investigations on a new gentamicin and vancomycin-coated PMMA nail for the treatment of bone and intramedullary infections:An experimental study in the rabbit[J].J Orthop Res,2008,26(6):785-792.
[10]Mendel V,Simanowski HJ,et al.Therapy with entamicin-PMMA beads,gentamicin-collagen sponge,and cefazolin for experimental osteomyelitis due to Staphylococcus aureus in rats[J].Arch Orthop Trauma Surg,2005,125(6):363-368.
[11]KlemmK.Gentamycin-PMMA-Beadsin treating boneandsofttissue infection[J].Excerpta Med Orthop,1980,25:182-184.
[12]Chang CC,Merritt K.Microbial adherence on polymthylmethacrylate(PMMA)surface[J].J Biomed Res,1992,26:197-207.
[13]Buchholz HW,Elson RA,Engebrecht E,et al.Management of deep of deep infection of total hip replacement[J].J Bone Joint Surg, 1981,63(B):342-353.
[14]Lin SS,Ueng,Liu SJ,et al.Development of biodegradable antibiotic delivery system[J].Clin Orthop,1999,362:240-250.
[15]Wang K,Jia Q,Han F,et al.Self-assembled l-alanine derivative organogel as in situ drug delivery implant:characterization,biodegradability,and biocompatibility[J].Drug Dev Ind Pharm,2010, 36(12):1511-1521.
[16]Li F,Wu W,Xiang L,et al.Sustained release of VH and rhBMP-2 from nanoporous magnesium-zinc-silicon xerogels for osteomyelitis treatment and bone repair[J].Int J Nanomedicine,2015,22(10): 4071-4080.
[17]Kanellakopoulou K,Giamarellos-Bourboulis EJ.Carrier system for the local delivery of antibiotics in bone infections[J].Drugs, 2000,59:1223-1232.
[18]Fung LK,Ewend M,Sills A,et al.Pharmacokinetics of in terstitial delivery of carmustine,4-hydroperoxycyclophosphamide and paclitaxel from a biodegradable polymer implant in the monkey brain [J].Cancer Res,1998,58(4):672-684.
[19]S S Sampath,K Garvin,D H Robinson.Preparation and characterisation of biodegradable poly(L-lactic acid)gen-tamicin delivery systems[J].Int J Pharm,1992,78:165-174.
Poly-D,L-Lactide and Levofloxacin-Blended beads to treat osteomyelitis in vitro
Objective This study described the biodegradable material poly-D,L-lactide could be used as a potential antibioticcarrier forlocal drugrelease.MethodsPoly-D,L-lactidewasfirst dissolvedintetrahydrofuranfollowedbyblending with levofloxacin in a physical way.The blend was then molded into beads.The beads with the best ratio were chosen forbacteriostasis intriplicate inoculatedwithS.aureusATCC 25923,Escherichia coli ATCC25922,Pseudomonas aeruginosa ATCC 27853 every 3 days until 46 days.Results In vitro tests of drug release and bacteriostasis demonstrated that the beads released high concentrations of antibiotic for the period of time(i.e.,46 days),which is needed to treat bone infection.Conclusion Poly-D,L-lactide as a drug carrier could be a potentially effective method for clinical local drug release,this study suggest that Poly-D,L-lactide as antibiotic beads for the sustained delivery system.All of these are desirable in a drug sustained delivery system for preventing or treating osteomyelitis.
Poly-D,L-lactide;Levofloxacin;Sustained delivery system;Osteomyelitis
R318;R683
A
10.3969/j.issn.1672-5972.2015.05.004
swgk2015-05-00104
曹洪(1982-)男,博士,副主任医师。研究方向:骨关节外科。
*[通迅作者]邹海兵(1970-)男,硕士,主任医师。研究方向:骨与关节损伤。
2015-05-22)
湖北省科学技术厅资助项目(2013CFC031);湖北省卫生计生科研基金资助项目(WJ2015Q042)
湖北医药学院附属人民医院骨关节外科,湖北十堰442000

