线粒体DNA单倍群对膝关节骨性关节炎发病率的影响
王 宇,柳云恩,刘欣伟,张玉彪,周大鹏,刘宪民,项良碧
1.沈阳军区总医院骨科,辽宁沈阳 110016;2.沈阳军区总医院 全军重症战创伤实验室,辽宁沈阳 110016
骨性关节炎(osteoarthritis,OA)是一种与年龄相关的退行性病变,其特征性病变是由软骨细胞功能失调导致的关节软骨退变。OA的危险因素包括性别、职业、吸烟史以及细胞核遗传背景,如软骨基质蛋白、聚蛋白多糖酶-2以及缓激肽B2在基因编码中的突变[1-2]。线粒体在OA的病变中起到一定作用,线粒体 DNA(mitochondrial DNA,mtDNA)对OA的影响可能因人种及环境因素的差异而不同。本文选取沈阳军区总医院的187例膝关节OA患者,对膝关节OA与mtDNA的相关性进行研究,评估mtDNA单倍群对OA发病率的影响及其潜在的作用机制。现报告如下。
1 资料与方法
1.1 临床材料 收集2012年1月至2014年1月就诊于我院的187例膝关节OA患者作为研究组。其中,女性135例,男性52例,年龄43~86岁,平均年龄(61.59±6.28)岁。纳入标准:根据美国风湿协会(ACR)标准[3]诊断为膝关节 OA,且根据患者膝关节影像学检查,按照Kellgren-Lawrence(K-L)评分[4]OA的病变度为2级或以上者。将研究组按照K-L评分分值分为2级组42例,3级组66例和4级组79例。对照组患者420例,其中女性237例,男性183例,年龄27~84岁,平均年龄(55.32 ±8.98)岁。对照组为尚未达到膝关节OA诊断标准且无其他已知的退行性病变(包括癌症、糖尿病和高血压可能与线粒体突变有关的疾病)患者。相关知情同意书中所有条目均经我院伦理委员会批准。
1.2 mtDNA测序和拷贝数的测量 采集患者血液样本并采用十二烷基磺酸钠(SDS)裂解法从外周血获取基因组DNA。本研究设计2组配套引物以增强mtDNA碎片的作用,这些碎片中包含有亚洲人群mtDNA单倍群中具有诊断意义的单核苷酸多态性(single nucleotide polymorphisms,SNPs)。这些引物的测序结果如下:L15975F:5'-CTCCACCATTAGCACCCAAAGC-3',H794R:5'-AGGCTAAGCGTTTTGAGCT'G-3',L9967F:5'-TCTCCATCTATTGATGAGGGTCT-3',H10858R:5'-AATTAGGCTGTGGGTGGTTG-3'。另一引物的测序结果为:299F:GGTGGAAATTTTTTGTTATG,用来测量mt16184~mt16193多聚胞苷酸间隔的序列。聚合酶链锁反应(PCR)扩增仪(北京索来宝生物科技有限公司)。使用步骤:95℃预变性5 min,94℃变性30 s,退火后57℃延伸30 s,72℃延伸40 s,35个循环,循环结束72℃延伸4 min。mtDNA与核DNA的比值代表mtDNA拷贝数的相对量。实时PCR采用Real-Time PCR系统(美国应用生物系统公司);试剂盒为SYBR®Green qPCR Mastermix(日本宝生物公司)。
1.3 统计学方法 采用SPSS 13.0统计学软件进行分析。单倍群或SNPs与OA发病率的关系采用χ2检验,单倍群、性别和年龄对OA的影响采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 年龄和性别对OA发病率的影响 研究组中女性比例(72.19%)明显高于对照组中女性比例(56.43%,OR=0.497,95%CI=0.342 ~0.722,P<0.01),同时均明显高于各组中男性。进行Logistic回归分析并排除年龄的影响后,其结果差异有统计学意义(OR=0.537,95%CI=0.362 ~0.796,P<0.05)。K-L评分为3级组的年龄分布(平均61.60岁)和K-L评分为4级组的年龄分布(平均63.60岁)差异无统计学意义,且以上2组患者年龄明显高于K-L评分为2级组中患者年龄(平均56.77岁),但2级组和3级组患者中年龄差异无统计学意义,2级组和4级组患者中年龄差异有统计学意义(P<0.05)。年龄和OA的病变有密切的关系。
2.2 mtDNA单倍群分析 OA患者中单倍群G出现频率明显高于对照组(OR=3.084,95%CI=1.055~9.017,P<0.05)。排除年龄和性别的影响,OA和单倍群仍有明显相关性(OR=3.834,95%CI=1.139~12.908,P<0.05)。然而,OA 患者中单倍群R出现频率明显低于对照组出现频率(OR=0.687,95%CI=0.473 ~0.998,P<0.05)。单倍群R的效应是通过单倍群F1a和单倍群B产生,而亚群B4则属于单倍群B4的分支。在排除年龄和性别的影响后,仅单倍群B(OR=0.503,95%CI=0.283~0.893,P<0.05)和亚群 B4(OR=0.483,95%CI=0.245~0.954,P<0.05)在 OA患者中出现频率明显降低。结果显示,单倍群B和B4是OA的保护因素。未见其他mtDNA单倍群或亚群与OA有相关性。见表1。

表1 mtDNA单倍群对膝关节OA的影响
2.3 SNPs分析 对OA患者中个体的SNPs进行分析后发现,SNP位点T16140C和T16217C在OA患者中更少表达,SNP位点T16140C和T16217C决定单倍群B和B4的表达。在Logistic回归分析中,排除年龄和性别对数据的影响,SNP位点T16140C(OR=0.370,95%CI=0.142 ~0.958,P<0.05)和T16217C(OR=0.493,95%CI=0.249 ~ 0.977,P<0.05)比较差异有统计学意义。对其他线粒体单核苷酸多态性(mtSNPs)进行分析,排除年龄和性别的影响,发现SNP位点T16362C的存在能够增强OA的发病率(OR=1.715,95%CI=1.174~2.506,P<0.05)。见表2。
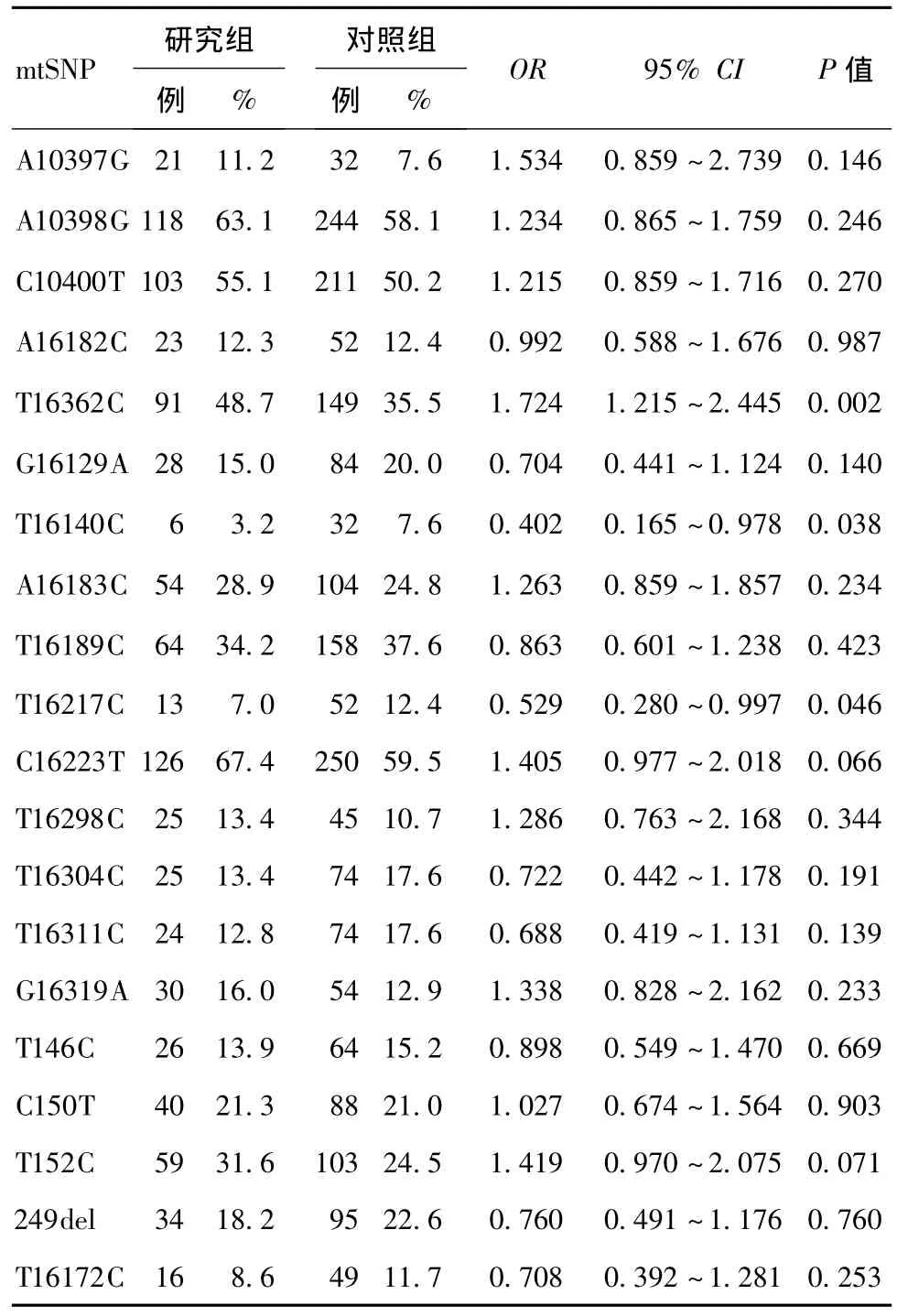
表2 线粒体DNA SNPs对膝关节OA的作用
2.4 线粒体DNA单倍群亚群分析 结果显示,在病情较重的组别(K-L评分分值为4级),单倍群G的出现频率明显增高(OR=10.870,95%CI=1.307~90.909,P<0.05)。对于单倍群 B(OR=0.812,95%CI=0.304~2.169,P=0.677)和亚群B4(OR=0.880,95%CI=0.277 ~2.801,P=0.829),2 者比较,差异无统计学意义。此外,虽然单倍群D4及其亚群D4a、单倍群N9及其亚群N9a对OA既非危险因素也非保护因素,但携带有单倍群D4或D4a的患者OA病情病变更严重,而携带有单倍群N9或N9a的患者OA病情病变较轻微。见表3。
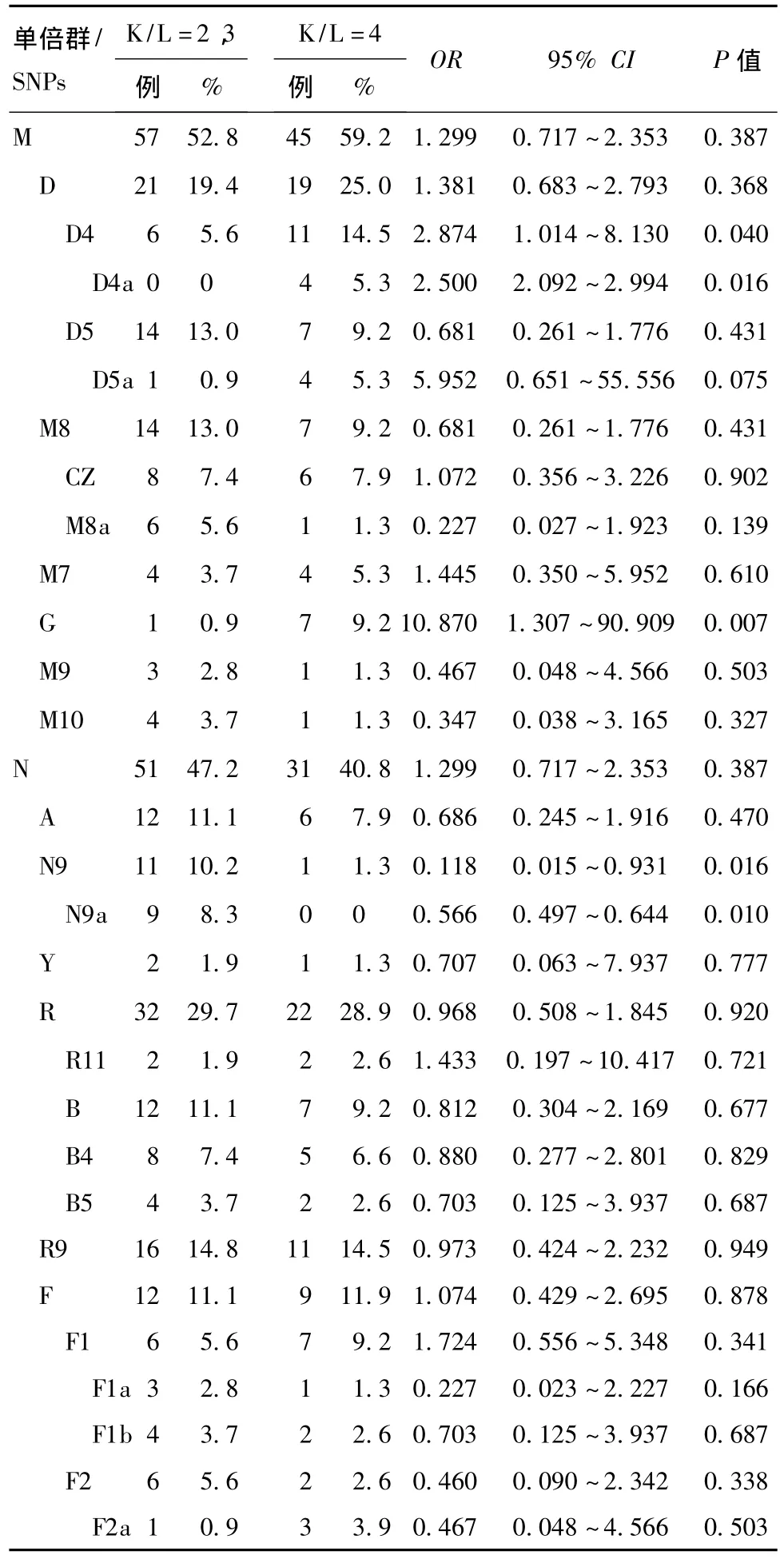
表3 mtDNA单倍群对OA患者K-L评分4级组的病变影响
2.5 mtSNPs位点分析 虽然mtDNA SNPs和OA的病情严重性之间的联系尚不明确,但mtDNA SNP位点T16362C有加重病情的倾向。见表4。
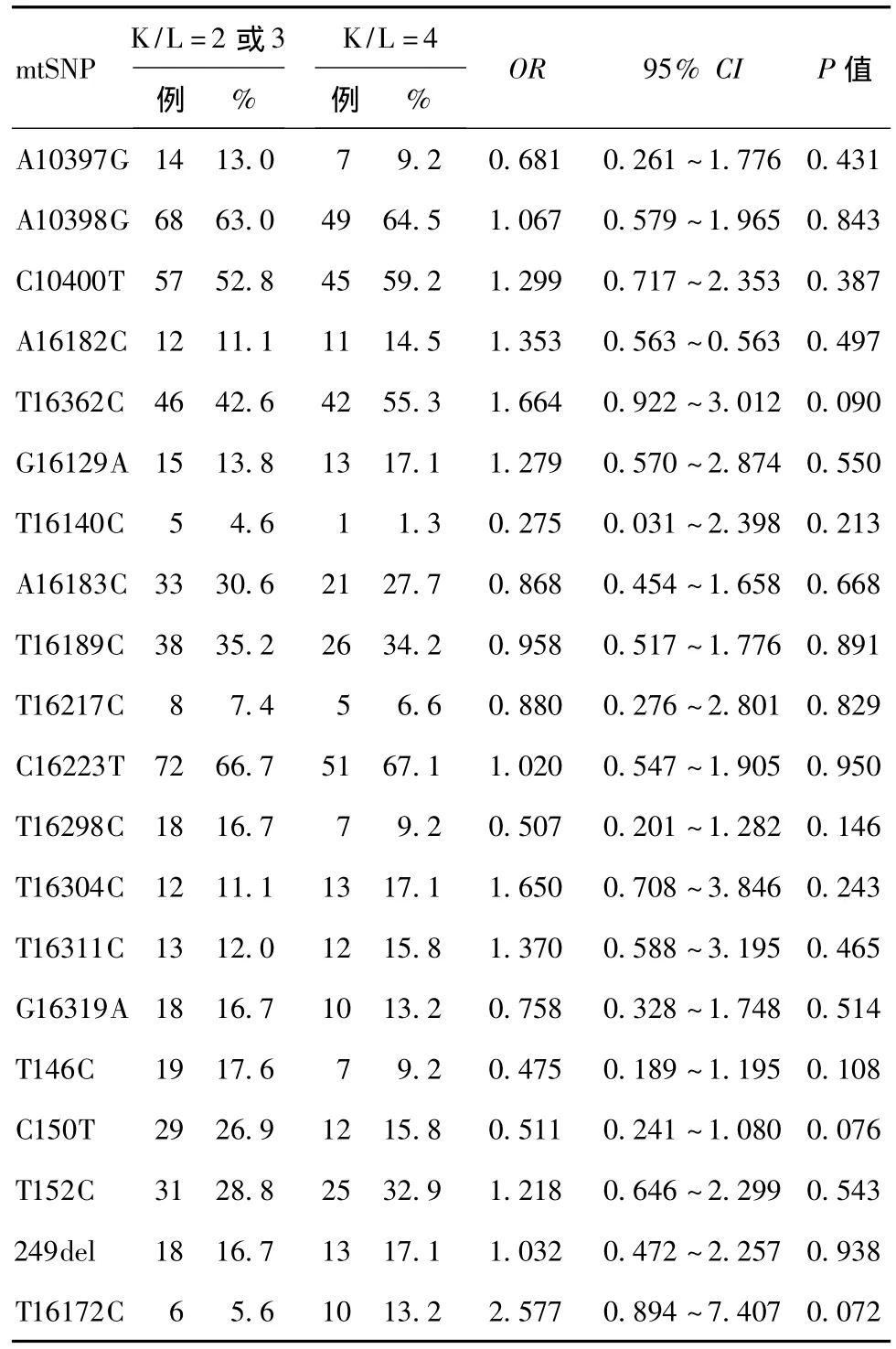
表4 mtSNPs对OA患者K-L评分4级组的病变影响
3 讨论
软骨细胞是软骨中唯一存在的细胞类型,并且其变性是OA发生的主要原因之一。最新研究表明,线粒体在OA的病变中起到一定作用[5]。人类线粒体包括超过1 000种蛋白质,其中的13种由mtDNA编码。mtDNA突变导致的疾病已有诸多报道[6]。mtDNA突变往往发生在特定的位点,而非漫长的人类进化中,认为其原因是由于线粒体遗传位点的多样性[7]。特定的mtDNA单倍群或者单倍型代表着一组SNPs,两者在遗传学和统计学上具有相关性。许多独立的研究表明,mtDNA的遗传变异性能够改变线粒体功能,如钙动力学、呼吸复合体运动与mtDNA的转录和翻译[8-9]。尤其许多病例对照研究表明,mtDNA与许多复杂疾病,如代谢综合征[10-11]、神经退行性疾病[12-13]、传染性疾病[14-15]、癌症[16-17]和衰老[18]等相关。
中国OA的发病率与欧洲的发病率相当[19]。在中国,城市老年人口中患有膝关节OA的患者数约占总人口的13%,高于农村地区的患病率[20–21]。最新研究表明,mtDNA单倍群在西班牙裔人群的髋、膝关节OA发病率中起到一定作用,但与OA相关的单倍群J仅在欧洲人群中发现,而中国人群中mtDNA 单倍群主要为 A、B、CZ、D、M7、M8 和 F,单倍群F和B在中国人群中更常见[22]。
作为最常见的关节炎,膝OA导致的疼痛及活动受限给患者生活带来极大不便。患病的危险因素主要来自遗传和环境[23]。本研究结果与OA流行病学研究结果一致[24]。本研究发现,女性比男性更易患OA。此外,随着年龄增加,OA的病情愈发加重,进一步证实OA是一种与年龄相关的退行性疾病。
病例对照研究表明,在西班牙裔人群中,单倍群J对髋关节OA和膝关节OA均有保护作用[25]。值得注意的是,单倍体J能够延缓膝关节OA病变的进展[26]。然而,mtDNA对OA的影响可能因人种以及环境因素的差异而不同。本研究表明,单倍群G和mtSNPs位点T16362C增加OA的风险,而单倍群B和mtSNPs位点 T16140C、T16217C能够降低OA的易感性。
本研究发现,携带有单倍群G的患者其病情病变更为严重。由于线粒体突变是与年龄相关的退行性疾病(如OA)发病的主要原因之一[6]。由此认为OA患者上调了mtDNA的拷贝数作为线粒体突变的代偿性机制。以往研究表明,单倍群G能够增加mtDNA缺失的发生率和线粒体活性氧的产生。因此,认为其能够增加肺癌的风险[27]。而在本研究中,OA患者的外周血(含有单倍群G)中未发现这种代偿机制,这表明其他含有mtDNA单倍群的细胞(如软骨细胞)由于氧化应激的缘故更容易受到损伤。mtDNA SNP位点16140C对软骨细胞的保护性作用是通过上调mtDNA拷贝数来加强线粒体功能,从而免遭氧化应激诱导的损伤以及细胞凋亡。有相关报道认为,mtDNA单倍群B和B4在胆道闭锁及口腔扁平苔藓的发生中作为保护因素[28]。本研究发现,mtDNA单倍群B和B4对OA的发生具有保护性作用。进一步的线粒体功能性研究证实,单倍体B和B4能够增加线粒体膜电位和mtDNA拷贝数,因此降低活性氧的水平和应激下细胞凋亡的数目,保护软骨细胞[29]。所有这些交互作用均支持单倍群B和B4对软骨细胞具有保护作用的观点。同时,以往的研究和本研究均证实,DNA单倍群B、B4和单倍群J(均为R的分支)对中国人群及西班牙人群分别具有保护作用,但是R的其他分支R9和R11并无类似作用[30]。由此表明,是单倍群R分支各自不同的mtDNA变异而不是来自单倍群R分支共有的mtDNA突变决定单倍群B、B4和单倍群J对OA的保护性作用。
在本研究中,SNP位点T16362C是唯一与单倍群不相关却能够增加OA风险的mtSNPs。T16362C与G11778A的联合作用分别与波兰的乳腺癌以及日本老年人的莱伯遗传性视神经病发生相关[31-32]。虽然目前还没有进一步的功能性研究涉及T16362C,但是以往研究和本研究认为,T16362C是人类退行性病变的危险因素[33]。为了进一步明确结论,需更大样本量研究来证实mtDNA单倍群对OA的作用。
本研究认为,单倍体G和T16362C是OA发生的危险因素,而单倍体B及其次级产物单倍体B4与其诊断性线粒体SNPs位点T16140C、T16217C是OA发生的保护因素。本研究发现,mtDNA拷贝数在OA患者中调高,mtDNA的遗传背景通过上调OA患者中mtDNA拷贝数进而影响OA的发病率。为了解mtDNA遗传背景在OA发生及病变中的作用,仍需进一步研究。
[1]Glasson SS,Askew R,Sheppard B,et al.Deletion of active ADAMTS5 prevents cartilage degradation in a murine model of osteoarthritis[J].Nature,2005,434(7033):644-648.
[2]Chen S,Zhou Y,Li J,et al.The effect of bradykinin B2 receptor polymorphisms on the susceptibility and severity of osteoarthritis in a Chinese cohort[J].JBiomed Biotechnol,2012,2012:597637.
[3]Hochberg MC,Altman RD,Brandt KD,et al.Guidelines for the medical management of osteoarthritis.PartⅡ.Osteoarthritis of the knee.American College of Rheumatology[J].Arthritis Rheum,1995,38(11):1541-1546.
[4]Kellgren JH,Lawrence JS.Radiological assessment of osteo-arthrosis[J].Ann Rheum Dis,1957,16(4):494-502.
[5]Blanco FJ,Rego I,Ruiz-Romero C.The role of mitochondria in osteoarthritis[J].Nat Rev Rheumatol,2011,7(3):161-169.
[6]Blanco FJ,López-Armada MJ,Maneiro E.Mitochondrial dysfunction in osteoarthritis[J].Mitochondrion,2004,4(5-6):715-728.
[7]Lin CS,Sharpley MS,Fan W,et al.Mouse mtDNA mutant model of Leber hereditary optic neuropathy[J].Proc Natl Acad Sci USA,2012,109(49):20065-20070.
[8]Wallace DC.A mitochondrial paradigm of metabolic and degener-ative diseases,aging,and cancer:a dawn for evolutionary medicine[J].Annu Rev Genet,2005,39():359-407.
[9]Suissa S,Wang Z,Poole J,et al.Ancient mtDNA genetic variants modulate mtDNA transcription and replication[J].PLoS Genet,2009,5(5):e1000474.
[10]Kazuno AA,Munakata K,Nagai T,et al.Identification of mitochondrial DNA polymorphisms that alter mitochondrial matrix pH and intracellular calcium dynamics[J].PLoS Genet,2006,2(8):e128.
[11]Fuku N,Park KS,Yamada Y,et al.Mitochondrial haplogroup N9a confers resistance against type 2 diabetes in Asians[J].Am J Hum Genet,2007,80(3):407-415.
[12]Tanaka N,Goto Y,Akanuma J,et al.Mitochondrial DNA variants in a Japanese population of patients with Alzheimer's disease[J].Mitochondrion,2010,10(1):32-37.
[13]Hendrickson SL,Hutcheson HB,Ruiz-Pesini E,et al.Mitochondrial DNA haplogroups influence AIDS progression[J].AIDS,2008,22(18):2429-2439.
[14]Fang H,Shen L,Chen T,et al.Cancer type-specific modulation of mitochondrial haplogroups in breast,colorectal and thyroid cancer[J].BMC Cancer,2010,10():421.
[15]Yao YG,Kong QP,Zhang YP.Mitochondrial DNA 5178A polymorphism and longevity[J].Hum Genet,2002,111(4-5):462-463.
[16]Zeng QY,Chen R,Darmawan J,et al.Rheumatic diseases in China[J].Arthritis Res Ther,2008,10(1):R17.
[17]Du H,Chen SL,Bao CD,et al.Prevalence and risk factors of knee osteoarthritis in Huang-Pu District,Shanghai,China[J].Rheumatol Int,2005,25(8):585-590.
[18]Kang X,Fransen M,Zhang Y,et al.The high prevalence of knee osteoarthritis in a rural Chinese population:the Wuchuan osteoarthritis study[J].Arthritis Rheum,2009,61(5):641-647.
[19]Cross M,Smith E,Hoy D,et al.The global burden of hip and knee osteoarthritis:estimates from the global burden of disease 2010 study[J].Ann Rheum Dis,2014,73(7):1323-1330.
[20]Yao YG,Kong QP,Bandelt HJ,et al.Phylogeographic differentiation of mitochondrial DNA in Han Chinese[J].Am J Hum Genet,2002,70(3):635-651.
[21]Neogi T.The epidemiology and impact of pain in osteoarthritis[J].Osteoarthritis Cartilage,2013,21(9):1145-1153.
[22]Cushnaghan J,Dieppe P.Study of 500 patients with limb joint osteoarthritis.I.Analysis by age,sex,and distribution of symptomatic joint sites[J].Ann Rheum Dis,1991,50(1):8-13.
[23]Rego I,Fernández-Moreno M,Fernández-López C,et al.Role of European mitochondrial DNA haplogroups in the prevalence of hip osteoarthritis in Galicia,Northern Spain[J].Ann Rheum Dis,2010,69(1):210-213.
[24]Rego-Pérez I,Fernández-Moreno M,Fernández-López C,et al.Mitochondrial DNA haplogroups:role in the prevalence and severity of knee osteoarthritis[J].Arthritis Rheum,2008,58(8):2387-2396.
[25]Zheng S,Qian P,Li F,et al.Association of mitochondrial DNA variations with lung cancer risk in a Han Chinese population from southwestern China[J].PLoS One,2012,7(2):e31322.
[26]Wu D,Cheng S,Chen X,et al.Mitochondrial haplogroup B4 may be a protective factor to oral lichen planus susceptibility in Chinese[J].Oral Dis,2014,20(1):62-68.
[27]Tiao MM,Liou CW,Huang LT,et al.Associations of mitochondrial haplogroups b4 and e with biliary atresia and differential susceptibility to hydrophobic bile Acid[J].PLoS Genet,2013,9(8):e1003696.
[28]He W,Newman JC,Wang MZ,et al.Mitochondrial sirtuins:regulators of protein acylation and metabolism[J].Trends Endocrinol Metab,2012,23(9):467-476.
[29]Czarnecka AM,Krawczyk T,Plak K,et al.Mitochondrial genotype and breast cancer predisposition[J].Oncol Rep,2010,24(6):1521-1534.
[30]Isashiki Y,Sonoda S,Izumo S,et al.Phylogenetic assessment of the mitochondrial DNA displacement loop haplotype in Japanese patients with Leber's hereditary optic neuropathy harboring the mitochondrial DNA G11778A mutation[J].Ophthalmic Res,2003,35(4):224-231.
[31]Kong QP,Bandelt HJ,Sun C,et al.Updating the East Asian mtDNA phylogeny:a prerequisite for the identification of pathogenic mutations[J].Hum Mol Genet,2006,15(13):2076-2086.
[32]Eaton JS,Lin ZP,Sartorelli AC,et al.Ataxia-telangiectasia mutated kinase regulates ribonucleotide reductase and mitochondrial homeostasis[J].J Clin Invest,2007,117(9):2723-2734.
[33]Sambrook J,Russell DW.Molecular Cloning:A Laboratory Manual[M].New York:Cold Spring Harbor Laboratory Press,2001:1530-1531.

