沉淀剂对浆态床合成甲醇铜基催化剂性能的影响
王海龙,马凤云*,莫文龙,王 晔,李 忠,肖 艳
(1.新疆大学化学化工学院,煤炭洁净转化与化工过程自治区重点实验室,新疆 乌鲁木齐 830046;2.太原理工大学煤化工研究所,煤科学与技术教育部和山西省重点实验室,山西 太原 030024)
沉淀剂对浆态床合成甲醇铜基催化剂性能的影响
王海龙1,马凤云1*,莫文龙1,王 晔1,李 忠2,肖 艳1
(1.新疆大学化学化工学院,煤炭洁净转化与化工过程自治区重点实验室,新疆 乌鲁木齐 830046;2.太原理工大学煤化工研究所,煤科学与技术教育部和山西省重点实验室,山西 太原 030024)
采用并流共沉淀法,分别以Na2CO3、CO(NH2)2、NaHCO3、C2H7NO和NaOH为沉淀剂,制备了5种CuO/ZnO/Al2O3浆态床合成甲醇催化剂,考察沉淀剂对催化剂前驱体物相组成及催化性能的影响。研究表明,含CO32-沉淀剂所制备的催化剂前驱体中的(Cu,Zn)2CO3(OH)2和(Cu,Zn)5(CO3)2(OH)6为活性组分,且前者较易形成,两者焙烧后形成CuO-ZnO固溶体,铜锌间协同作用强,催化剂活性高。而含OH-沉淀剂制备的催化剂CuO和ZnO间分散性差,催化剂活性差。催化剂性能评价结果表明,以Na2CO3为沉淀剂制备催化剂前驱体中 (Cu,Zn)2CO3(OH)2和(Cu,Zn)5(CO3)2(OH)6物相含量最高,其催化性能最好:CO转化率和甲醇时空收率分别为40.45%和256.8g·kg-1·h-1,失活率为0.77%/d。
甲醇合成;铜基催化剂;制备;沉淀剂;浆态床
煤基浆态床合成甲醇是当前煤高效清洁转化最具发展潜力的途径之一。但若将固定床催化剂直接应用于浆态床,易粉化,寿命短,阻碍了浆态床合成甲醇技术的工业化应用。因此,开发适用于浆态床反应器的合成甲醇催化剂迫在眉睫[1-6]。
目前,沉淀法为制备铜基催化剂最常用的方法[7,8],由于沉淀剂对沉淀法所制备的催化剂晶粒粒径、粒度和活性组分分散度均有显著影响,故而国内外诸多学者对其进行了相关研究,并取得了一定成果。王文亮等[9]以Cu(NO3)2为原料,分别以NH4HCO3、NH3·H2O、NaOH、NaOH与Na2CO3的混合液为沉淀剂,制备CuO超细粉体,结果表明,沉淀剂对粉体的粒径、形貌、催化活性和氧化能力均有显著影响。许多研究表明[10-13],催化剂前驱体的物相组成对催化剂活性和稳定性具有重要影响,而沉淀剂对催化剂前驱体物相组成有较大影响,在碱式碳酸盐催化剂前驱体中,单斜晶系锌孔雀石 (Cu,Zn)2CO3(OH)2和斜方晶系绿铜锌矿(Cu,Zn)5(CO3)2(OH)6是高活性物相,其经热分解后,能形成原子水平结合态的CuO-ZnO固熔体。因此,本文主要研究了不同沉淀剂对铜基催化剂前驱体物相组成和含量及其催化合成甲醇性能的影响。
1 实验部分
1.1 试剂与仪器
分析纯Cu(NO3)2·3H2O、Zn(NO3)2·6H2O、Al(NO3)3·9H2O、Na2CO3、NaHCO3、尿素、乙醇胺,NaOH和液体石蜡均由天津市盛奥化学试剂有限公司提供;试验用水为去离子水,H2、N2、CO和 CO2纯度均为99.99%。实验所用WHF-0.5型高压釜由大连通达反应釜有限公司提供。
1.2 催化剂的制备
采用并流共沉淀法制备CuO/ZnO/Al2O3催化剂。首先,配制浓度为1mol/L的Na2CO3、CO(NH2)2、NaHCO3、C2H7NO和NaOH溶液,分别与总浓度为1mol/L,nCu∶nZn∶nAl=4.5∶4.5∶1的Cu(NO3)2/Zn(NO3)2/ Al(NO3)3混合溶液在70℃水浴加热条件下并流加入到1000mL烧杯中进行沉淀反应,并调节沉淀剂溶液的流速以保证沉淀母液pH=7~8。其中,尿素溶液要在配制好后,室温静置7天,将其升温至70℃以促进其水解反应的发生,待溶液pH达到8时,开始沉淀反应。其次,沉淀结束,在微波辐射反应器中80℃老化1h后,将沉淀液抽滤,洗涤,以除去滤饼中Na+、NO3-等,然后110℃干燥12h,350℃焙烧6h,筛分取粒度≤80目样品备用。将Na2CO3、CO(NH2)2、NaHCO3、C2H7NO和NaOH作为沉淀剂制备的催化剂前驱体和催化剂分别表示为 P-Na2CO3,P-CO(NH2)2,PNaHCO3,P-C2H7NO,P-NaOH和C-Na2CO3,C-CO(NH2)2,C-NaHCO3,C-C2H7NO,C-NaOH。
1.3 催化剂的表征
X-射线衍射(XRD)表征:采用日本Rigaku D/ max2500型 X射线衍射仪,Cu靶 Kα射线 (λ= 1.54056×10-10m),Ni滤波,扫描速度8°/min,石墨单色管,管电压和管电流分别为40kV和100mA,步长0.01°,扫描范围5°~85°,闪烁计数器记录强度。
热重分析(TG-DTG):所用仪器为美国TA仪器公司SDTQ-600型热分析仪。操作条件:样品质量5mg,N2流速50ml/min,升温速率为8℃/min。
X-射线能谱分析(EDS):所用仪器为英国牛津仪器有限公司生产的2000型X射线能谱仪,加速电压20kV,工作距离15mm,采集时间120s。
FT-IR分析:所用仪器为Nicolet Nexus FTIR,选用MCT检测器,扫描范围为400cm-1~4000cm-1,扫描次数64次,分辨率4cm-1,样品与KBr混合压片制得。
1.4 催化剂的活性评价
采用自制500mL浆态床高压反应装置进行催化剂的活性评价。将5g催化剂和250mL液体石蜡加入到500mL高压釜中,在H2与N2体积比为1∶9的气氛下 270℃还原 6h,切换为体积比 n(CO2)∶n(H2)∶n(CO)=0.21∶2.6∶1的原料气,在240℃、4.0MPa和气体质量空速1620L/(Kgcat·h)反应条件下进行活性测试。反应产物冷凝分离后,采用GC7800气相色谱(北京东西分析仪器有限公司)分析气相组成,TCD检测器,DX201柱。
2 结果与讨论
2.1 前驱体的XRD表征
图1为5种催化剂前驱体的 XRD谱图。PNa2CO3、P-CO(NH2)2和P-NaHCO3在2θ=18.9°、24.1°和35.9°处出现了Cu2CO3(OH)2(No.JCPDS41-1390)的特征衍射峰,2θ=18.9°、24.1°、35.9°、38.5°和42.1°处出现了(Cu,Zn)2CO3(OH)2(No.JCPDS36-1475)的特征衍射峰,两者在2θ=18.9°和24.1°处的特征衍射峰发生重叠,这意味着Zn2+进入到Cu2CO3(OH)2晶相中,取代Cu2+生成了(Cu,Zn)2CO3(OH)2物相。
在 2θ=13.1°、29.8°和 32.9°处 出 现 了Zn5(CO3)2(OH)6(No.JCPDS19-1458)的特征衍射峰,其中在 2θ=13.1°和 32.9°处与(Zn,Cu)5(CO3)2(OH)6(No. JCPDS17-0743)的特征衍射峰(2θ=13.1°、24.1°和32.9°处)重叠,可知Cu2+进入Zn5(CO3)2(OH)6的晶相中,取代Zn2+形成了(Zn,Cu)5(CO3)2(OH)6物相。P-CO(NH2)2和P-NaHCO3除了存在上述物相,在2θ=39.7°、47.0°和56.3°处,还出现了Cu(OH)2(No.JCPDS35-0505)的特征衍射峰;在2θ=31.8°和36.3°处出现了ZnO(No. JCPDS36-1451)的特征衍射峰。出现这种现象的原因可能是CO(NH2)2与NaHCO3水溶液呈弱碱性,它们的水解速度较Na2CO3慢得多,因而溶液中的CO32-离子浓度相对较低,从而无法与Cu2+和Zn2+离子充分反应,导致Cu2+和Zn2+只能与OH-结合,生成Cu(OH)2和Zn(OH)2,而Zn(OH)2在干燥时受热分解为ZnO。

图1 不同催化剂前驱体XRD谱图
从图1还可看出,与P-CO(NH2)2和P-NaHCO3相比,P-Na2CO3中的各物相的特征衍射峰均非常弥散,这说明Cu2+和Zn2+同晶取代形成的(Zn,Cu)5(CO3)2(OH)6和(Cu,Zn)2CO3(OH)2晶体发育并不完善,处于亚稳态。
对于P-C2H7NO和P-NaOH,因沉淀剂中没有CO32+,不可能存在碱式碳酸盐,两种前驱体在图1中均未发现碱式碳酸盐的特征衍射峰,而在2θ= 16.7°、23.8°、39.7°、47.0°和54.3°处出现了Cu(OH)2的特征衍射峰,在 2θ=31.8°、34.4°、36.3°、47.5°、56.6°,62.9°和67.9°处出现了ZnO的特征衍射峰,其中P-NaOH中Cu(OH)2和ZnO的特征衍射峰非常尖锐,晶型发育完全。
在 5种催化剂前驱体的 XRD衍射峰中,P-Na2CO3的特征衍射峰比较弥散,P-CO(NH2)2和P-NaHCO3的峰形类似,这三组试样的组成成分中均存在(Zn,Cu)5(CO3)2(OH)6和(Cu,Zn)2CO3(OH)2物相,焙烧后,有利于形成CuO-ZnO固溶体。P-C2H7NO和P-NaOH只存在ZnO和Cu(OH)2,且结晶度较大,铜锌组分分散不均匀。
2.2 催化剂的XRD表征
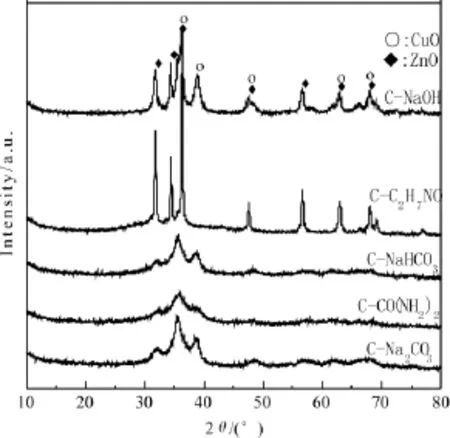
图2 焙烧后的XRD谱图
图2给出了5个催化剂的XRD谱图。由图可知,C-Na2CO3,C-CO(NH2)2和C-NaHCO3在2θ=36.3°, 38.7°和47.5°等处出现了CuO(No.JCPDS48-1548)的特征衍射峰,在2θ=31.8°,36.3°和47.5°等处出现了ZnO(No.JCPDS36-1451)的特征衍射峰。在2θ=36.3°和47.5°处CuO和ZnO的特征衍射峰重叠,且峰形弥散,结晶度小,表明在焙烧过程形成了分散均匀的CuO-ZnO固溶体,从而增强了铜锌间的协调作用[10,14],有利于提高催化剂的活性。
除了上述催化剂试样的CuO和ZnO的XRD特征衍射峰位置外,C-C2H7NO和C-NaOH在2θ= 34.4°处还出现了ZnO的特征衍射峰,并在2θ= 36.3°,47.5°,62.9°和67.9°处与CuO的特征衍射峰重叠,但峰形尖锐,表明在焙烧过程中生成了CuOZnO固溶体,但结晶度较大,分散性不好,铜锌间协同作用受到抑制。对比图1和图2可发现,前驱体中含 Cu2CO3(OH)2、Zn5(CO3)2(OH)6、(Cu,Zn)2CO3(OH)2和(Zn,Cu)5(CO3)2(OH)6物相时,焙烧后所生成的CuO和ZnO的衍射峰均较为弥散,表明碱式碳酸盐类前驱体经焙烧分解生成的CuO和ZnO结晶度小,分散更均匀。C-C2H7NO和C-NaOH的XRD谱图的衍射峰非常尖锐,晶体结晶度大,对于结晶发育完全的晶体,粒径较大,在焙烧阶段脱水、脱酸之后,所形成的CuO和ZnO颗粒易团聚。以上5种催化剂在XRD检测中未发现Al2O3的衍射峰,说明其以无定型态的形式存在[15]。
2.3 前驱体的FT-IR表征
各试样前驱体的红外吸收光谱如图3所示。
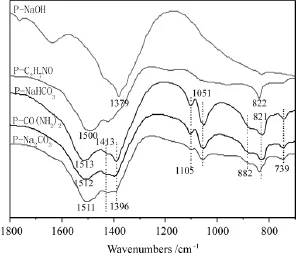
图3 不同沉淀剂制备的催化剂前驱体的红外谱图
C-O不对称伸缩振动吸收峰在 1520cm-1~1390cm-1范围内,C-O对称伸缩振动吸收峰在1030cm-1附近,O-C-O平面不对称弯曲振动吸收峰在830cm-1附近,O-C-O平面对称弯曲振动吸收峰在743cm-1附近[16]。
从图3中可见,P-Na2CO3、P-CO(NH2)2和P-NaHCO3在 1051、882、821、739、1396cm-1均存在特征吸收峰, 且峰形依次逐渐尖锐,说明三者都存在Cu2(CO3)(OH)2和Zn5(CO3)2(OH)6物相[17-18],且两物相的量依次增多,三者在1513、1105和1413cm-1处同样存在特征吸收峰,可见Zn2+/Cu2+进入Cu2(CO3)(OH)2和 Zn5(CO3)2(OH)6晶格中发生同晶取代生成了(Cu,Zn)2(CO3)(OH)2和(Cu,Zn)5(CO3)2(OH)6物相,这与XRD分析结果一致。P-Na2CO3在1413cm-1处吸收峰较P-NaHCO3和P-CO(NH2)2强度大,说明P-Na2CO3试样中的(Cu,Zn)5(CO3)2(OH)6的含量较多,且晶体成长有序排列,而P-NaHCO3和P-CO(NH2)2中这两种物相的量较少或以无定形态存在,P-C2H7NO和PNaOH无上述现象。
2.4 前驱体的TG-DTG表征
前驱体中的(Cu,Zn)2CO3(OH)2是Cu2(CO3)(OH)2中的 Cu2+与 Zn2+发生同晶取代的产物,(Cu,Zn)5(CO3)2(OH)6是 Zn5(CO3)2(OH)6中的 Zn2+与Cu2+发生同晶取代的产物,因此Cu2+与Zn2+间的相互取代是形成高活性催化剂的重要因素。本文通过热重分析,结合前驱体中各物相的失重温度,建立了一种粗略计算前驱体中活性物相取代度的方法。催化剂前驱体铜锌组分物相在热重实验过程中发生以下分解反应:
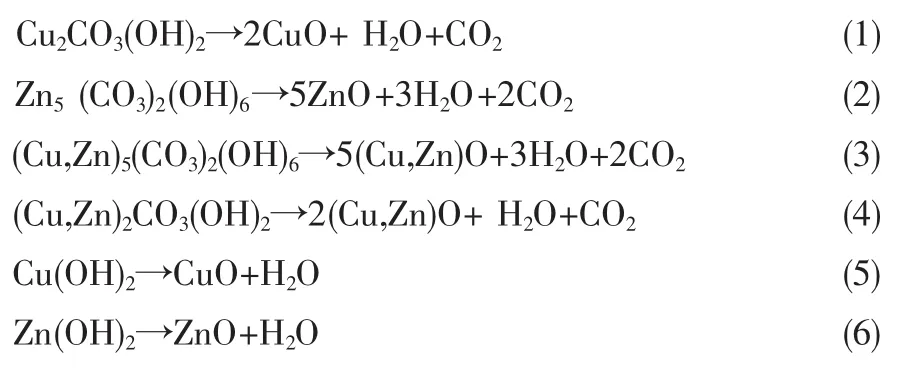

图4 Zn5(CO3)2(OH)6和Cu2CO3(OH)2的DTG谱图
图4为Zn5(CO3)2(OH)6和 Cu2CO3(OH)2的DTG谱图,Zn5(CO3)2(OH)6在248℃和265℃处出现了失重峰,在265℃失重速率最大,将其失重温度范围确定为255℃~275℃。Cu2CO3(OH)2在300℃~350℃范围内有明显的失重峰,在325℃时失重速率最大,将其失重温度范围确定为315℃~345℃;根据文献[19],(Cu,Zn)2CO3(OH)2分解温度为280℃,将其失重温度范围确定为275℃~295℃;(Cu,Zn)5(CO3)2(OH)6分解温度为362℃,将其失重温度范围确定为345℃~385℃。
图5为5组试样的 DTG谱图。由图可知,P-CO(NH2)2试样在265℃有一个小的Zn5(CO3)2(OH)6失重峰,在280、325和362℃并未出现明显的失重峰,这表明该试样前驱体中Zn5(CO3)2(OH)6含量较高,而其余三种物相含量较低。P-Na2CO3和P-NaHCO3试样在280℃和362℃出现了失重峰,在265℃和325℃处并未出现明显的失重峰,表明这两组试样中含有较多的(Cu,Zn)2CO3(OH)2和(Cu,Zn)5(CO3)2(OH)6。这两组试样在T>500℃时,出现了较为明显的失重峰,该峰为前躯体物相二次分解时碳酸盐的失重峰。P-C2H7NO和P-NaOH试样并未在上述温度出现失重峰,表明这两组试样中不含上述的4种物相。
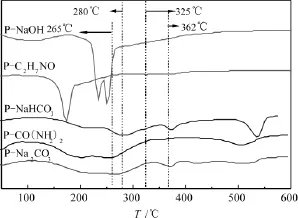
图5 不同催化剂前驱体的DTG谱图
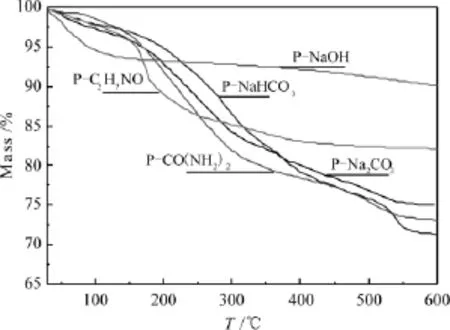
图6 不同催化剂前驱体的TG谱图
图6为5个试样的TG谱图。由该图可看出,5组试样失重量大小为P-NaHCO3>P-CO(NH2)2>P-Na2CO3>P-C2H7NO>P-NaOH。P-C2H7NO和P-NaOH的失重量分别为17.87%和9.9%,两者不存在碱式碳酸盐物相,只具有氢氧化物和氧化物,不发生铜锌同晶取代。表1给出了P-Na2CO3,P-CO(NH2)2和P-NaHCO3的TG分析结果,由表1可知,3种试样的锌孔雀石含量均远远超过绿铜锌矿的量,这说明在老化过程中,Zn2+进入 Cu2CO3(OH)2晶格,取代Cu2+形成(Cu,Zn)2CO3(OH)2物相的过程相对容易;而Cu2+进入Zn5(CO3)2(OH)6晶格中,取代Zn2+形成(Cu,Zn)5(CO3)2(OH)6物相相对困难。P-Na2CO3,P-CO(NH2)2和P-NaHCO3都含有碱式碳酸盐,三者的铜锌同晶取代度值依次降低。
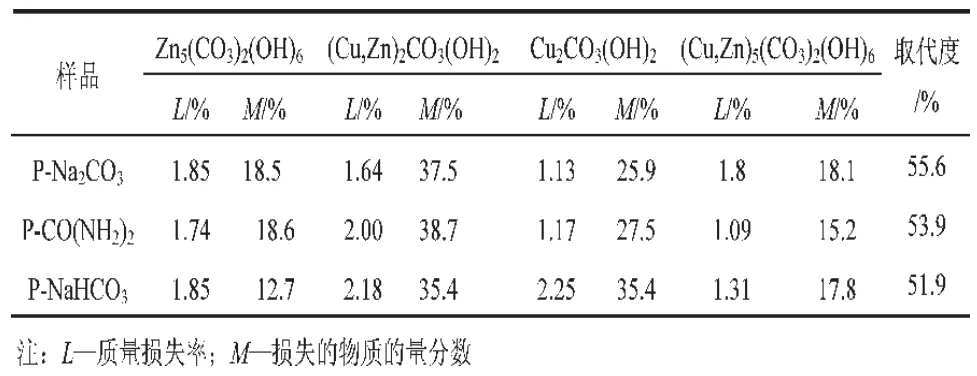
表1 五个催化剂试样TG曲线的分析结果
2.5 催化剂的活性与稳定性评价

表2 不同沉淀剂制备催化剂的活性与稳定性
表2为不同沉淀剂制备的催化剂在浆态床反应体系中的CO转化率XCO、甲醇时空收率STY、选择性SM和失活速率Q的评价结果。由表中数据可知,5种催化剂的选择性相差不大,均在98%以上,活性和稳定性存在明显差别。这5种试样的XCO和STY大小为:C-Na2CO3>C-CO(NH2)2>C-NaHCO3>C-C2H7NO>C-NaOH。P-Na2CO3、P-CO(NH2)2和P-NaHCO3的XRD衍射峰弥散,结晶度小,表明各物相分散均匀,晶体发育程度弱,三者中的铜和锌部分发生同晶取代生成(Cu,Zn)2CO3(OH)2和(Cu,Zn)5(CO3)2(OH)6物相,取代度依次降低,与活性评价顺序相同,表明(Cu,Zn)2CO3(OH)2和(Cu,Zn)5(CO3)2(OH)6为催化剂前驱体中的活性物相,焙烧后有利于形成CuO-ZnO固溶体,铜和锌组分分散均匀,协同作用强,提高催化剂的活性,其中C-Na2CO3的活性最高,STY和XCO分别达到了256.8g·kg-1·h-1和40.45%,失活速率仅为0.77%/d。 而 P-C2H7NO 和 P-NaOH 中 无(Cu,Zn)2CO3(OH)2和(Cu,Zn)5(CO3)2(OH)6物相,两者的XRD衍射峰强度明显强于前三者,且峰型尖锐,表明其物相结晶度最大,各物相分散不均匀,致使焙烧后获得的催化剂C-C2H7NO和C-NaOH中的CuO和ZnO物相结晶度在5种催化剂中最大,且分散不均匀,铜锌协同作用弱,催化剂活性最差。
3 结论
以Na2CO3做沉淀剂所制备的催化剂催化性能最好,CO转化率和甲醇时空收率分别为40.45%和256.8g·kg-1·h-1,失活率为0.77%/d。含CO32-型沉淀剂在沉淀过程中有利于形成碱式碳酸盐,进而在老化过程中进一步发生同晶取代,形成具有较高活性的锌孔雀石和绿铜锌矿物相,两物相在焙烧后易形成CuO-ZnO固溶体,且分散性好,CuO-ZnO协同作用增强,催化剂活性高。含OH-型沉淀剂制备的催化剂CuO和ZnO间分散性不好,协同作用弱,催化剂活性差。 CO32-型沉淀剂制备的催化剂前驱体中(Cu,Zn)2CO3(OH)2和(Cu,Zn)5(CO3)2(OH)6物相前者较易形成,前驱体中活性物相(Cu,Zn)2CO3(OH)2和(Cu,Zn)5(CO3)2(OH)6物相含量越高,其催化性能也越好。
[1]李忠,范辉,郑华艳,等.微波辐射对浆态床合成甲醇CuO/ZnO/Al2O3催化剂前驱体微观结构及催化性能的影响[J].催化学报,2010,31(4):471-478.
[2]Kotdabadi H,Jahanmiri A.Optimization of methanol synthesis reactor using gengtic algorithms[J].Chem Eng J, 2005:249-255.
[3]Heydorn E C,Diamond B W,Lilly R D.Commercialscale demonstration ofthe liquid phase methanol (LPMEOHTM)process,DOE/NETL-2004/1199[R].U.S. Department of Energy(DOE).DOI:10.2172/823132.
[4]Lange J P.Methanol synthesis:A short review of technology improvements[J].Catal today,2001,64:3-8.
[5]Khandan N.Mohammad Kazemeini.Mahmoud aghaziarati synthesis of dimethyl ether over modified H-mordenite zeolites and bifunctional catalysts composed of Cu/ZnO/ ZrO2and modified H-mordenite zeolite in slurry phase[J]. Catal Lett,2009,129:111-118.
[6]李忠,张小兵,郭启海,等.喷雾干燥成型温度对浆态床合成甲醇CuO/ZnO/Al2O3催化剂活性及稳定性的影响[J].化工学报,2011,62(6):1554-1562.
[7]Fujita S,Moribe S,Kanamori Y,et al.Preparation of a coprecipitated Cu/ZnO catalyst for the methanol synthesis from CO2effects ofthe calcination and reduction conditions on the catalytic performance[J].Appl Catal A,2001,207(1):121-128.
[8]Shen G C,Fujita S I,Takezawa N.Preparation of precursors for the Cu/ZnO methanol synthesis catalysts by coprecipitation methods:Effects ofthe preparation conditions upon the structures of the precursors[J].J Catal, 1992,138(2):754-758.
[9]王文亮,李东升,岳可芬,等.沉淀剂对CuO超细粉体形态与性能的影响 [J].化学研究与应用,2004,15(6): 775-778.
[10]Fujitani T,Nakamura J.The chemical modification seen in the Cu/ZnO methanol synthesis catalysts [J].Appl Catal A,2000,191(1-2):111-129.
[11]Li J L,Inui T.Characterization of precursors of methanol synthesis catalysts, copper/zinc/ aluminum oxides, precipitated at different pHs and temperatures[J].Appl Catal A,1996,137(1):105-117.
[12]Millar G J,Holm I H,Uwins P J R,et al.Characterization of precursors to methanol synthesis catalysts Cu/ZnO system[J].J Chem Soc,Faraday Trans,1998,94(4):593-600.
[13]Spencer M S.Precursors of copper/zinc oxide catalysts[J]. Catal Lett,2000,66(4):255-257.
[14]Choi Y,Futagami K,Fujitani T.The role of ZnO in Cu/ ZnO methanol synthesis catalysts-morphology effect or active site model[J].Appl Catal A,2001,208(1-2):163-167.
[15]Zhang X B,Li Z,Guo Q H,et al.Influence of the calcination on the activity and stability of the Cu/ZnO/ Al2O3catalyst in liquid phase methanol synthesis[J].Fuel, 2010,89(7):1348-1352.
[16]Stoilova D,Koleva V,Vassileva V.Infrared study of some synthetic phases of malachite (Cu2(OH)2CO3)-hydrozincite (Zn5(OH)6(CO3)2)series[J],Specrochim Acta Part A,2002, 58(9):2051-2059.
[17]FrostR L,HalesM C.Synthesisand vibrational spectroscopic characterisation of synthetic hydrozincite and smithsonite[J].Polyhedron,2007,26:4955-4962.
[18]Frost R L,Hales M C,Reddy B J.Aurichalcite-an SEM and Raman spectroscopic study[J].Polyhedron,2007,26: 3291-3300.
[19]Millar G J,Holm I H,Uwins P J R,et al.Characterization of precursors to methanol synthesis catalysts Cu/ZnO system[J].J Chem Soc,Faraday Trans,1998,94(4):593-600.
Effect of precipitants on properties of copper-based catalysts for methanol synthesis in slurry reactor
WANG Hai-long1,MA Feng-yun1,MO Wen-long1,WANG Ye1,LI Zhong2,XIAO Yan1
(1.Key Laboratory of Coal Clean Conversion and Chemical Engineering Process(Xinjiang Uyghur Autonomous Region),College of Chemistry and Chemical Engineering,Xinjiang University,Urumqi 83004,China;2.Key Laboratory of Coal Science and Technology of Ministry of Education and Shanxi Province,Institute of Coal Chemical Engineering,Taiyuan University of Technology,Taiyuan 030024,China)
Five CuO/ZnO/Al2O3catalysts used for methanol synthesis were prepared by co-precipitation method with Na2CO3, CO(NH2)2,NaHCO3,C2H7NO and NaOH as precipitants,respectively.The effects of precipitants on the phase composition of the catalyst precursors were investigated,and the corresponding catalytic performance of the prepared catalysts were evaluated in a slurry bed reactor.The results showed that(Cu,Zn)2CO3(OH)2and(Cu,Zn)5(CO3)2(OH)6were active components in catalyst precursors which were prepared by precipitants containing CO32-.(Cu,Zn)2CO3(OH)2phase was easier than(Cu,Zn)5(CO3)2(OH)6to be formed,and both of them could be decomposed to form CuO-ZnO solid solution in which the synergistic effect of copper and zinc was high,resulting in high catalytic performance.The dispersion between CuO and ZnO in the catalysts prepared by precipitants containing OH-was poor, resulting their bad catalytic performance.TG-DTG results showed that the catalyst prepared by Na2CO3as precipitant had the highest content of(Cu,Zn)2CO3(OH)2and(Cu,Zn)5(CO3)2(OH)6in the five catalyst precursors,which made it had the best catalytic performance: the CO conversion was 40.45%;STY for methanol was 256.8g·kg-1·h-1;and the deactivation rate was 0.77%/d.
methanol synthesis;copper-based catalyst;preparation;precipitator;slurry bed reactor
O643.1;TQ426;TQ223.121
:A
:1001-9219(2015)03-26-06
2014-07-08;基金来源:新疆维吾尔自治区科技支疆项目 (201291102),乌鲁木齐市科学技术计划项目(G131010001);
:王海龙(1988-),男,在读研究生,电话13609905547,电邮718916298@qq.com;*联系人:马凤云(1954-),女,教授,博士生导师,电邮 ma_fy@126.com。

