二氧化碳加氢制甲醇过程热力学分析
祝 贺,汪丹峰,陈倩倩,沈国飞,唐志永
(中国科学院上海高等研究院,上海 201210)
二氧化碳加氢制甲醇过程热力学分析
祝 贺,汪丹峰,陈倩倩,沈国飞,唐志永*
(中国科学院上海高等研究院,上海 201210)
CO2加氢制甲醇是温室气体CO2资源化一个极具前景的研究领域,本文采用吉布斯自由能最小法耦合非理想体系PR状态方程对反应过程进行了热力学平衡分析。结果表明,提高压力和降低温度有利于反应的进行,有利于提高CO2的转化率,同时提高了CH3OH的选择性;增加原料n(H2)/n(CO2)有利于提高CO2的转化率和CH3OH的选择性。另外,适当添加少量CO作为原料,CO可能从产物转变为反应物,因此虽然降低了反应过程CO2的转化率,但能够增加单位CO2的CH3OH产率,不过,若原料气中CO含量过多,则CO2加氢过程转变为传统的CO加氢过程;由于反应过程受热力学平衡的制约,CO2单程转化率较低(约20%~30%),采用尾气循环的工艺过程能够成倍提高CO2总转化率。
二氧化碳;资源化;加氢;甲醇;热力学;吉布斯自由能最小法
CO2作为最主要的温室气体,是碳氢化合物燃烧的终极产物,同时也是一种宝贵的含碳资源,CO2资源化是绿色化学和可持续发展的趋势。化学惰性较强的CO2在一定温度和高效催化剂条件下进行催化转化而加以化学利用,如CO2重整CH4制合成气、CO2与环氧化合物合成环状碳酸酯、CO2加氢制甲醇[1-2]。其中CO2加氢制甲醇是一个极具前景的研究领域,一方面,产品甲醇是现代化工和能源产业结构中重要的基础化工产品和化工原料;另一方面,该路线中合成和精馏操作单元的投资与传统路线(CO加氢制甲醇)的投资相当,而原料CO2的丰富廉价,进一步提升了该路线的经济性[3]。
CO2加氢研究重点大多集中在催化剂[4-7]活性组分、载体和助剂的选择,考察不同制备方法、预处理等对催化剂性能的影响。热力学平衡数据是CO2加氢制甲醇过程重要的基础数据,若能认清CO2加氢制甲醇的热力学规律,将会对催化剂的研制、反应器的结构形式和工艺操作条件的优化等提供重要的理论指导与基础数据支持,而对于CO2加氢制甲醇过程系统的热力学分析鲜有文献进行报道。
处理复杂反应体系的化学平衡问题的经典方法主要有两类[8]:平衡常数法和吉布斯自由能最小法 (又称自由焓最小法)。对于含有CO2、H2、CO、CH3OH等非理想气体体系,早期文献报道主要采用平衡常数法,通过SHBWR[9]、PR,SRK[10]等状态方程求解,这需要进行详细的过程推导和复杂的计算机编程,计算成本高,工作量大。周密[11]等指出计算甲醇合成体系的平衡组成时,偏离非理想物性可以在Aspen Plus商业软件中采用BWRS物性方法,但未指明计算复杂反应体系的化学平衡所采用的方法。
本文基于吉布斯自由能最小法,针对CO2加氢制甲醇的非理想气体混合体系采用PR状态方程,对量子气体氢气的临界参数进行修正[12],通过商业软件Aspen Plus内吉布斯反应器对CO2加氢制甲醇过程进行热力学平衡分析。
1 反应体系
CO2加氢制甲醇反应体系中,若不考虑生成烷烃、醇等副反应及体系可能存在的少量惰性气体如N2等,主要反应有:

CO2加氢制甲醇反应体系中共有五种反应化合物CO2、H2、CH3OH、CO、H2O,其组成元素有C、H、O共3种,通过原子系数矩阵和化合物化学式系数矩阵分析可知系数矩阵的秩为3,根据相律分析,独立组分数为5,则独立反应数为2,其中反应(1)为主反应。
2 热力学与动力学
CO2加氢制甲醇过程,独立反应数R=2,即需要2个独立反应及相关反应的动力学方程来分析CO2加氢过程。动力学方程型式及参数,很大程度依赖于催化剂,同时也受到反应器类型及操作条件等因素影响。
用以控制化学过程的方法主要是改变:(1)温度;(2)压力;(3)反应物的比例;(4)催化剂。若不知这些因子对平衡及速度的影响,就不但不能使其充分发挥作用,有时还可以引起混乱。动力学与热力学是相辅相成的,动力学的研究必须以热力学的结果(肯定反应有可能发生)为前提条件,而热力学只有与动力学相结合才能全面解决化学反应的实际问题[13-14]。
因此,不同结构和特性的催化剂上的动力学过程虽然有所差异,但都遵循热力学,即都受到热力学反应趋势和极限目标的限制。分析二氧化碳加氢制甲醇过程的热力学过程,可以帮助判断反应进行的方向、过程的控制因素(热力学还是动力学)和热力学平衡的限度,避免热力学上不可行或者不利的生产和设计条件。
3 结果与讨论
3.1 温度、压力和原料气n(H2)/n(CO2)对平衡的影响
CO2加氢制甲醇体系内,原料气只有H2和CO2,因此需要研究温度、压力和原料气n(H2)/n(CO2)等对体系热力学平衡的影响。
以250℃、5MPa、n(H2)/n(CO2)=3(由反应(1)的化学计量数确定)为基础,研究温度、压力和原料气n(H2)/n(CO2)等对热力学平衡过程中CO2的转化率XCO2、甲醇的选择性SM和CO的选择性SCO的影响,如表1所示。从表1可以看出:
(1)随着反应温度的增加,达到平衡时,H2和CO的物质的量分数yH2、yCO增加,CH3OH和H2O的物质的量分数yM、yH2O降低,CO2的物质的量分数yCO2变化不大;XCO2降低;SM降低,SCO增加;反应温度从 200℃上升到 280℃时,XCO2从 37.62%降低到25.07%,而SM从96.04%降低到42.99%。
(2)随着操作压力的增加,达到平衡时,yH2、yCO、yCO2降低,yM、yH2O增加;XCO2、SM增加,SCO降低; 操作压力从1MPa上升到10MPa时,XCO2从16.95%上升到40.11%,SM从9.60%上升到90.87%。
(3)随着n(H2)/n(CO2)的增加,达到平衡时,yCO2、yCO降低,yH2增加,yM、yH2O变化不大;XCO2、SM增加,SCO降低;原料n(H2)/n(CO2)从2增加到4时,XCO2从20.47%增加到31.75%,βM从65.66%增加到74.67%。
温度、压力和n(H2)/n(CO2)对平衡组成的影响,有其热力学方面的根本原因,可以通过对独立反应(1)和反应(2)的影响进行分析:
(1)CO2加氢合成甲醇为放热反应,降低温度促进反应(1)和反应(2)朝正方向进行,xCO2增加;同时可能由于主反应反应(1)比反应(2)放热量大,低温对甲醇生成有利,降低温度SM增加。但从动力学角度而言,低温会降低催化反应,研发高性能的低温催化剂则有非常重要的意义。
(2)CO2加氢合成甲醇主反应反应(1)的分子数降低,增加压力有利反应朝正方向进行,有利于CO2转化,XCO2提高。压力对反应(2)没有影响,因此提高压力,SM增加。但高压会增加体系压缩功耗,增加运行成本。
(3)增加原料n(H2)/n(CO2),促进主反应反应(1)朝正方向进行,XCO2增加,但提高原料H2含量会增加H2消耗,增加了原料成本,廉价的H2来源也是制约其工业化的难点之一。
3.2 n(CO)/n(CO2)对平衡的影响
由上述分析可知,以CO2和H2为原料时,反应产物为 CO和 CH3OH,CO作为副产物降低了CH3OH的选择性,因此原料中可补充少量的CO以提高CH3OH的选择性。根据反应(2)可知,CO可能是产物也可能是反应物,传统的甲醇和CO的选择性定义将失去意义。以反应器为基准,引进基于单位CO2输入的CH3OH产率的概念YM/CO2in,定义为反应器达到平衡时甲醇流量和反应器入口甲醇流量的差值与反应器入口CO2流量的比值,见式(4)。
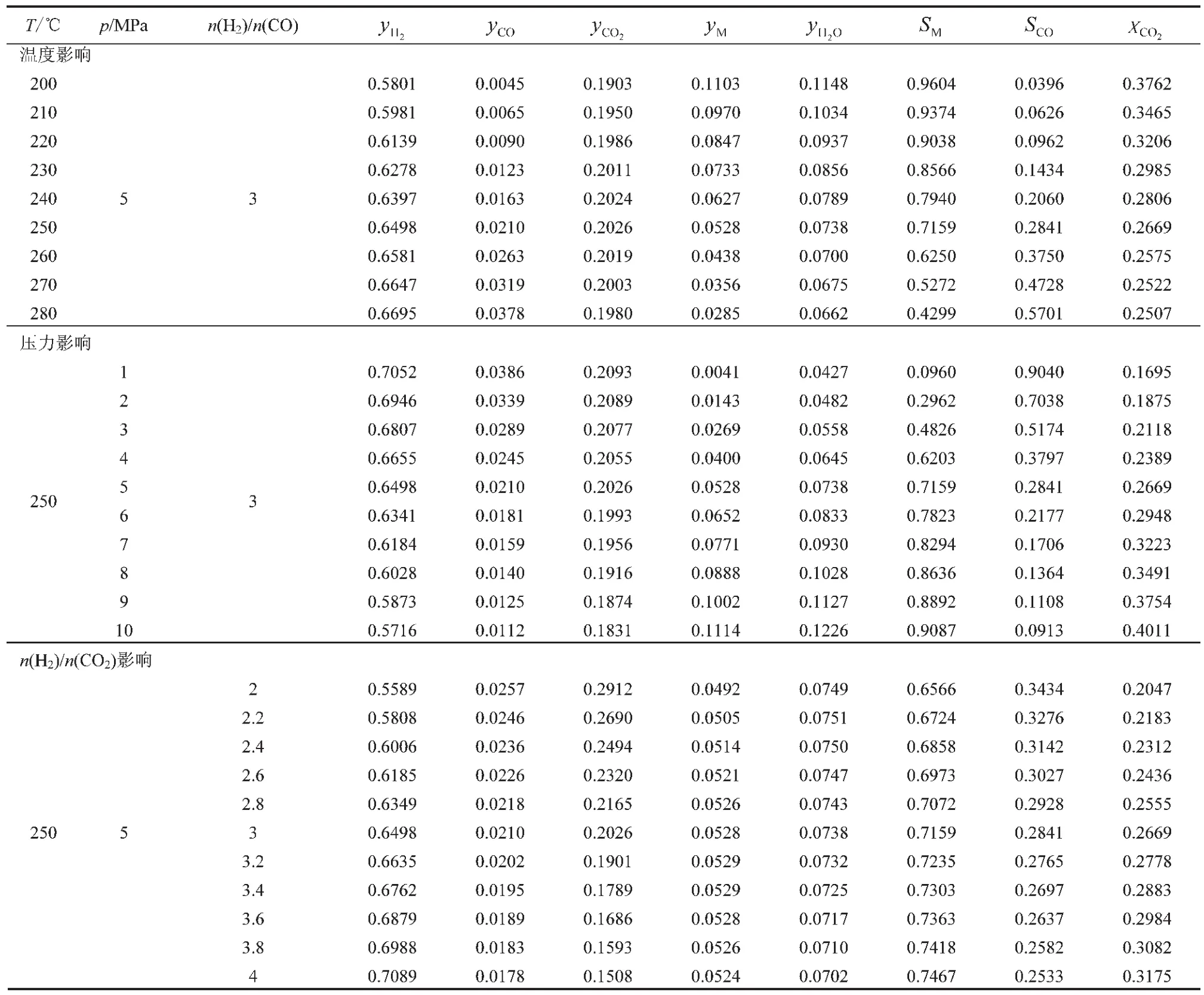
表1 温度、压力和原料n(H2)/n(CO2)对热力学平衡的影响
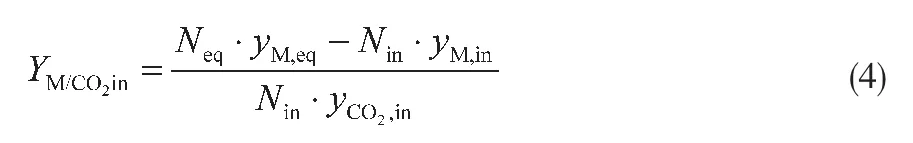
CO2加氢过程,原料气只有H2和CO2,CH3OH和CO是产物。若原料中加入CO后,反应(2)可能朝正方向也可能逆方向进行,因此CO既可能是产物也可能是反应物,视具体情况而定。对于平衡时产物中CO与原料气中 CO的流量差值ΔNCO=Neq· yCO,eq-Nin·yCO,in,若ΔNCO>0,则原料气中CO量小于平衡时CO量,CO为生产物;若ΔNCO<0,则原料气中CO量大于平衡时CO量,CO为反应物。
以250℃、5MPa、n(H2)/n(CO2)=3为基础,研究原料n(CO)/n(CO2)对过程热力学平衡的影响,见表2。从表2可以看出:随着原料n(CO)/n(CO2)的增加,达到平衡时,yH2、yH2O降低,yCO、yCO2、yM增加; 当n(CO)/ n(CO2)较低时(低于0.05),ΔNCO>0,CO为生产物;当n(CO)/n(CO2)较高时(高于0.1),ΔNCO<0,CO为反应物。所以,随着原料气中n(CO)/n(CO2)增加,CO逐步从生产物变为反应物,因此虽然 XCO2降低,但YM/CO2in仍然增加。不过,若原料气中有太多的CO,则CO2加氢过程转变为传统的CO加氢过程。
3.3 尾气循环及案例
上述分析可知,对于CO2加氢过程,高压、低温等条件有利于提高CO2的转化率,但由于化学平衡条件的限制,CO2单程转化率(即上文定义的CO2的转化率XCO2,以进入反应器的CO2流量作为基准)只有20%~30%,可考虑采用尾气循环的方式来提高CO2总转化率(以原料气的CO2流量作为基准)。
建立如图1所示的CO2加氢循环工艺过程,原料 CO2、H2及少量 CO与循环气 7在混合器MIXER-1中充分混合后,流股1与反应器出口流股3预热至约 200℃的流股 2后进入反应器REACTOR,反应后流股3热量通过热流100供给流股1加热后,经过HEATER-3继续冷却至约40℃后进入闪蒸室 FLASH, 闪蒸产品粗甲醇METHANOL收集,而闪蒸气6部分作为尾气8排放,大部分作为循环气7重新进入反应系统。对反应器仍采用平衡计算的方法,即假设原料在反应器内经过足够的停留时间和高效的催化剂作用最终达到化学平衡。
循环工艺影响参数较多,除上述讨论的温度、压力等参数外,循环比也是重要参数之一。本文给出一个计算案例,循环工艺过程的物流信息如表3所示。可知,在反应器内为220℃、5MPa、n(H2)/ n(CO2)=3、n(CO)/n(CO2)=0.1时,采用的循环比=6728/ (1200+3600+120)=1.4,此时:

表2 原料n(CO)/n(CO2)对热力学平衡的影响
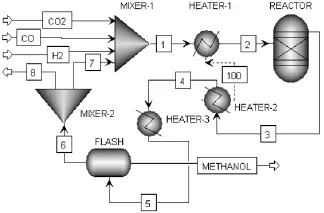
图1 CO2加氢循环工艺过程
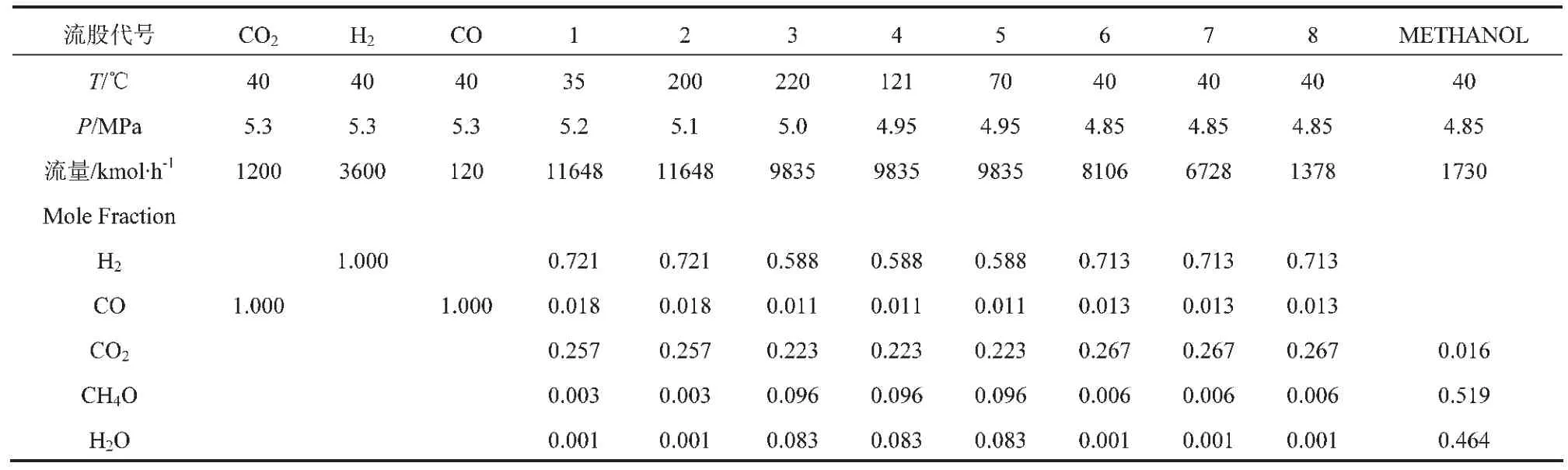
表3 CO2加氢循环工艺物流信息表
CO2单程转化率为:
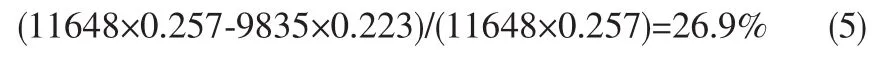
CO2总转化率为:

因此,CO2加氢过程的CO2单程转化率较低,若采用尾气循环的工艺过程,CO2总转化率可成倍增加。
4 结论
本文采用吉布斯自由能最小法耦合非理想体系PR状态方程,基于商业软件Aspen plus对反应过程进行了热力学平衡分析,分别考察了温度、压力、n(H2)/n(CO2)、原料气中添加少量CO、尾气循环等对CO2加氢热力学过程的影响。结果表明,提高压力和降低温度有利于反应的进行,有利于提高CO2的转化率,同时提高了CH3OH的选择性;增加原料n(H2)/n(CO2)有利于提高CO2的转化率和CH3OH的选择性。另外,适当添加少量CO作为原料,CO可能从产物转变为反应物,因此虽然降低了反应过程CO2的转化率,但能够增加单位CO2的CH3OH产率,不过,若原料气中CO含量过多,则CO2加氢过程转变为传统的CO加氢过程;由于反应过程受热力学平衡的制约,CO2单程转化率较低(约20%~30%),采用尾气循环的工艺过程能够成倍提高CO2总转化率。
[1]魏伟,孙予罕,闻霞,等.二氧化碳资源化利用的机遇与挑战[J].化工进展,2011,30(1):216-224.
[2]许文娟,马丽萍,黄彬,等.CO2催化加氢研究进展[J].化工进展,2009,28(S1):284-289.
[3]杨志贤.二氧化碳加氢制甲醇 [J].聚氯乙烯,1998,26 (4):36,57-60.
[4]高成广,范凤兰,贾丽华,等.助剂对CuO-ZnO-Al2O3催化CO2加氢合成甲醇性能的影响[J].天然气化工(C1化学与化工),2013,38(4):42-46.
[5]高成广,范凤兰,贾丽华,等.凝胶网格共沉淀法制备CuO/ZnO/Al2O3及其催化CO2加氢合成甲醇研究[J].天然气化工(C1化学与化工),2013,38(02):29-33.
[6]高文桂,王华,张逢杰,等.铜锌比对CuO-ZnO-ZrO2催化剂CO2加氢合成甲醇性能的影响[J].天然气化工(C1化学与化工),2014,39(04):16-20,40.
[7]覃志强,高文桂,王华,等.稀土助剂 Pr改性 Cu/Zn/ ZrO2合成甲醇催化剂的催化性能 [J].化工进展,2013, 32(4):820-823.
[8]朱开宏,袁渭康.化学反应工程分析 [M].北京:高等教育出版社.2002.
[9]宋维端,朱炳辰,骆赞椿,等.应用SHBWR状态方程计算加压下甲醇合成的反应热和平衡常数 [J].华东化工学院学报,1981,17(1):11-24.
[10]应卫勇,薛梅,房鼎业.甲醇合成系统平衡组成计算[J].化工设计与开发,1991,3(4):19-24.
[11]周密,唐黎华,刘敬荣.Aspen Plus模拟计算甲醇合成的平衡组成[J].煤化工,2008,12(6):30-33,42.
[12]韩晓锋,张清,杨金珠,等.ASPEN PLUS在甲醇合成中的应用[J].煤化工,1999,27(2):32-34.
[13]傅鹰.化学热力学导论 [M].北京:科学技术出版社, 1981.
[14]刘士荣.物理化学概念辨析[M].长沙:湖南科技出版社, 1986.
Thermodynamic analysis of CO2hydrogenation to methanol
ZHU He,WANG Dan-feng,CHEN Qian-qian,SHEN Guo-fei,TANG Zhi-yong
(Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai 201210,China)
The greenhouse gas CO2hydrogenation to methanol was a very promising research area for CO2utilization. Thermodynamic equilibrium of CO2hydrogenation to methanol was analyzed using the Gibbs free energy minimization with PR state equation.It indicates that CO2conversion and the selectivity of methanol would increase with the increase of reaction pressure and H2/CO2molar ratio in the feed gas and the decrease of reaction temperature.The methanol yield per mole CO2increased,though CO2conversion decreased,with the addition of a small amount of CO into the feed gas.Yet,CO2hydrogenation would be replaced by CO hydrogenation if an excessive amount of CO was added into the feed gas.Due to thermodynamic equilibrium restriction,CO2one-pass conversion was low(20%-30%).The total CO2conversion could be doubled when the exhaust gas recycling process was adopted.
carbon dioxide;resource utilization;hydrogenation;methanol;thermodynamics;Gibbs free energy minimization
O642;TQ013.1;TQ223.121
:A
:1001-9219(2015)03-21-05
2014-10-14;
:中国科学院战略性先导科技专项(XDA02000000);
:祝贺(1984-),男,工程师,从事碳一化工、能源、环境相关的反应器开发及计算机仿真,电邮zhuh@sari.ac.cn;*
:唐志永,研究员,研究方向为反应工程、系统集成及复合能源体系,电邮tangzy@sari.ac. cn。

