血清碱性磷酸酶测定结果的溯源性研究
王卫兵
首都医科大学,北京 100069
血清碱性磷酸酶测定结果的溯源性研究
王卫兵
首都医科大学,北京 100069
一项血清酶测定结果的可溯源性研究发现,碱性磷酸酶(ALP)在多种生化分析仪上的测定结果与校正物的定值相差悬殊,并且不同来源的ALP试剂盒的测定结果间也存在高低不一的系统误差。本文分析了系统误差的产生原因,从理论和实验两个方面排除了生化分析仪的原因,指出影响ALP测定结果的关键因素是缓冲液的种类,并以此为例说明在进行血清酶活性测定结果的溯源、校正和室间比对时,必须考虑构成检测系统的各个要素,包括试剂盒的性能质量和生化分析仪的参数设置。
碱性磷酸酶;生化分析仪;酶活性测定;结果溯源;室间质评
0 前言
在一项血清酶测定结果可溯源性研究[1]中,研究的组织者在某市三级医院的50家检验科和其他临床实验室统一发放了由日本临床化学协会(JSCC)推荐的酶参考物(ERM)1支(日本旭化成株式会社生产),随后让各实验室在多种生化分析义上(主要包括日立、奥林巴斯和贝克曼全自动生化分析仪)按现行操作规程要求进行定标和室内质控测定,之后再测定ERM,重复测定10次,在指定日期内完成检测,取均值上报给检验中心进行统计计算。研究者对50家实验室的ERM测定结果均值与ERM标示值进行了比较,认为二者间的相对偏倚属于系统误差,其中相对偏倚最大的项目是碱性磷酸酶(ALP)。研究者对此指出,ALP测定结果显著低于标准品标示值,不同试剂间的测定结果偏差较大,这与试剂中缓冲液的组成和种类有关,未明确ALP测定结果偏差的原因。笔者查对了该研究论文中列出的11个不同来源的ALP试剂盒的测定原理和试剂组成,现就ALP测定结果的溯源、校正和室间质评与试剂盒性能质量的关系讨论如下。
1 ALP测定结果在EAE和2A 2M 1P缓冲系统间的系统误差的原因分析
在笔者査对的11种试剂盒中,有8个试剂盒的测定结果低于标准品标示值,这些试剂盒使用的底物相同,均为对硝基酚磷酸二钠,缓冲系统为2-氨基-2-甲基-1-丙醇(2A2M 1P)。不同ALP试剂盒选用的2A2M 1P浓度范围为0.35~1.00 mol/L,pH范围为10.2~10.9,ALP激活剂Mg2+浓度范围为0.5~2.2 mmol/L(其中有用醋酸镁的,也有用氧化镁的),这8种试剂盒对标准品的测定结果比标示值低的程度范围为30%~50%,不同试剂盒间的差异应该是由2A2M 1P缓冲液浓度、pH值和Mg2+浓度的差异造成的。如果检测的酶标准品是在2A2M 1P缓冲系统内定值,那么这8种试剂盒的测定结果应该最接近定值。在室间质评的ALP测定方法分组时,此8种试剂盒应归为一组,使用同一靶值,计算变异指数(VIS)和能力比对(PT)得分。那么为什么采用这8种ALP试剂盒检测ERM的ALP活性会出现如此大的负偏倚呢?
笔者查阅了ERM中,ALP并不是在2A2M 1P缓冲液内定值,而是采用日本临床化学协会(JSCC)的推荐方法定值[2],缓冲液是2-乙基氨基乙醇(EAE),而美国临床化学协会(AACC)和国际临床化学联合会(IFCC)推荐方法中采用的缓冲液为2A2M 1P[3],德国临床化学协会[4](GSCC)和斯堪地那维亚临床化学协会(SSCC)则推荐使用二乙醇胺(DEA)。在不同缓冲系统中,血清中ALP各型同工酶活性的表达程度不一。而在EAE中,ALP各型同工酶相对催化反应性较一致,即肝型100%、骨型90%、胎盘型89%、小肠型99%。而在DEA或2A2M 1P中,小肠型ALP的相对活性表达低于50%,在一些肝病血清中小肠型ALP也占相当大比例,故我国和JSCC推荐使用EAE作为缓冲液[5]。JSCC曾在EAE与DEA缓冲液系统中测定了一批血清的ALP活性,观察了肝型、小肠型ALP在两种缓冲系统中的活性表达(图1)。由图1可见,小肠型ALP在EAE中的活性比在DEA中高出约33%[6]。

图1 两种缓冲液(DEA和EAE)中ALP活性相关散点图
笔者在一项比较研究中,用3种缓冲液系统同时检测了高ALP活性血清的系列稀释样品,结果见图2。由图2可见,ALP活性在DEA中比在2A2M 1P中平均高出2倍以上;ALP活性在2A2M 1P中又比在碳酸盐缓冲液高。在本研究纳入的20例患者中,在DEA(Y)与碳酸盐缓冲液(X)中测定血清ALP活性的相关系数(r)为0.99,回归方程Y=2.46X-5.99,回归散点图见图3。分别以ALPEAE、ALPDEA、ALP2A2M 1P、ALPNaHCO3/Na2CO3代表4种缓冲液的ALP活性。若根据图1~3的数据测定同一样品的ALP活性,应呈现ALPEAE≈ALPDEA>ALP2A2M 1P>ALP NaHCO3/Na2CO3,这正是采用2A2M 1P缓冲液的8个不同来源的ALP试剂盒检测ERM的ALP活性会出现较大负偏倚的原因。按照酶校正物可转移性(Transferability)的定义,酶校正物只能在两个表现有相同分析特异性的方法间转移准确性,因此由JSCC法定值的ERM不适合在以2A2M 1P为缓冲液的ALP测定方法中转移准确性。
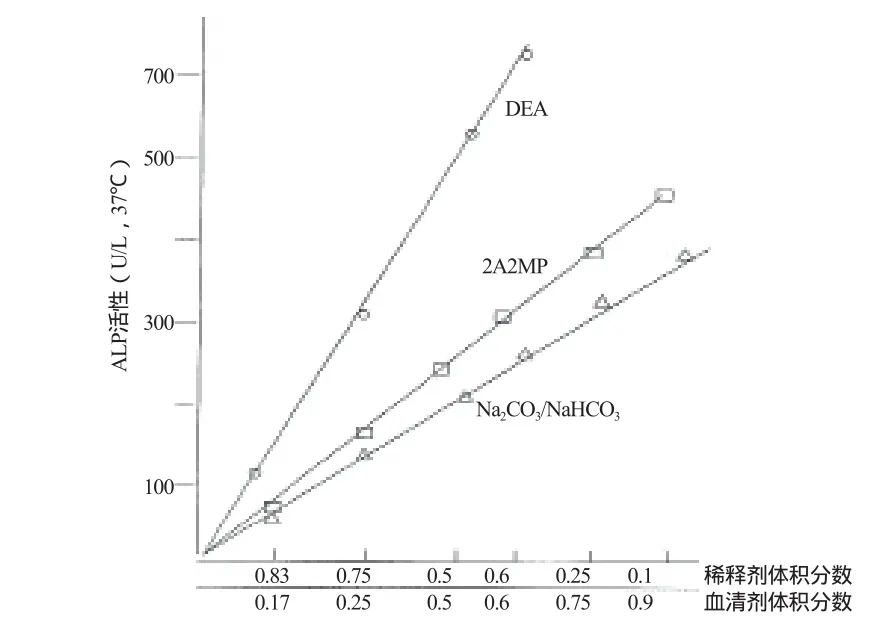
图2 碱性磷酸酶活性与缓冲液种类的关系

图3 两种缓冲液中血清碱性磷酸酶活性相关散点图
2 ALP测定结果在EAE和DEA缓冲系统间的系统误差的原因分析
由上所述,由JSCC法定值的ERM也不适合在以DEA为缓冲液的ALP测定方法中进行校正。由图1可知,EAE和DEA分析特异性的不同主要表现在小肠型ALP在EAE中表达程度为99%,而在DEA中却不足50%。IFCC和我国临床检验学会否定DEA缓冲系统的原因有5点[5]:①DEA的pH反应曲线为过敏感曲线,对保证分析的重复性不利;②1 mol/L的DEA粘度大,在仪器分析中易产生交叉污染;③DEA的pH离最适pH较远;④DEA试剂杂质中有ALP抑制剂;⑤不同型ALP同工酶活性表达差异相对较大。GSCC和SSCC主要依据缓冲液选择的一般原则,即从多种缓冲液中选择酶活性表达最高者,至于其他一些弱点可以用提高试剂纯度、降低浓度等加以调整。
在11种检测ERM的ALP试剂盒中,有两种ALP试剂盒的检测结果高于ERM的标示值,其中一种ALPDEA1的正偏倚约25%,另一种ALPDEA2的正偏倚竟高达80%,这两种ALP试剂盒都为德国生产。经查产品说明书已明确ALPDEA2所用缓冲液是DEA,浓度0.35 mol/L,pH10.4,醋酸镁16 mmol/L,ZnSO41.0 mmol/L,其中Mg2+浓度比上述任一ALP试剂盒中的Mg2+浓度都高,而且添加了Zn2+,这可能是ALPDEA2测定结果比ERM标示值高出80%的主要原因。Mg2+是ALP的激活剂,而血清内源性Mg2+浓度会因人而异,正常成人血清Mg2+浓度的参考范围为0.74~1.03 mmol/L。Zn2+又是ALP的辅基,Zn2+-ALP为全酶(holo-ALP)具有活性,如失去Zn2+只剩下ALP的酶蛋白(apo-ALP)则无活性。考虑到大多数定值或非定值质控血清,甚至酶校正物在制备过程中会发生Zn2+丢失,在这些质控物质或校正物中就会存在不同比例的apo-ALP。依据上述结果,日本旭化成株式会社的ERM中必然存在较高比例的apo-ALP,因此在使用含有Zn2+的ALPDEA2试剂盒测定时,这些apo-ALP可得以表达。据此也可推断,日本旭化成株式会社在给ERM定值的ALP试剂组分中缺Zn2+,没有使apo-ALP转化为holo-ALP。
据IFCC的ALP研究资料显示,在ALPDEA2的试剂中,除有Zn2+外,还应有适量离子缓冲螯合剂N-羟基乙基乙二胺四乙酸(HEDTA)。这是因为:Zn2+/Mg2+之间存在对apo-ALP的竞争结合,如果反应液中Zn2+/Mg2+比例不当会导致ALP活性下降;因为Zn2+对apo-ALP的亲和力比Mg2+高10倍,为防止Zn2+对Mg2+激活作用的解除,需要向试剂中添加适量HEDTA,利用Zn2+-HEDTA与Mg2+-HEDTA解离常数的不同,维持反应液Zn2+/Mg2+的适当比例,以实现ALP的最大活性表达。ALPDEA1测定结果不如ALPDEA2高的原因,即与Mg2+、Zn2+、HEDTA等在试剂盒生产中的运用是否科学合理有关[7]。
3 由ALP室间质评分析科学分组的重要性
在ALP室间质评中,底物相同都是对硝基酚磷酸盐(4NPP),方法学分组应当主要依据采用何种缓冲体系。在RANDOX组织的-次跨国室间质评中,涉及1000多个参评实验室,主要分为两组:(4NPP,AMP,37℃)和(4NPP,DEA,37℃),两组的回报结果(均值±2SD)确定的靶值分别是409 U/L和505 U/L(表1),可见方法组1(AMP)缓冲液与方法组2(DEA)缓冲液间的质评结果存在明显系统误差。

表1 RANDOX室间质评ALP回报数据分组统计结果
某国家在2007年组织了3次共15个调查样品的室间质评,选择其中一组数据(200721)来显示两个方法组的统计结果(表2),可见方法组1(AMP)缓冲液与方法组2(其他)缓冲液的质评结果均值基本相等。这种回报结果趋同性是由于方法学分组不科学,再加上其他原因造成的,使本应存在的方法间的系统误差不能显现。
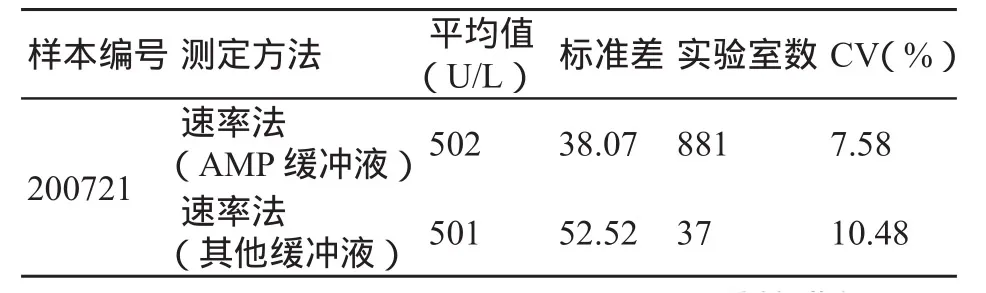
表2 某国家室间质评ALP回报数据分组统计结果
此外,ALP测定时如果不按所用缓冲系统进行分组,而是使用同一靶值,将使室间质评结果混乱,达不到通过参加室间质评来提高参评实验室检测准确性的目的。某国家某省在2006年进行的室间质评没有分组,ALP回报结果见表3,可见在ALP室间质评中,不进行科学合理的方法学分组,必然会导致这种高低相差悬殊的回报结果。

表3 某国家某省2006年室间质评ALP回报结果
4 ALP检测系统与实验误差
试剂盒的性能质量会影响ALP的测定结果,除缓冲液外,其他因素如底物浓度、pH、离子强度、辅因子的种类和浓度等也会影响测定结果。此外,校正方法、仪器性能、仪器分析中的参数设置、仪器维护保养及操作规程等也会对测定结果造成影响,即凡是构成“ALP检测系统”的各要素在任一环节出现问题都会影响到最终结果。
以某公司生产的ALP试剂盒为例,其缓冲液为2A2M 1P,参数设置为波长405 nm、比色杯光径1 cm、反应温度37 ℃。第1种测定方法以血清起动:应用试剂为试剂1与试剂2以4:1比例混合后备用,应用试剂与标本按1000 μL比20 μL的比例混匀,60 s后开始监测2 m in内每分钟的吸光度变化,并计算出每分钟吸光度的变化率;第2种测定方法以试剂2起动:试剂1与标本按800 μL比20 μL的比例混匀并保温3~5 min,加入200μL试剂2混匀,60 s后开始监测2 m in内每分钟的吸光度变化,并计算出每分钟吸光度的变化率,根据每分钟吸光度的变化率计算ALP的活性。从上述过程可以看出,“ALP检测系统”包含多种影响因素,在分析时需要具体分析和综合分析相结合。在“ALP检测系统”间,影响检测结果的主要因素是缓冲液种类和试剂配方。另一项关于不同检测系统血清酶测定结果的偏倚评估与可比性的研究发现,检测系统与目标检测系统间的误差不能被接受,其原因也应按上述思路进行分析[8]。
为了做好血清酶测定结果的溯源、校正和室间质评,相关人员应进一步学习IFCC发布的文件[PⅡS0009-9120(98)00039-3],该文件以实例证明了酶校正物的可交换性只能在有相同分析特异性的方法间进行,并一再强调了“检测系统”的概念。不能把酶校正物简单地当作一般代谢物已知浓度的标准品那样使用,避免造成测定结果和临床应用的混乱[9]。正如文献报道的那样:一个厂家的校正品一般都是在自己的检测系统内进行评估的,在同类系统内能很好地把测定结果的值在参考方法和常规方法间进行传递,但它不一定适合另一个厂家的检测系统,因此不要把一个厂家针对特定检测系统生产的校正品用于校正另一个检测系统[10]。
5 结语
目前,国际上对ALP的基因结构及分子生物学的研究已经非常深入,ALP检测的参考方法、标准操作程序和参考物质(校正血清)也都已经推广,ALP测定的准确性也不断提高。为保证我国临床常规化验室ALP活性测定及校正的准确性,实现溯源式管理,应科学开展室间质评,深入开展相关工作。
[1]王清涛,童清,郭健.血清酶测定结果可溯源性研究[J].中华检验医学杂志,2003,26(12):761-763.
[2]徐国宾,吴南,王清涛.要重视血清酶学测定的标准化工作[J].临床检验杂志,2007,25(3):161-164.
[3]Schumann G,Bonora R,Ceriotti F,et al.IFCC primary reference procedures for the measurement of catalytic activity concentrations of enzymes at 37 degrees C.International Federation of Clinical Chemistry and Laboratory Medicine.Part 6.Reference procedure for the measurement of catalytic concentration of gammaglutamyltransferase[J].Clin Chem Lab Med,2002,40(7):734-738.
[4]Recommendations of the German Society for Clinical Chemistry.Standardisation of methods for the estimation of enzyme activities in biological fl uids.Experimental basis for the optimized standard conditions[J].Z Klin Chem Klin Biochem,1972,10(6):281-291.
[5]孟泽,王毓三.中华医学会检验学会的碱性磷酸酶(ALP)催化活性浓度测定的推荐方法(讨论稿)[J].临床检验信息导报, 1997,(1):5-19.
[6]Calibrators in Clinical Engymology(Prepared w ith purified human originated enzymes)Human Enzymes(For use as ERMS,Calibrators and control serums)[EB/OL].[2007-05-09][2015-04-08].http://asahi kasei.co.jp/shindan/eng/jproduct1/index.htm l.
[7]Tietz NW,Rinker AD,Shaw LM,et al.IFCC methods for the measurement of catalytic concentration of enzymes Part 5.IFCC method for alkaline phosphatase(orthophosphoric-monoester phosphohydrolase,alkaline optimum, EC 3.1.3.1)[J].J Clin Chem Clin Biochem,1983,21:731-748.
[8]张秀明,庄俊华,徐宁,等.不同检测系统血清酶测定结果的偏倚评估与可比性研究[J].中华检验医学杂志,2006,29(4):346-349.
[9]Férard G,Edward J,Kanno T,et al.Validation of an enzyme calibrator-an IFCC guideline.International Federation of Clinical Chem istry[J].Clin Biochem,1998,31(6):495-500.
[10]张志强,血细胞分析仪校准系数变化分析[J].中国医疗设备,2014,29(5):61-63.
Research on the Traceability of the Serum A lkaline Phosphatase Determ ination Results
WANG Wei-bing
Capital M edical University, Beijing 100069, China
An exam ination to the traceability of alkaline phosphatase(ALP)activity discovered that laboratory ALP activity measurement results existed big differences from the fixed value of enzyme reference material, and higher or lower system errors existed between ALP kits from different sources.This review analyzed the reason of these system errors, indicated that the key in fl uencing factor was buffer system type in ALP assay.Taking ALP as an example, it indicated that traceability, calibration and external laboratory quality assessment of serum enzymes activity measurement must consider every element of the detecting system, including performance quality of reagent kit and parameter settings of analyzer.
alkaline phosphatase;biochem ical analyzer;determ ination of the enzyme activity;result traceability;room quality assessment
R197.39
A
10.3969/j.issn.1674-1633.2015.12.013
1674-1633(2015)12-0049-04
2015-04-08
作者邮箱:wanglei@ccmu.edu.cn

