氟西汀治疗糖尿病痛性神经病变的疗效分析
秦永章 柯瑞琼 肖丽霞 方向南 洪世华 吕维名
[摘要] 目的 观察氟西汀治疗糖尿病痛性神经病变的临床疗效。 方法 将2014年1月~2015年1月我院收治的60例糖尿病合并糖尿病痛性神经病变患者随机分为治疗组(A组)和对照组(B组),每组各30例,A组患者给予氟西汀治疗,B组患者给予安慰剂治疗,治疗观察8周,比较治疗前后血糖水平、测量正中神经、腓总神经运动神经传导速度及感觉神经传导速度。 结果 治疗组的临床缓解率明显高于对照组,治疗组患者的正中神经感觉传导速度、腓总神经感觉传导速度显著加快,且优于对照组(P<0.05),而对照组无明显变化。两组患者治疗前后FBG、2 hPG比治疗前下降但差异无统计学意义(P>0.05)。 结论 采用氟西汀治疗糖尿病伴痛性神经病变效果明显,还可控制血糖,值得临床推广。
[关键词] 氟西汀;糖尿病;痛性神经病变
[中图分类号] R587.2 [文献标识码] B [文章编号] 1673-9701(2015)28-0053-03
糖尿病痛性神经病变(painful diabetic peripheral neuropathy,PDPN)作为糖尿病最常见的神经系统并发症之一,随着病程的延长,患病率也显著升高,且男女发病率相近,调查显示13%~24%糖尿病患者合并PDPN[1,2]。研究证实一旦确诊糖尿病痛性神经病变,5~10年内死亡率高达25%~50%[3]。临床上糖尿病病发后抑郁也成为常见合并症,患者不良情绪会对其康复产生负面的影响,严重影响着患者的健康状况和生活质量[4]。5-羟色胺(5-HT)作为一种重要的神经递质与胰岛素共同储存在胰岛β细胞中[5],在维持体内葡萄糖内环境稳态中发挥重要作用[6],此外5-HT 是治疗糖尿病周围神经病变及抑郁症的共同联结体[7]。临床上常用的选择性5-羟色胺再摄取抑制剂能提高大脑和脊髓中 5-HT 和 NE 浓度,从而抑制大脑和脊髓疼痛传导通路过度兴奋,提高疼痛阈值,以达到镇痛效果[8],为氟西汀应用于治疗糖尿病痛性神经病变提供了理论支持,目前氟西汀广泛用于治疗抑郁性精神障碍[9],关于其改善2型糖尿病情绪障碍及糖尿病合并急性脑梗死患者血糖的研究已有报道[10,11],但尚未见其对2型糖尿病痛性神经病病变的报道,故本研究拟通过将氟西汀应用于2型糖尿病合并痛性神经病变患者,探讨其治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
选取本院2014年1月~2015年1月收治的病程8~12年的2型糖尿病合并痛性神经病变患者60例(男/女:28/32),年龄45~72岁,平均(54.1±3.4)岁。入组患者均符合1999年WHO糖尿病診断标准[12],且HbA1c<7.0%,显著的自发性神经疼痛、麻木等神经系统病变表现,疼痛视觉模拟评分>4分,肌电图结果显示腓总神经传导运动速度及正中神经传导感觉速度异常,近4周内未行糖尿病痛性神经病变的任何相关治疗,入组患者排除严重的心、肝、肾等重要脏器严重疾病,排除妊娠或准备妊娠、哺乳期妇女,经期不规律的患者。将60例患者随机分为治疗组(A组)和对照组(B组),A组:30例(男/女:15/15),年龄45~71岁,平均(53.2±4.3)岁,B组30 例(男/女:13/17),年龄46~72岁,平均(54.3±3.7),两组患者入组基线的空腹血糖(FBG)、餐后2 h血糖(2hPG)、糖化血红蛋白(HbA1c)、年龄等一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 研究方法
入组患者均行糖尿病患者教育,治疗过程中保持饮食与运动方案不变,维持原有降糖的基本治疗方案,A组患者在上述基础上采用氟西汀(百忧解,20 mg×28片,礼来苏州制药有限公司,国药准字J20120001)治疗,每日 20 mg,Qd;B 组患者给予空白安慰剂,共治疗8周。治疗期间严禁使用扩张末梢血管药、止痛药及其他治疗糖尿病神经疾病药物。第0周和第8周抽血检测空腹血糖(FBG)、餐后2 h血糖(2hPG)。采用 Neuropack 2型电位仪于治疗前后测定运动神经传导速度(MNCV)及感觉神经传导速度(SNCV)。
1.3 观察指标
观察两组患者治疗前后的FBG、2hPG、MNCV、SNCV及视觉模拟疼痛评分。其中空腹血糖控制目标:(4.0~6.1)mmol/L,餐后 2 h 血糖为(6.1~11.1)mmol/L。MNCV、SNCV的参考范围为:(50~70)m/s。
1.4 疗效判定[13]
评分采用疼痛视觉模拟评分评估,0 分无疼痛感,1~3 分轻度疼痛,4~6 分重度疼痛,7~9 分重度疼痛,10 分疼痛剧烈。
1.5 统计学方法
所有数据采用 SPSS16.0统计学软件处理,计量资料以(x±s)表示,组间比较采用独立样本t检验,治疗前后比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组血糖水平比较
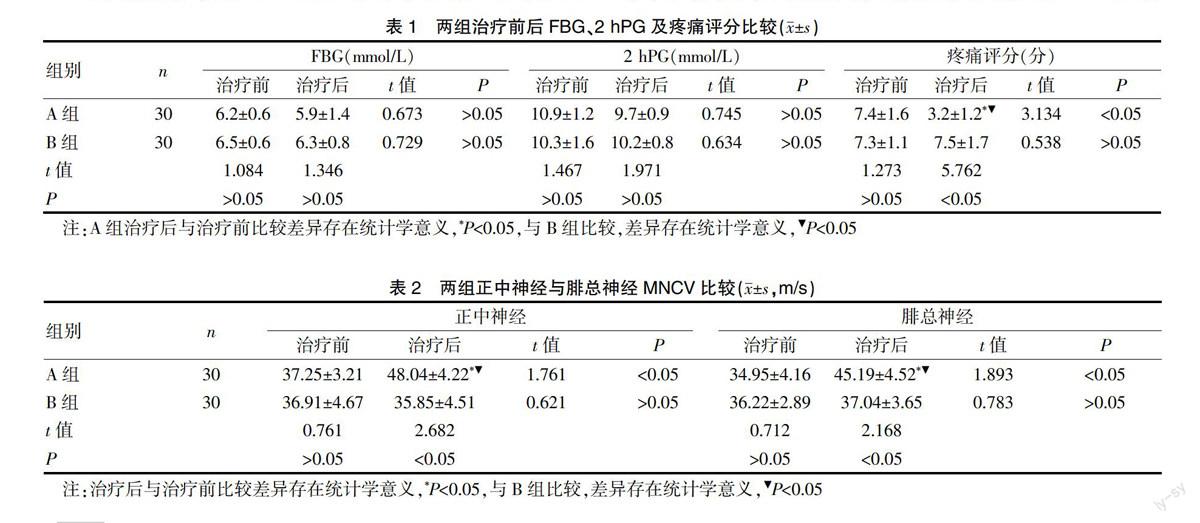
治疗8周后,两组患者的FBG、2hPG较治疗前下降,但差异无统计学意义(P>0.05)。见表1。
2.2 两组疼痛评分比较
A组患者治疗后疼痛显著改善,评分显著下降(P<0.05),而B组的疼痛评分升高,见表1。
2.3 两组运动和感觉经神经传导速度比较
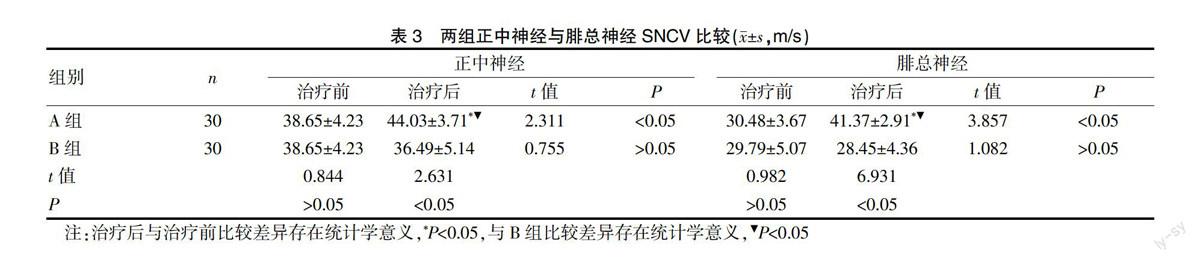
两组治疗前正中神经及腓总神经MNCV、SNCV比较差异无统计学意义(P>0.05)。经过8周治疗后,A组正中神经及腓总神经 MNCV、SNCV较治疗前显著增快(P<0.05),且快于B组,差异具有统计学意义(P<0.05)。见表2、3。
3讨论
随着糖尿病发病率增加,作为糖尿病神经系统并发症之一的糖尿病合并痛性神经病变(PDPN)发病也呈现不断上升的趋势,临床上多以肢体感觉异常、对称性疼痛、呈持续性或间歇性发作,疼痛主要体现为烧灼样痛、针刺样痛等,严重影响患者的生活,目前关于其作用机制报道较多,但无统一明确的定论,有研究报道高血糖与神经病变的发生、发展关系密切[14],其可能与糖尿病代谢紊乱导致的多元醇旁路激活、蛋白质非酶糖基化产物的形成、氧化应激、己糖胺途径、核因子KB探路及蛋白激酶C激活等有关。此外,一些神经调节肽,包括降钙素基因相关肽、去甲肾上腺素、P物质及 5-羟色胺水平增高等也可能与疼痛有关[15]。有研究报道,5-羟色胺(5-HT)和去甲肾上腺素(NE)内源性疼痛抑制通路调节失衡也在 PDPN的发病机制中起重要作用[16,17]。
关于糖尿病痛性神经病变的治疗目前尚无针对性治疗方法,临床中还是多以降糖的同时改善疼痛为主要的手段,目前临床上用于缓解PDPN的治疗药物为FDA批准的度洛西汀[3,18]。氟西汀作为选择性五羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors,SSRI)的代表性药物,多用于治疗脑卒中后抑郁、焦虑、失眠等疾病。其用于治疗抑郁的机制为通过抑制神经突触细胞对神经递质血清素的再吸收以增加细胞外可以和突触后受体结合的血清素水平,从而达到抗抑郁的作用。目前关于其如何改善抑郁及促进神经功能康复的报道较多,而关于其治疗PDPN的国内研究较少,基于治疗PDPN的理论及临床实践支持,本研究推测氟西汀(临床中常用的选择性5-HT再摄取抑制剂)在治疗糖尿病患者抑郁的同时,可能改善其痛性神经病变。
本研究采用氟西汀应用于2型糖尿病合并痛性神经病患者,研究结果表明A组患者的血糖水平有所降低但与治疗前无显著性差异,与文献报道一致[11]。而正中神经及腓总神经的运动神经传导速度及感觉神经传导速度较治疗前显著改善,并且优于B组,提示在2型糖尿病合并痛性神经病变的治疗中,加用氟西汀治疗时不仅改善患者抑郁的精神状态的同时,而且可以显著改善神经功能并减轻患者的疼痛,是临床值得推荐的一种治疗方案。
[参考文献]
[1] Aszmann O,Tassler PL,Dellon AL. Changing the natural history of diabetic neuropalhy:Ineidence of ulcer amputation in the contralateral limb of patients with a unilateral nerve decompression proeedure[J]. Ann Plast Surge,2004, 53(6):517-522.
[2] 葛梅凌. 卡马西平治疗糖尿病痛性周围神经病变34 例临床疗效分析[J]. 中医临床研究,2012,7(3):90-92.
[3] 李琴,李兴,张庙生. 盐酸度洛西汀联合硫辛酸治疗糖尿病痛性神经病变的疗效分析[J]. 中国医疗前沿, 2013, 8(8): 6-8.
[4] 陈慧敏,赵峥,蒋玉卉,等. 氟西汀和多虑平治疗糖尿病伴情绪障碍的对照研究[J]. 新乡医学院学报,2008,11(1):5-6.
[5] Ekholm R,Ericson LE,Lundquist I. Monoamines in the pancreatic islets of the mouse.Subcellular localization of 5-hydroxytryptamine by electron microscopic autoradiography[J]. Diabetologia,1971,(7):339-348.
[6] Lam DD,Heisler LK. Serotonin and energy balance:Molecular mechanisms and implications for type 2 diabetes[J]. Expert Rev Mol Med,2007,(9):1-24.
[7] 張鑫蕊. 5-羟色胺与糖尿病周围神经病变伴发抑郁的关系[D]. 大连医科大学,2014.
[8] 毛庆祥,杨天德. 度洛西汀治疗疼痛的研究进展[J]. 中国新药与临床杂志,2008,27(4):292-295.
[9] 萧焕明,施梅姐,池晓玲. 373例乙肝肝硬化失代偿期患者证候与客观指标的相关性研究[J]. 辽宁中医杂志,2012,39(10):1909-1912.
[10] 曾秀琴. 氟西汀治疗对糖尿病伴情绪障碍的疗效观察[J].中国医学创新,2012,9(32):22.
[11] 何奕涛,蔡智立,杨焱,等. 氟西汀对2型糖尿病合并急性脑梗死患者血糖的影响[J]. 中国神经精神疾病杂志,2014,40(10):690-691.
[12] 李玉秀,赵维纲,罗邦尧. 格列美脲治 2型糖尿病有效性和安全性的临床观察[J]. 中华内分泌代谢杂志,2002,18(2):152-154.
[13] 从莉萍. 氯诺昔康联合卡马西平治疗痛性糖尿病神经病变疗效观察[J]. 中国实用医刊,2011,38(6):98-99.
[14] Iyer S,Tanenberg RJ. Pharmacologic management of diabetic peripheral neuropathic pain[J]. Expert Opinion on Pharmacotherapy,2013,14(13):1765-1775.
[15] 邓存浩. 卡马西平治疗糖尿病痛性神经病变的临床疗效观察[J]. 现代诊断与治疗,2014,25(14):3234-3236.
[16] Genuth S. Insights from the diabetes control and complications trial/epidemiology of diabetes interventions and complications study on the use of intensive glycemic treatment to reduce the risk of complications of type 1 diabetes[J]. Endocrine Practice,2006,(12):34-41.
[17] Turner RC,Holman RR,Cull CA,et al. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes(UKPDS 33)[J]. Lancet,1998, 352(9131):837-853.
[18] 甄燕,高素红,武春林,等. 度洛西汀联合甲钴胺治疗痛性糖尿病周围神经病变的临床疗效观察[J]. 临床合理用药,2015,8(2A):82-83.
(收稿日期:2015-07-06)

