MonoTrap法捕集白木香愈伤组织挥发性成分及其GC—MS分析
张珂 陈华姑 龚胜 孙海燕 王健
海南大学园艺园林学院热带作物种质资源保护与开发利用教育部重点实验室 海南海口 570228
摘 要 采用新型材料MonoTrap作为顶空固相萃取的吸附剂,捕集茉莉酸甲酯(MeJA)处理后的白木香愈伤组织挥发性成分,并应用GC-MS分析测定其化学成分及相对含量。结果表明,从MeJA不同处理下的白木香愈伤组织中共鉴定出56种挥发物成分,主要成分为脂肪烃类、芳香族类和倍半萜类等成分;通过正交实验法确定最佳捕集方法为:不破碎愈伤组织材料,于30 ℃条件下、采用MonoTrap捕集6 h。MonoTrap法结合气质联用具有高灵敏度、强针对性和可操作性强的优点,可以为白木香的开发利用提供理论依据。
关键词 白木香;愈伤组织;挥发性成分;MonoTrap;气相色谱-质谱
中图分类号 R284 文献标识码 A
GC-MS Analysis on the Volatile Constituents Adsorbed with Mono Trap from Callus of Aquilaria sinensis(Lour.)Gilg.
ZHANG Ke, CHEN Huagu, GONG Sheng, SUN Haiyan, WANG Jian*
College of Horticulture & Landscape Architecture, Hainan University,/Key Laboratory of Protection and Development
Utilization of Tropical Crop Germplasm Resources, Ministry of Education, Haikou, Hainan 570228, China
Abstract A novel material MonoTrap was used as the adsorbent of headspace solid phase extraction to absorb the volatile constituents from the MeJA-treated callus of Aquilaria sinensis. Then, the chemical constituents and relative contents of the volatile components were analyzed by GC-MS. The results showed that there were 56 compounds found in the MeJA-treated callus of A. sinensis, in which, the main constituents were aliphatic hydrocarbons, sesquiterpenoids and aromatics. The best absorbing method according to the results of orthogonal experimental was: non-broken callus materials, 30 ℃, absorbing for 6 h. MonoTrap coupled with GC-MS had advantages of high sensitivity, strong pertinence and operability. The study can provide a simpler and more flexible method for the volatile constituents analysis of A. sinensis(Lour.)Gilg.
Key words Aquilaria sinensis(Lour.)Gilg;Callus;Volatile components;MonoTrap;Gas Chromatography-Mass Spectrometry
doi 10.3969/j.issn.1000-2561.2015.08.024
白木香[Aquilaria sinensis(Lour.)Gilg.]又名土沉香、牙香树、女儿香、香材、芫香,为瑞香科(Thymelaeaceae)沉香属(Aquilaria)植物,是一种热带、亚热带常绿乔木,产于广东、海南、广西、福建等省区[1]。其含树脂的木材称为沉香,为《中国药典》收载的品种;味辛、苦、温,归脾、胃、肾经,具有降气、温中、暖肾助阳的功能;主治胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急等症[2]。长期以来由于森林资源、生态环境遭受自然灾害和人为破坏,白木香野生资源破坏极其严重,濒临灭绝,现已被列为国家三级珍稀濒危保护植物及国家二级重点保护野生植物[3-4],并被载入《中国植物红皮书》[5],为中国特有的珍贵药用植物。
沉香药效的主要有效成分是沉香挥发油,以倍半萜类和芳香族化合物为主,此外还含有脂肪酸及脂肪烷类等物质[6]。近年来,有学者提出“白木香防御反应结香假说”和“激发子诱导结香假说”[7-8],认为茉莉酸甲酯(MeJA)作为“激发子”可诱导白木香产生防御反应,生成具有抑菌活性的防御类物质,参与调节次生代谢产物途径。日本学者Ito等[9],Okudera[10]在无菌条件下,将MeJA加入白木香悬浮细胞中,诱导产生了α-愈创木烯(α-guaiene)、α-葎草烯(α-humulene)和δ-愈创木烯(δ-guaiene)。Xu等[11]采用固相微萃取技术(SPME)结合GC-MS检测分析白木香愈伤组织挥发性成分,在未经处理的健康的白木香愈伤组织中只发现有α-愈创木烯和δ-愈创木烯2种倍半萜;在MeJA处理后的白木香愈伤组织中发现有4种倍半萜,这些物质可能是白木香防御类物质和沉香类前体物质。
目前,白木香少量组织的挥发性成分的鉴定主要用SPME技术[9-11]。SPME技术是一种新型的无溶剂样品预处理技术,但存在价格昂贵、萃取头易碎且需要进行高温解吸处理、聚合物图层性质不稳定、易产生样品携带等缺陷[12]。固相萃取整体捕集剂MonoTrap是用于捕集和萃取的新生代介质,是集硅胶、活性炭、ODS特性为一体的高交联性新吸附剂,优点在于其硅胶骨骼里混合了活性炭,对极性物质、低沸点物质、芳烃的吸附有很大作用;可吸附包括在任何基质中的挥发性、不挥发性、极性(中性或酸性)、非极性、液态及气态物质;既可用少量有机溶剂萃取,也可用热脱附共色谱分析,十分适合少量和微量材料的挥发性成分捕集,不需要对萃取成分进行高温解吸处理,且方便携带,比常用的SPME使用方法更灵活,灵敏度更高[13],在香味成分、食品、环境的浓缩分析、筛选分析中,作为捕集工具的使用越来越多[14]。
笔者采用MonoTrap法捕集经过MeJA处理的白木香愈伤组织挥发性成分,通过气相色谱-质谱联用技术(GC-MS)对其化学成分进行分析研究,探索该检测方法的有效捕集条件,验证该方法检测白木香愈伤组织挥发性成分的有效性,为进一步开发利用白木香提供科学依据。
1 材料与方法
1.1 材料
供试白木香采自海南大学农科实验基地;愈伤组织由本实验室用三年生白木香幼嫩茎段诱导培养生成。
HP6890/5973型GC/MS气相色谱质谱联用仪(美国惠普公司);ABJ220-4M电子分析天平(德KERN);KQ-50B型超声波清洗器(昆山市超声仪器有限公司);QYN100-2氮吹仪(上海乔跃电子有限公司);固相萃取整体捕集剂DCC18 MonoTrap(上海岛津GL生物技术有限公司)。
1.2 方法
1.2.1 MonoTrap法捕集白木香愈伤组织挥发性成分 将白木香愈伤组织转接入含100 μmol/L MeJA的培养基中培养7 d。在单因素试验基础上,设置吸附时间(A)、温度(B)、材料处理(C)3个因素作为变量,采用L9(34)正交表优化试验条件。各因素设3个水平:吸附时间设1、6、12 h;温度设30、60、40 ℃;材料处理设机械破碎,不破碎和室温下风干0.5 h。各处理均准确称取0.6 g经MeJA处理后的愈伤组织,按试验设计进行材料处理,分别放入20 mL样品瓶里,将1片MonoTrap DCC18悬于样品瓶中的顶空固定架上,按试验设计温度与时间,顶空捕集白木香愈伤组织挥发性成分。挥发性成分采集完成后,将MonoTrap取出置于塑料衬管中,加二氯甲烷1mL超声萃取5 min,取上清液于1.5 mL离心管中,氮吹浓缩至100 μL,作为GC-MS检查样品。
1.2.2 GC-MS分析条件 气相色谱条件:色谱柱为HP-5MS 5%Pheny Methy Siloxane(30 m×0.25 mm×0.25 μm)弹性石英毛细管柱,柱温60 ℃(保留2 min),以6 ℃/min升至300 ℃,保持4 min,汽化室温度250 ℃;载气为高纯He(99.999%),柱前压0.526 bar,载气流量1.0 mL/min;进样量1 μL;分流比20 ∶ 1。
质谱条件:离子源为EI源;离子源温度为230 ℃;四极杆温度150 ℃;电子能量70 eV;发射电流34.6 μA;倍增电压837 V;接口温度280 ℃;质量范围50~500 amu。
1.3 数据统计与分析
1.3.1 正交试验数据统计 正交试验结果以有无捕集到倍半萜类物质为考核指标进行评分,捕集到0种的处理记1分,捕集到1种的处理记3分,捕集到2种的处理记6分,捕集到3种的处理记9分,捕集到4种的处理记10分。根据试验结果进行正交试验的直观分析与方差分析。
1.3.2 GC-MS分析与鉴定 用毛细管色谱法对白木香愈伤组织挥发性成分进行分离及含量分析;用色谱峰面积归一化法测得各组分的相对含量;用气相色谱-质谱总离子流色谱检测得GC-MS总离子流图;所得色谱和质谱信息利用计算机NIST11.L质谱数据库自动检索和人工解析,确定化合物名称及相对含量。
2 结果与分析
2.1 MonoTrap法萃取最佳条件的确定
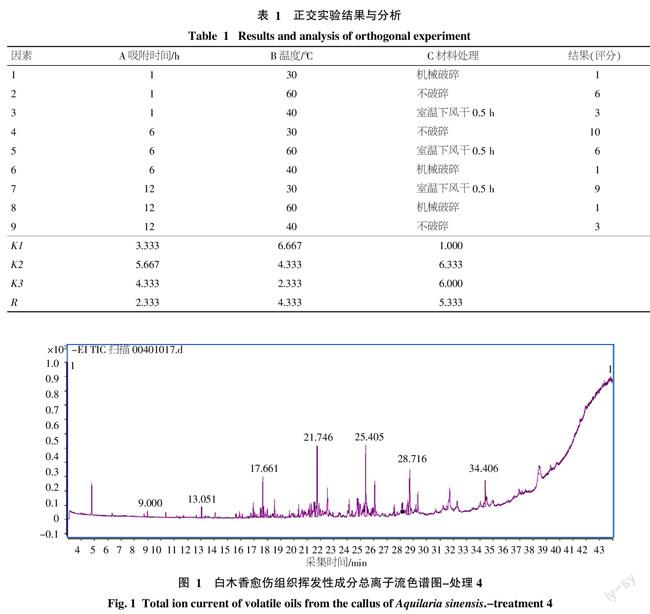
最佳萃取条件的正交试验结果见表1。通过对表1相关数据进行直观分析可见:A2>A3>A1,B1>B2>B3,C2>C3>C1,A2,B1,C2的水平较好,最佳萃取组合为A2B1C2;3因素对愈伤组织挥发性成分的影响顺序为C>B>A。根据以上结果,确定MonoTrap法顶空捕集白木香愈伤组织挥发性成分的条件为:不破碎愈伤组织材料,于30 ℃捕集6 h。
2.2 气相色谱-质谱的分析与鉴定
经过正交试验处理,分别获得9个捕集条件下白木香愈伤组织挥发性成分总离子流图(图1)。
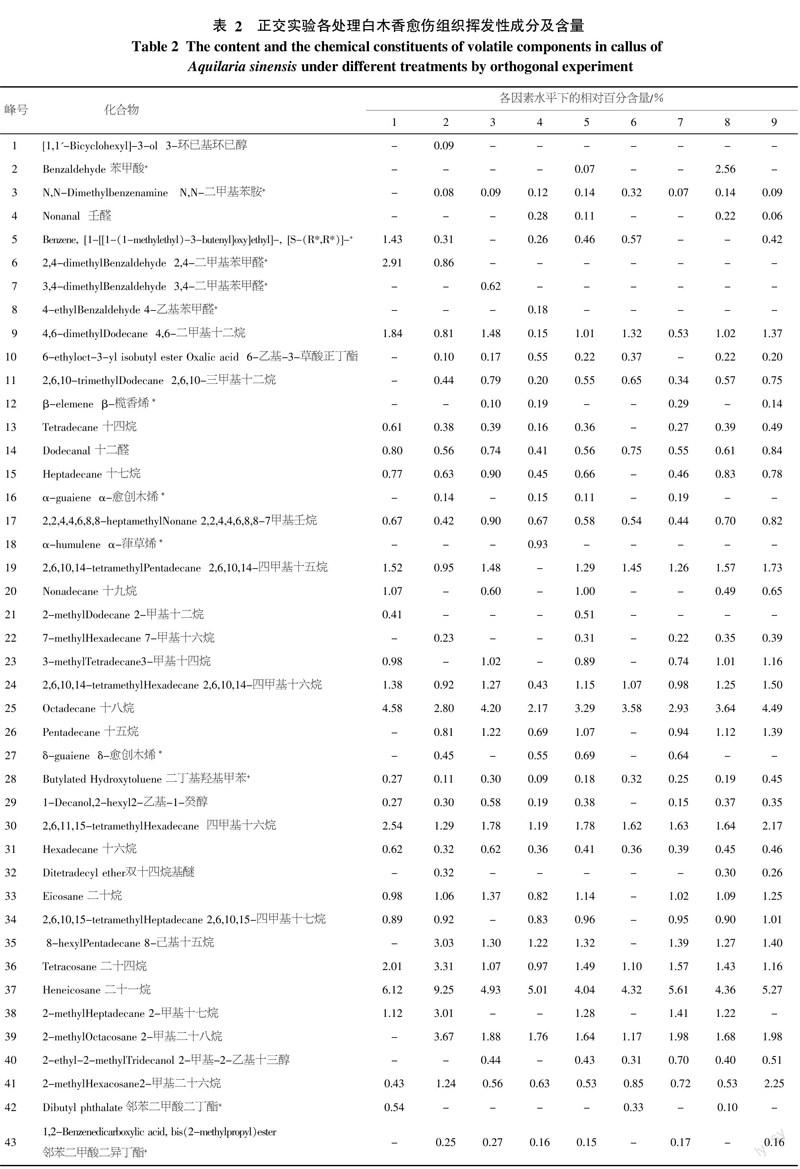
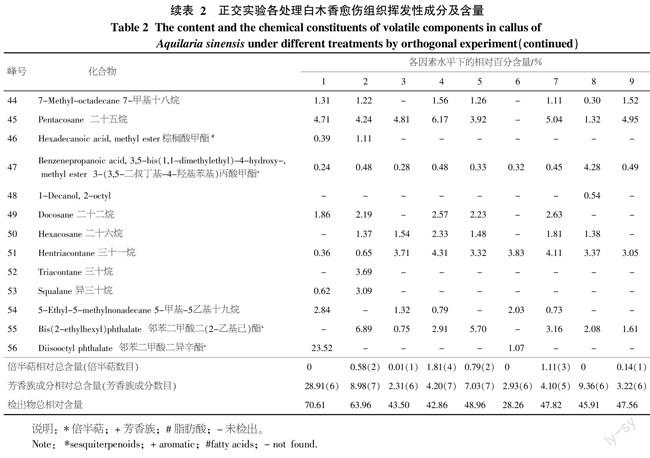
对9个处理获得的挥发性物质进行分析合并,将其名称及相对含量按照保留时间排列顺序如表2。实验共鉴定出Monotrap捕集不同处理下白木香愈伤组织中的56个化合物,占挥发性物质总量的48.83%。由表2可知,白木香愈伤组织挥发性成分中脂肪烃类含量最高,平均含量达38.57%,其次为芳香族类,平均含量达7.90%,9个处理共检出4种倍半萜成分。十八烷、二丁基羟基甲苯、四甲基十六烷、二十一烷、二十四烷和3-(3,5-二叔丁基-4-羟基苯基)丙酸甲酯等化合物在9种处理中均能检出,相对百分含量也大致相同,说明这些成分在不同捕集条件下挥发比较稳定。而个别挥发性成分在不同处理中差异相当大,如邻苯二甲酸二异辛酯仅在处理1和6中检出,且含量差异很大,说明该成分对不同的捕集条件比较敏感。
对检测到的β-榄香烯、α-愈创木烯、α-葎草烯、δ-愈创木烯4种倍半萜类物质的分析结果如下:处理1、6和8为破碎愈伤组织材料,均未能检测出,说明材料破碎会极大影响倍半萜成分的挥发;处理3和9为40 ℃条件下萃取,均有检测出β-榄香烯,处理2和5为60 ℃条件下萃取,均有检测出α-愈创木烯和δ-愈创木烯,说明不同温度处理可影响倍半萜类化合物种类的萃取;处理7检测出β-榄香烯、α-愈创木烯、δ-愈创木烯3种倍半萜成分;处理4检测出β-榄香烯、α-愈创木烯、α-葎草烯、δ-愈创木烯4种倍半萜成分,且仅有处理4检出了α-葎草烯。总体来看,这4类倍半萜成分对捕集条件比较敏感。
3 讨论与结论
从本研究结果看,所有愈伤组织破碎条件下的处理都没有检测出倍半萜类特征性成分,可见愈伤组织破碎可严重影响倍半萜类物质的检出,可能是因为萜烯类化合物极不稳定,在细胞破碎时发生了一系列化学反应[15]。本试验结果也表明萃取温度和吸附时间均对白木香愈伤组织挥发性成分有一定影响。从吸附时间结果来看,吸附6 h的检出效果好于吸附1 h, 说明随着处理时间增加,愈伤组织挥发的倍半萜类种类增加,符合挥发物随时间增加而增多的一般规律,但到了12 h又有所下降(表1),原因可能是长时间处理下,Monotrap吸附材料对萜烯类的吸附能力加强,导致后期二氯甲烷对这些成份洗脱困难而不易检测出。从吸附温度来看,高温条件下检出效果明显比30 ℃时差(表1),说明高温会减少萜烯类成份的挥发与检测,可能是愈伤组织细胞在高温胁迫下,随胁迫时间增加,细胞活力逐渐降低,膜质过氧化程度逐渐增加[16],导致倍半萜类物质的损失。总体来看,白木香愈伤组织挥发性成份中倍半萜类成分含量很低且稳定性较差(表2),因此对材料前期处理比较敏感,破碎、高温、吸附时间过长均会减少其检出效果,所以检测时材料应保持自然状态。白木香是一种典型的伤害诱导型药用植物,只有在伤害等胁迫条件或外界刺激诱导下才能够在其木质部内产生倍半萜等沉香类物质[17]。戚树源等[18]分析检测在健康白木香木材组织中没有沉香倍半萜类成分,其主要成分为棕榈酸、油酸和亚油酸等脂肪酸与本研究检测到的挥发性成分有较大的差异,证明诱导作用是产生这些防御类物质和沉香倍半萜类前体物质的重要条件。Ito等[9-10,17]在经过MeJA处理的白木香悬浮细胞或茎干中,检测到了α-愈创木烯(α-guaiene)、α-葎草烯(α-humulene)和δ-愈创木烯(δ-guaiene)等成分,与本研究结果类似。但这些研究中一般只检测到3种倍半萜类物质,而本研究则检测出4种倍半萜类物质,在白木香愈伤组织检测出β-榄香烯,说明本方法具有更高的灵敏性。β-榄香烯具有气特异、微香的特性,同时β-榄香烯还具有抑制转移、抗多药耐药、抗肿瘤免疫、化疗增效、放疗增敏等作用[19]。
本研究结果也可以看出,不同的处理检测出的成分种类及含量有较大的差异,说明该方法对捕集条件灵敏地响应。由于白木香不同品种、不同部位作为外植体,不同培养条件,不同诱导方式等因素,会导致愈伤组织中倍半萜和芳香族物质种类和含量存在较大差异,因此不同条件下白木香愈伤组织中倍半萜成分检测的捕集条件还需要进一步有针对性的优化,才能获得更为理想的结果。
参考文献
[1] 中国科学院“中国植物志”编辑委员会. 中国植物志[第52(1)卷][M]. 北京: 科学出版社, 1999: 290.
[2] 中华人民共和国药典编委会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2010: 128-129.
[3] 国家环境保护局, 中国科学院植物研究所.中国珍稀濒危保护植物名录(第一册)[M]. 上海: 上海科技教育出版社, 1987: 94.
[4] 国家林业部, 国家农业部.国家重点保护野生植物名录(第一批)[S]. 1999年8月4日国务院批准[J]. 环境教育, 2008(7): 84.
[5] 中国科学院植物研究所. 中国植物红皮书-稀有濒危植物[M]. 北京: 科学出版社, 1992: 670-671.
[6] 郭晓玲,田佳佳,高晓霞,等. 不同产区沉香药材挥发油成分GC-MS分析[J]. 中药材, 2009, 32(9): 1 354-1 358.
[7] 张 争, 杨 云, 魏建和,等. 白木香结香机制研究进展及其防御反应诱导结香假说[J]. 中草药, 2010, 41(1): 156-159.
[8] 朱智强. 白木香的结香机理及造香技术[J]. 热带林业, 2013, 41(3): 31-33.
[9] Ito M, Okimoto K, Yagura T, et al. Induction of sesquiterpenoid production by methyl jasmonate in Aquilaria sinensis cell suspension culture[J]. Journal of Essential Oil Research, 2005, 17: 175-180.
[10] Okudera Y, Ito M. Production of agarwood fragrant constituents in Aquilaria calli and cell suspension cultures[J]. Plant Biotechnology, 2009, 26: 307-315.
[11] Xu Y H, Zhang Z, Wang M X, et al. Identification of genes related to agarwood formation: transcriptome analysis of healthy and wounded tissues of Aquilaria sinensis[J]. BMC Genomics,2013, 14: 227.
[12] 汪瑾彦, 陈大舟, 汤 桦,等. 水体沉积物和土壤中多环芳烃的分析方法研究[J]. 现代仪器, 2010, 16(2): 11-15.
[13] 佐藤睦, 外丸腾彦, 武田まなゐ,等. 运用新生代型整体构造高交联吸附剂“MonoTrap”进行样品捕集、 加热脱附、 有机溶剂萃取的方法研讨[C]. 第十七届全国色谱学术报告会论文集,2009: 868-868.
[14] 王 晨. 不同桂花品种的香气成分分析及红外光谱鉴定模型初步建立[D]. 南京: 南京林业大学, 2012.
[15] 张赟彬, 缪存铅,崔俭杰. 吹扫/捕集-热脱附气质联用法对荷叶挥发油成分的对比分析[J]. 化学学报, 2009, 67(20): 2 368-2 374.
[16] 巩慧玲. 植物愈伤组织对高温胁迫的生理响应及G6PDH对高温适应的调节机理研究[D]. 兰州: 兰州大学, 2011.
[17] 张 争, 杨 云, 魏建和,等. 白木香茎中内源茉莉酸类和倍半萜类物质对机械伤害的响应[J]. 园艺学报, 2013, 40(1):163-168.
[18] 戚树源, 陆碧瑶, 朱亮峰,等. 白木香中白木香醛形成的研究[J]. 植物生理学通讯, 1992, 28(5): 336-339.
[19] 王宏虹, 刘华钢, 刘丽敏. β-榄香烯抗肿瘤作用机制研究概况[J]. 药物评价研究, 2009, 32(2): 140-143.

