兔关节软骨细胞原代培养及生物学鉴定
赵海洋 马子君 路 屹 陈传好
(蚌埠医学院人体解剖学教研室,安徽 蚌埠 233030)
软骨细胞是关节软骨损伤破坏以及骨关节炎(OA)等临床软骨疾病过程中的靶细胞,其生物活性变化情况是探讨关节损伤及OA等疾病中软骨细胞的破坏、病理和治疗的重要手段。体外培养软骨细胞是明了软骨细胞生物学性状的重要方法〔1〕。对软骨细胞的增殖,分化以及基质合成过程中的变化因素进行探讨,有助于我们在组织工程化软骨细胞培养与基因、蛋白水平上进行研究提供合适的条件。当前,体外培养软骨细胞技术虽已得到较高的改善和提高〔2,3〕,但尚存在步骤较为繁琐、实验投入较高等问题。如何较快地得到大量纯化软骨细胞成为实验研究的关键。本研究旨在建立软骨细胞体外培养体系并分析其生物学活性。
1 材料与方法
1.1 实验动物 清洁级4周龄新西兰幼兔,雌雄不限,由蚌埠医学院实验动物中心提供。
1.2 试剂与实验仪器 Ⅱ型胶原酶(Gibco公司),1640培养基、胰蛋白酶1∶250(Hyclone公司),胎牛血清(四季青),双抗(青霉素、链霉素),甲苯胺蓝、CCK-8(Sigma公司),兔抗人Ⅱ型胶原抗体,FITC标记山羊抗兔二抗IgG(上海生物工程有限公司)。
1.3 方法
1.3.1 兔膝关节软骨分离获取 健康4周龄新西兰幼兔腹腔麻醉,备皮,用碘伏腹部及下肢皮肤消毒,无菌操作沿膝关节剪开上下剥离皮肤,更换手术器械和手套,防止碘酒等有机物污染。打开关节腔剪断韧带暴露膝关节,刮除周围的骨膜,滑膜等组织,切取关节面软骨组织(以不渗血为度),置入盛有磷酸盐缓冲(PBS)液(含青霉素,链霉素)的无菌玻璃瓶皿内。用含双抗液的PBS液漂洗培养皿内组织块三次,用眼科剪将其剪碎至1 mm3大小的组织块。
1.3.2 软骨细胞消化 将软骨块转移至10 ml离心管内。加入5倍体积的0.25%胰蛋白酶置于37℃恒温箱内消化,每15 min震荡一次,共消化30 min。取出离心管加入含15%血清培养基终止消化,以1 200 r/min,离心5 min,弃上清。用含双抗的PBS液洗涤一遍,相同转速、时间离心,弃上清。加入0.3%Ⅱ型胶原酶3 ml,置37℃恒温培养箱内消化45 min,每15 min取出震荡一次,取出离心管加入同体积15%胎牛血清培养基终止消化,以1 200 r/min,离心5 min,弃上清。加含双抗PBS混匀,使用100目不锈钢网筛过滤,所得滤液放入另一无菌离心管内,1 200 r/min,离心5 min,弃上清,加入少量含血清的培养基吹打放置。原过滤后的组织块重新置入离心管内,如前法消化45 min,消化后的处理同上。将两次消化所取的软骨细胞混合,台盼蓝染色检测细胞活性,血球计数板计数。
1.3.3 软骨细胞培养 按(3~4)×105细胞/ml,接种于25 cm2培养瓶内。37℃恒温,5%CO2饱和湿度培养箱内培养。每3天更换培养液1次,待软骨细胞贴壁达80%后传代。传代时,倒掉培养基,用含双抗PBS液轻洗细胞2次,培养瓶内加入0.25%胰蛋白酶消化液,置恒温箱1 min左右,倒置显微镜下观察细胞回缩,间隙增大,终止消化,反复吹打瓶壁上软骨细胞,使其彻底从培养瓶壁脱落,收集细胞液,800 r/min,离心5 min,1∶2传代。
1.4 检测指标
1.4.1 软骨细胞生长情况 软骨细胞分离培养,观察细胞生长、形态、细胞密度等生物学形态拍照记录。按照CCK-8试剂盒说明,连续检测8 d,分别用酶标仪检测在450 nm处的吸光度(OD值),绘制细胞生长曲线。
1.4.2 细胞活性检测 分离培养的原代软骨细胞呈圆球形,悬浮状态,取9滴细胞悬液,加入1滴0.4%台盼蓝,充分混匀,静置5~10 min,取1滴混合液,注入血细胞计数板,计算每毫升培养液内活细胞数,检测活细胞率约90%左右。
1.4.3 甲苯胺蓝染色形态学观察 取生长状态良好的软骨细胞接种于6孔板上,置入含多聚赖氨酸的玻片爬片,弃培养液,用PBS液洗2次,直接用4%多聚甲醛固定于6孔板中1 h,4℃恒温。自来水冲洗15 min,蒸馏水洗5 min,然后加甲苯胺蓝浸染2 h,弃除多余液,倒置显微镜下观察拍照。
1.4.4 Ⅱ型胶原免疫荧光检测 取生长良好的软骨细胞6孔板内爬片,PBS液漂洗3次各5 min,4%多聚甲醛固定10 min,PBS液洗3次各5 min,5%BSA封闭30 min,加入一抗4℃过夜,PBS液漂洗3次各5 min,加入二抗37℃放置30 min以上,行显微镜下观察。
2 结果
2.1 软骨细胞生长情况 软骨细胞在原代培养的最初1~3 d增殖速度较快细胞数(×103个/ml)分别为0.970 1,1.038 6,1.166 0。4 d以后至第6天细胞增殖速度较为缓慢分别为1.205 2,1.219 1,1.218 2,进入平台期。第7天细胞增殖停滞细胞数约为1.196 2×103个/ml。兔膝关节软骨细胞原代培养,倒置显微镜下观察可见细胞在未贴壁前呈现圆球形,悬浮于培养液内。培养12 h左右,细胞开始呈现贴壁状态。48 h后绝大多数细胞贴壁,且部分细胞开始变形,细胞形态呈现多角形,均匀散在生长,出现细胞分裂相见。7 d细胞铺满培养瓶底。9 d后可进行传代。传代后细胞生长较快,细胞数量增多时可呈现“铺路石”状外观图。细胞传至第6代时,细胞呈长梭形,细胞生长缓慢,形状变得不规则,且坏死脱落细胞增多,见图1。

图1 原代软骨细胞培养不同时间点的形态变化(×100)
2.2 细胞活性检测 分离培养的原代软骨细胞呈圆球形,悬浮状态,检测活细胞率约90%左右。传代后,活性可达到95%以上。随着传代次数增多,细胞活性开始出现降低状态。
2.3 甲苯胺蓝染色 细胞爬片经甲苯胺蓝染色后,细胞周围有少量蓝紫色异染颗粒出现,胞质呈现蓝紫色,胞核呈深蓝色,核仁明显(图2)。
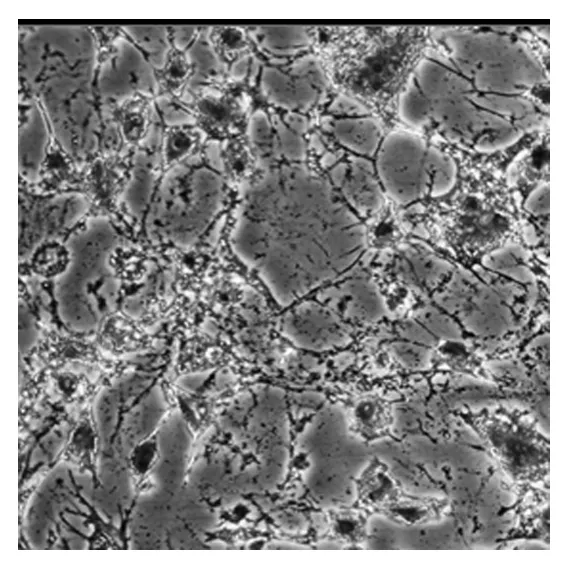
图2 原代培养的兔膝关节软骨细胞甲苯胺蓝染色(×100)
2.4 Ⅱ型胶原免疫荧光染色 Ⅱ型胶原是软骨细胞基质内的主要成分,Ⅱ型胶原的合成与分泌可作为鉴定软骨细胞的特定指标〔4〕。荧光显微镜下观察,可见典型的软骨细胞形态,软骨细胞胞质呈现绿色荧光,胞核不着色(图3)。
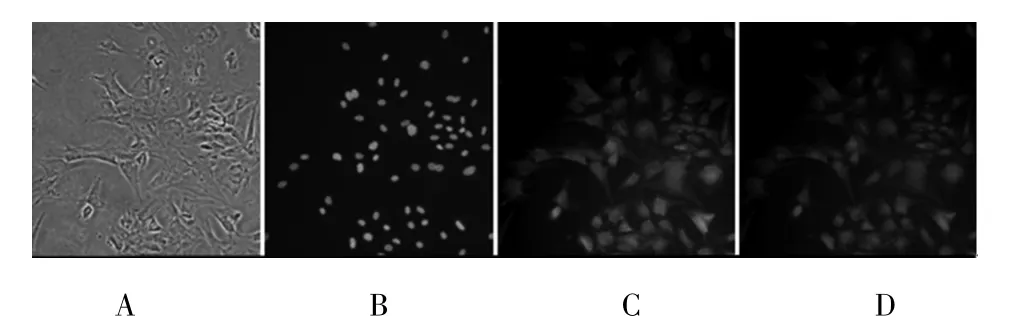
图3 原代培养的兔膝关节软骨细胞Ⅱ型胶原免疫荧光染色(×200)
3 讨论
软骨细胞是关节软骨内唯一的细胞成分,只要通过合适的机械分离和化学解离并注意培养方法,就能很好地得到较多的活性高的软骨细胞〔5〕。关节软骨表面为一层纤维膜组织,机械分离软骨细胞时注意仔细剥离。本实验结果显示,采取两种酶消化及Ⅱ型胶原酶多次消化方法可获得大量游离、纯化的兔膝关节软骨细胞。正常软骨细胞主要分泌Ⅱ型胶原及蛋白多糖,但在连续多次培养过程中,这种表型逐渐减弱消失,转化生成Ⅰ型胶原,蛋白多糖的分泌水平也会降低,即出现去分化现象〔6,7〕。且在低密度培养情况下,细胞与细胞间无法相互影响,细胞与基质失去联系,细胞因子无法提供反馈调节,细胞也会出现去分化现象,合成分泌Ⅱ型胶原能力下降,呈现成纤维细胞样变化。高密度培养,细胞形态保持良好。去分化现象较少出现〔8〕。软骨细胞没有特异性标志物,但可通过对其分泌的基质成分氨基多糖的甲苯胺蓝染色和Ⅱ型胶原的免疫荧光染色〔9,10〕。本实验在甲苯胺蓝染色后结果证实,细胞内及细胞周围可见蓝紫色异染颗粒,细胞内外GAGs均为强阳性。Ⅱ型胶原免疫荧光染色发现,细胞胞浆呈绿色,胞核不着色,为强阳性结果。结合取材部位证实本实验所提取培养观察的细胞为软骨细胞,且细胞状态良好。综上,原传代兔膝关节软骨细胞的培养方法,可以快速得到大量高纯度且增殖活性较高的软骨细胞,为进一步研究兔膝关节软骨细胞其他生物学特性及组织生物工程研究提供实验基础。
1 Tew SR,Murdoch AD,Rauchenberg RP,et al.Cellular methods in cartilage research:primary human chondrocytes in culture and chondrogenesis in human bone marrow stem cells〔J〕.Methods,2008;45(1):2-9.
2 宋卫东,刘尚礼,李卫平,等.人关节软骨细胞培养法的改良及其特有表型的检测〔J〕.中华实验外科杂志,2003;20(2):147-8.
3 孙 壮,褚立希.关节软骨细胞分离和培养及其在中医药研究中的应用进展〔J〕.上海中医药大学学报,2008;22(4):94-6.
4 Pullig O,Kladny B,Weseloh G,et al.Metabolic activation of chondrocytes in human osteoarthritis.Expression of type Ⅱ collagen〔J〕.Z Orthop Ihre Grenzgeb,1999;137(1):67-75.
5 Manning WK,Bonner WM.Isolation and culture of chondrocytes from human adult articular cartilage〔J〕.Arthritis Rheum,1967;10(3):235-9.
6 Liu G,Kawaquchi H,Oqasawara T,et al.Optimal combination of soluble factors for tissue engineering of permanent cartilage from cultured human chondrocytes〔J〕.J Biol Chem,2007;282(28):20407-15.
7 Schulze-Tanzil G.Activation and dedifferentiation of chondrocytes:implications in cartilage injury and repair〔J〕.Ann Anat,2009;191(4):325-38.
8 沈是铭,毛宾尧.关节软骨的自分泌调节〔J〕.中国矫形外科杂志,2000;7(2):173-6.
9 Weinstein T,Evron Z,Trebicz-Geffen M,et al.β-D-xylosides stimulate GAG synthesis in chondrocyte cultures due to elevation of the extracellular GAG domains,accompanied by the depletion of the intra-pericellular GAG Pools,with alterations in the GAGprofiles〔J〕.Connect Tissue Res,2012;53(2):169-79.
10 Kenzaki K,Tsuchikawa K,Kuwahara T.An immunohistochemical study on the localization of typeⅡcollagen in the developing mouse mandibular condyle〔J〕.Okajimas Folia Anat Jpn,2011;88(2):49-55.

