多生化指标联合检测预测动脉粥样硬化斑块稳定性的可行性研究
许成岗,武红斌,高俊峰,徐海宁,何文杰
随着我国人口老龄化进程的加快,心脑血管疾病成为我国人民健康最大杀手,尤其是脑卒中,其致死率及致残率均很高,严重影响我国人民的生活质量。动脉粥样硬化是脑卒中独立的危险因素,主要是因为粥样斑块的脱落引起栓塞、血栓使动脉严重狭窄致脑供血不足,因此采取积极有效措施来及早发现动脉粥样硬化的病变及识别易损的斑块,具有十分重要的临床意义[1],目前寻找血中能反映斑块不稳定的生化标志物成为研究的热门课题,有价值的生化指标有超敏C-反应蛋白(hs-CRP)、单核细胞趋化因子(MCP-1)、基质金属蛋白酶-9(MMP-9),在不同的侧面反映动脉粥样斑块的稳定性。由于单一标记物的敏感性及特异性有限,所以联合检测多种标记物将有助于提高诊断的准确性。本研究分析多种生化指标联合检测预测动脉粥样硬化斑块稳定性。
1 资料与方法
1.1 临床资料 选取2012年5月—2014年6 月经颈动脉彩超检查颈动脉粥样硬化的患者,共396例,男270例,女126 例,年 龄51 岁~76 岁(63.4 岁±6.4岁)。排除标准:①有精神性疾病或痴呆者;②躯体合并长期慢性炎症性疾病;③入组时患有感染性疾病;④有严重心、肝肾疾病或功能异常。将患者按照入院后是否发生颈动脉粥样硬化斑块失去稳定性、破裂或发生缺血性事件分为稳定组(95例)及非稳定组(301例)。两组患者在年龄、性别等一般资料差异不具有统计学意义(P>0.05)。详见表1。
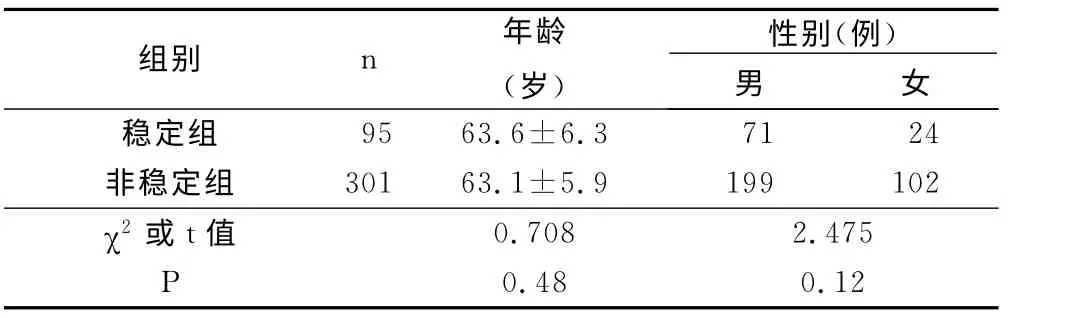
表1 两组患者一般资料
1.2 检查方法 所有患者在应用降脂药、肝素、抗血小板药物、静脉溶栓药物及低分子肝素等药物之前住院即刻抽取静脉血,留取20 mL 外周静脉血,在两支促凝管中各加入3 mL,在两只无抗凝管中各加入3 mL,进行检测hs-CRP,其余8mL 外周静脉血放置于肝素抗凝管,进行离心留取上层血浆,转速设定为3 000r/min离心1.5min,于-80℃超低温冰箱保存,标本检测前室温融化,hs-CRP、MMP-9、MCP-1三种指标集中进行检测,hs-CRP 采用免疫散射比浊法,测定由我院检验科生化室完成,检测范围为(0~3)mg/L。MMP-9采用酶联免疫吸附法,用ELISA 检测试剂盒(奥地利Bender MedSystems公司)进行检测,其检测灵敏度为0.05ng/L,BiocenHTZ酶联免疫检测仪型。MCP-1采用酶联免疫吸附法,用ELISA 检测试剂盒(奥地利Bender MedSystems公司)进行检测,检测灵敏 度 为2.3 pg/mL,BiocenHTZ 酶 联 免 疫 检 测 仪型[2]。
1.3 评价指标 测量患者hs-CRP、MMP-9、MCP-1 三种指标浓度。
1.4 统计学处理 将本组研究涉及数字录入SPSS13.0行数据分析,hs-CRP、MMP-9、MCP-1 三种指标浓度等计量资料行t检验。P<0.05为差异有统计学意义。以ROC分析判断相关指标的诊断价值,敏感性和特异性。
2 结 果
2.1 两组患者hs-CRP、MMP-9、MCP-1 指标浓度比较 与 非 稳 定 组 相 比,稳 定 组hs-CRP、MMP-9、MCP-1的浓度更低,差异具有统计学意义(P<0.01)。详见表2。
表2 两组hs-CRP、MMP-9、MCP-1 指标浓度比较

表2 两组hs-CRP、MMP-9、MCP-1 指标浓度比较
组别 n hs-CRP(mg/L)MMP-9(ng/mL)MCP-1(pg/ml)稳定组95 3.32±2.83 0.21±0.04 0.37±0.07非稳定组 301 16.24±2.42 0.27±0.03 0.49±0.05 t值43.500 15.609 18.396 P <0.01 <0.01 <0.01
2.2 两组诊断指标的ROC工作曲线 以敏感性为纵坐标,1-特异性为横坐标绘制ROC 的曲线,稳定组三种指标的ROC 曲线下面积从大到小为(hs-CRP>MCP-1>MMP-9,即0.921>0.642>0.613),非稳定组三种指标ROC曲线下面积从大到小为(MMP-9>MCP-1>hs-CRP,即0.929>0.855>0.624)。详见图1、图2。
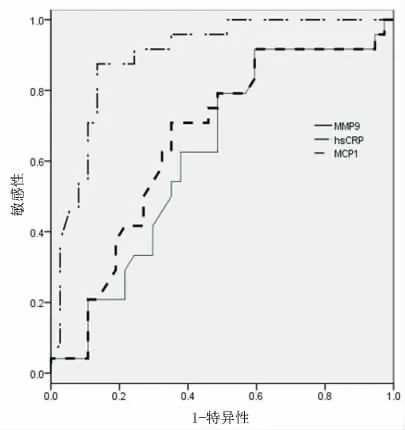
图1 稳定组三种指标ROC曲线

图2 非稳定组三种断指标ROC工曲线
2.3 三种指标的最佳检测水平及相应的敏感性和特异性 通过Youden指数测验,得出三种物质的最佳检测浓度分别hs-CRP为8.3 5mg/L,MCP-1为0.282pg/mL,MMP-9 为0.141ng/mL。在稳定组中,hs-CRP 的 敏 感 性 要 明 显 高 于MMP-9 及MCP-1,特异性三个指标的差异不显著。在非稳定组中,MMP-9、MCP-1的敏感性及特异性高于hs-CRP。详见表3。
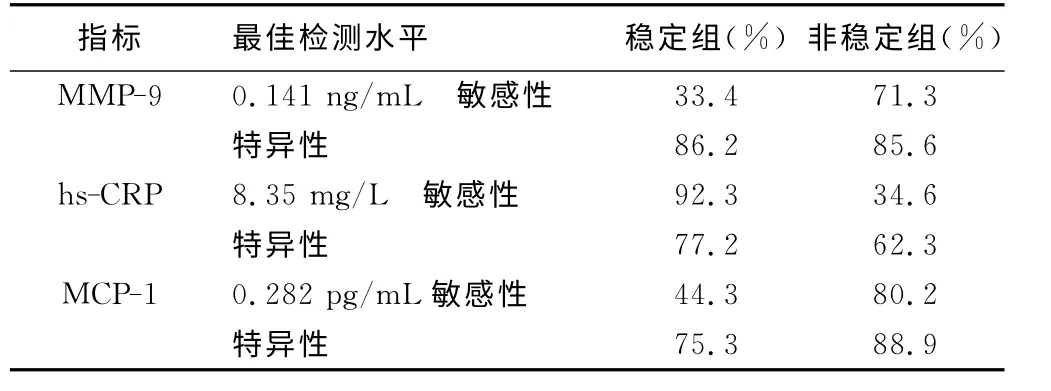
表3 3种指标最佳检测水平及相应的敏感性和特异性
2.4 三种指标联合检测稳定组及非稳定组结果 以hs-CRP>8.35mg/L,MCP-1>0.282pg/mL,MMP-9>0.141ng/mL为标准诊断稳定组的敏感性和特异性提高到97.4%、92.9%。以hs-CRP>8.35 mg/L,MCP-1>0.282pg/mL,MMP-9>0.141ng/mL 为标准诊断非稳定组的敏感性和特异性提高到94.0%、95.5%。
3 讨 论
3.1 颈动脉粥样硬化形成机制 颈动脉是动脉粥样硬化斑块的好发部位,也是便于利用现代超声成像技术观察和准确测量动脉IMT 的理想超声成像窗口,并能反映全身动脉粥样硬化的情况[3]。按粥样硬化病灶病理学特征分为易损斑块和稳定斑块,易损斑块破裂、脱落导致远端动脉管腔血栓的形成,其是脑缺血性卒中重要的形成机制,动脉粥样硬化的形成除纤维增生性病变及慢性免疫炎症性机制外[4],低密度胆固醇脂蛋白被氧化且不断沉积于动脉内膜下,形成的脂核也是其机制之一,所以炎性因子的作用及炎症细胞浸润、脂质代谢的异常及平滑肌的增生为粥样斑块形成及发展的关键病理环节[5]。
3.2 多生化指标联合检测预测动脉粥样硬化斑块稳定性结果分析 本研究显示与非稳定组相比,稳定组hs-CRP、MMP-9、MCP-1 的浓度更低,差异具有统计学意义(P<0.01),表明粥样硬化斑块稳定型患者与非稳定型患者在hs-CRP、MMP-9、MCP-1等生化指标具有明显差异,hs-CRP、MMP-9、MCP-1 可能能够预测粥样硬化斑块的稳定性,这与刘公理等[6]观点一致,推测这与三种因子的作用有关:①hs-CRP:C反应蛋白是在病理状态下,一种肝脏合成的急性期蛋白,尤其hs-CRP 作为一种最具标志性炎症过程中表达的因子,是检测动脉粥样硬化极具敏感性的检测指标,可以预测斑块的预后及反应稳定状态,CRP可通过激活补体系统直接影响动脉粥样硬化的血管壁,且促进血栓及炎症的发展[7]。本研究显示hs-CRP在最佳检测浓度8.35 mg/L 时,其在稳定组的敏感性为92.3%,特异性为77.2%,表明hs-CRP对预测动脉粥样硬化斑块稳定性有较好的临床价值。②单核细胞趋化因子:MCP-1是平滑肌细胞和内皮细胞产生的一种单核细胞趋化性的吸引分子,使单核细胞黏附在血管内皮细胞并渗透至内皮下形成泡沫细胞,MCP-1主要由平滑肌细胞及内皮细胞通过旁分泌或(和)自分泌产生,其中内皮细胞分泌的MCP-1主要作用于动脉粥样硬化的早期,平滑肌细胞分泌的MCP-1作用于动脉粥样硬化各期,且病变越重内皮细胞受损越严重,迁移的平滑肌细胞也越多,因此MCP-1分泌越多,其血清浓度也就越高,MCP-1促进单核细胞进入血管内皮下,促进血管壁细胞增生及移行,从而参与动脉粥样硬化的发生发展[8]。本研究显示MCP-1在最佳检测浓度0.282pg/mL 时,其在非稳定组的敏感性为80.2%,特异性为88.9%,表明MCP-1对预测动脉粥样硬化斑块稳定性有较好的临床价值。③基质金属蛋白酶-9:MMP-9主要由平滑肌细胞及巨噬细胞分泌,其可以溶解胶原成分,斑块成分比例发生明显的变化,并使脂质的含量相对增多,增加了斑块的不稳定性,其可分解斑块纤维帽基质。使纤维帽变薄,斑块结构发生弱化,造成斑块破裂或溃疡,使斑块脂质核心中组织因子等致凝的物质欲血液接触,使凝血系统激活,诱导斑块血栓的形成[9]。本研究显示MMP-9 在最佳检测浓度0.141ng/mL时,其在非稳定组的敏感性为71.3%,特异性为85.6%,表明MMP-9 对预测动脉粥样硬化斑块稳定性有较好的临床价值。
本研究在综合以上结论的基础上,对提高动脉粥样硬化斑块稳定性预测的准确性予以探究,以hs-CRP>8.35mg/L,MCP-1>0.282pg/mL,MMP-9>0.141ng/mL为标准诊断稳定组的敏感性和特异性提高到97.4%、92.9%。以hs-CRP>8.35mg/L,MCP-1>0.282pg/mL,MMP-9>0.141ng/mL 为诊断标准非稳定组的敏感性提高到94.0%、95.5%,因此多生化指标联合检测可以提高动脉粥样硬化斑块稳定性预测的准确性,可以有效避免传统单一检查项目灵敏度、特异性不够所产生的问题。
[1] 张晶,关欣,王伟,等.血脂代谢与颈动脉粥样硬化不稳定性斑块的相关性[J].中国动脉硬化杂志,2012,20(9):833-836.
[2] Du Y,Wei F,Dong Z,et al.Prognostic value of serum LP-PLA2 and hs-CRP in unstable atherosclerotic plaques[J].Clinical Experimental Hypertension,2011,(2):113-116.
[3] Hermida J,Lopez FL,Montes R,et al.Usefulness of high-sensitivity C-reactive protein to predict mortality in patients with atrial fibrillation(from the atherosclerosis risk in communities[ARIC]Study)[J].Am J Cardiology,2012,(1):95-99.
[4] Inaba M,Sugioka K,Ueda M.Atherosclerosis:Progress in diagnosis and treatments Topics:Ⅱ.Atherosclerosis-promoting factors;pathogenesis and pathophysiology;2.Pathophysiology of coronary atherosclerosis[J].Nihon Naika Gakkai Zasshi,2013(2):275-282.
[5] Davidson J,Rotondo D.Atherosclerosis;cell biology and lipoproteins:Lipid metabolism,eicosanoids,peroxisome proliferator activated receptors and the atherogenic process[J].Current Opinion Lipidology,2010,17(4):347-354.
[6] 刘公理,吴赛珠,阮云军,等.多种生化标志物与颈动脉粥样硬化斑块稳定性的关系[J].山东医药,2012,52(5):7-9.
[7] 张东平,李淮玉.颈动脉粥样硬化斑块性质、血清hs-CRP水平在脑梗死发病预测及病情判定中的应用[J].山东医药,2013,53(47):53-55.
[8] Cheng F,Keeley EC,Lee JK.Molecular prediction for atherogenic risks across different cell types of leukocytes[J].BMC Medical Genomics,2012,5:243-251.
[9] 张浩,孙文文,汪奕斌,等.血清sCD105与MMP-9对冠状动脉事件的预测价值[J].中国热带医学,2012,12(12):1522-1524.

