真菌和哺乳动物GPI锚定蛋白结构和功能差异的研究进展
牛理达 赵静 吴建华
(第二军医大学附属长海医院皮肤科,上海200433)
在真核生物体内有两种类型的膜蛋白:完整的膜蛋白和脂质锚定蛋白。完整的膜蛋白包括一个或几个跨膜区域,从而构成疏水的α-螺旋结构,将蛋白嵌入流动的双分子层中[1]。我们将脂质锚定蛋白分为两组:一组是将蛋白连于内部的质膜侧,其余的则连于外侧。第1组以钙调磷酸酶B为代表,第2组则是一些包含C-末端信号序列的蛋白通过GPI锚连于细胞膜上。GPI锚定蛋白 (Glycosylphosphatidylionsitol-anchored protein,GPI-anchored protein)是在真核生物中的一种保守的翻译后修饰蛋白,如真菌中白念珠菌的GPI锚定蛋白对真菌细胞壁的合成和修复,氧化应激的适应以及对机体的侵袭等发挥着重要作用;而在哺乳动物体内GPI锚定蛋白的合成贯穿于胚胎发育、神经发生、免疫反应和受精作用。若GPI锚定蛋白的生物合成途径受损,将会导致一些疾病的发生,严重者会导致胚胎致死。
1 GPI锚定蛋白的结构、修饰和转运
在真菌细胞内的GPI锚定蛋白的N端和C端均有信号肽,其中C末端为可以有效诱导其与GPI锚结合,故称为GPI锚定蛋白的锚定信号肽,一般为一段不带电的疏水性的氨基己酸,在靠近C末端9-10氨基酸的位置有GPI结合位点ω点。蛋白中间由功能集团和富含色氨酸/丝氨酸的结构区域构成。N短信号肽、C端疏水性氨基酸以及靠近C端的ω点被认为是GPI锚定蛋白的保守结构域 (见图1)。
以啤酒酵母菌为代表来详细描述一下真菌GPI锚定蛋白 (GPI-anchored proteins,GPI-APs)的修饰与转运。在GPI锚与蛋白相连后,与肌醇相联的酰基链被 Bst1p移除 (PGAP1的同源物)[2],脂肪酸的移除且被转运至内质网上是由Per1p(哺乳动物体内的PGAP3同源物)介导和Gup1p调节的[3]。Ted1p和Cdc1p是哺乳动物中PGAP5的同源物,定植于内质网上。有报道指出,Ted1p对GPI锚上的乙醇胺-磷酸盐(Ethanolamine phosphate,Et-NPs)起作用,单链的 EtNPs是在 Mcd4p和Gpi7p的作用下添加上去的,而EtNPs是否也在它们的作用下被移除还不得而知[4]。GPI-APs包含一个长饱和脂肪酸,以脂肪依赖的方式将特定的蛋白集中和分类至特定的内质网出口(ER-exit site,ERES)。P24蛋白家族通过在ERES特定的区域与COPII连接促进修饰后的 GPI-APs有效输出[5]。GPIAPS在运至高尔基体后与P24蛋白复合物家族发生接力,未发生修饰的GPI-APs被P24蛋白复合物通过CPOI由高尔基体回运至内质网 (见图2)。内质网上合成的GPI-APS以不同的形式转运至真菌或酵母的细胞壁或细胞膜上。
2 真菌细胞壁GPI锚定蛋白的结构和功能
真菌的细胞壁GPI锚定蛋白 (cell wall GPI-anchored proteins,GPI-CWPs)常常高度的磷酸化和糖基化,并且常常参与带正电离子的绑定[6-7]。蛋白外衣由 β-1、6-葡聚糖、β-1、3-葡聚糖和少量甲壳素构成的内层的多聚糖层包围[8]。GPI-CWPs在外层的蛋白外衣通过GPI锚以共价键的方式与β-1,6糖苷键相连,同时依次与 β-1,3-葡聚糖的分子末端相连 (见图3)。
真菌细胞壁上的GPI锚定蛋白对真菌的黏附、形态转换和细胞壁合成有着重要的影响,以白念珠菌为例,白念珠菌中的GPI锚定蛋白具有呈家族性出现的特征,通过对白念珠菌全基因组序列的对比,发现有白念珠菌中的115个GPI锚定蛋白的编码基因中有67个分别属于不同的基因家族。白念珠菌70%的GPI锚定蛋白的功能未知,但是他们在合成和维持细胞壁的完整及侵袭方面有着重要的作用,例如白念珠菌SC5314中的ALS家族中的8个成员介导了白念珠菌与宿主细胞的黏附[9-10]。Als3,作为一种侵袭素促进白念珠菌被宿主上皮细胞摄取[11],同时在结合铁蛋白螯合铁方面起到重要作用。菌丝相关性的Hwp1在介导菌丝形成方面发挥重要作用,进而影响真菌的黏附和侵袭[12]。其他GPI-CWPs在细胞壁的合成和修饰方面也发挥作用,例如 Gas/Phr家族[13-14]、Crh家族和Ecm33家族。GPI锚定的天门冬氨酰蛋白酶或天冬酶sap9和sap10也有助于真菌细胞壁的合成[15]。过氧化物歧化酶 Sod4、Sod5和Sod6被预测有潜在的侵袭属性[15-17]。微生物的黏附是其致病性最重要的决定因素之一,真菌病原体被确定的黏附素很少,来自于白念珠菌的Hwp1、Ala1p/Als5、Als1p和来自于光滑念珠菌的Epa1,他们都隶属于糖基磷脂酰肌醇依赖的细胞壁蛋白 (GPI-CWP)[18],在介导真菌与宿主细胞之间的黏附过程中发挥重要作用。
3 哺乳动物GPI锚定蛋白的概述以及与真菌GPI锚定蛋白的区别与联系
GPI锚存在于每一个真核生物体内,从单核的酵母细胞、一些浮游生物的细胞到高级的哺乳动物的细胞,然而很多GPI锚定蛋白如葡糖苷酶、α-淀粉酶、天门冬氨酰酶、超氧化物歧化酶、磷脂酶等的特定功能都无从知晓,在哺乳动物体内GPI锚的合成与真菌具有相同的方式,由胆胺、甘露糖、葡糖胺和肌醇在内质网上合成以分泌的形式转运至细胞膜表面,形成 GPI质膜蛋白 (Plasma membrance GPI proteins,GPI-PMPs)(见图 4),而在真菌体内GPI锚定蛋白除了可以锚定于细胞膜外,其中部分蛋白可以从细胞膜上脱落,而以共价键的方式与细胞壁上的β-1,6-葡糖胺相结合,形成细胞壁GPI锚定蛋白 (cell wall GPI-anchored proteins,GPICWPs),哺乳动物GPI-APs是哺乳动物胚胎发育、神经发育、免疫反应和受精所必需的,人类的一些疾病就是由于GPI锚定蛋白合成过程中的基因突变造成的。有研究指出,在造血干细胞中,PGI-A编码了GPI锚生物合成的第一种酶,PGI-A主干的突变与阵发性血红蛋白尿 (PNH),一种获得性的溶血性疾病的发生有重要关联,此外还有一些报道指出PIG-M、PIG-V和PIG-N的常染色体隐性突变会引起遗传性的GPI锚定蛋白缺陷[19],从而造成身体发育过程中严重的缺陷,由此我们可知哺乳动物和真菌的GPI锚定蛋白的结构和功能具有很大差异,但是将他们连于细胞壁或者细胞膜上GPI锚的合成和核心结构是相似的。
4 展 望
真菌的GPI锚定蛋白是细胞免疫和体液免疫重要的目标,随着近年来关于白念珠菌GPI锚定蛋白的研究越来越多,研究人员不再仅仅着眼于某一个蛋白,而是从整体角度、基因家族角度去研究GPI锚定蛋白的结构和功能。此外,以GPI锚定蛋白为靶点,筛选出新的新的抗真菌药物的工作也成为研究方向,一些推测的如葡聚糖Blg2,Camp65/Scwl和黏附因子Als1和Als3,在白念珠菌病的动物模型中利用后3种GPI锚定蛋白可预测研制出疫苗[20]。而在哺乳动物体内GPI锚定蛋白功能广泛,涉及细胞识别、信号转导、生长发育、分化和程序性死亡等重要生命过程,与许多疾病有着一定的联系,如血栓形成、白血病等[21]。由于真菌和哺乳动物的GPI锚具有相似的合成部位和核心结构,在研发作用于GPI锚定蛋白的抗真菌药过程中,虽然抗真菌GPI锚定蛋白的药物具有较好的种属特异性,因此我们推测对于真菌GPI锚定蛋白的损伤有可能会间接影响都真菌GPI锚的功能进而可能会引起一些无法预测的药物的副作用。同时通过对真菌细胞壁蛋白组结构的调整和动态修饰的研究,在真菌感染宿主时,我们可以了解细胞壁成分对于宿主识别病原体中的作用。同时有利于我们研发新的疫苗、生物标记物等,进而帮助我们提高一些致病性真菌的诊断和治疗。
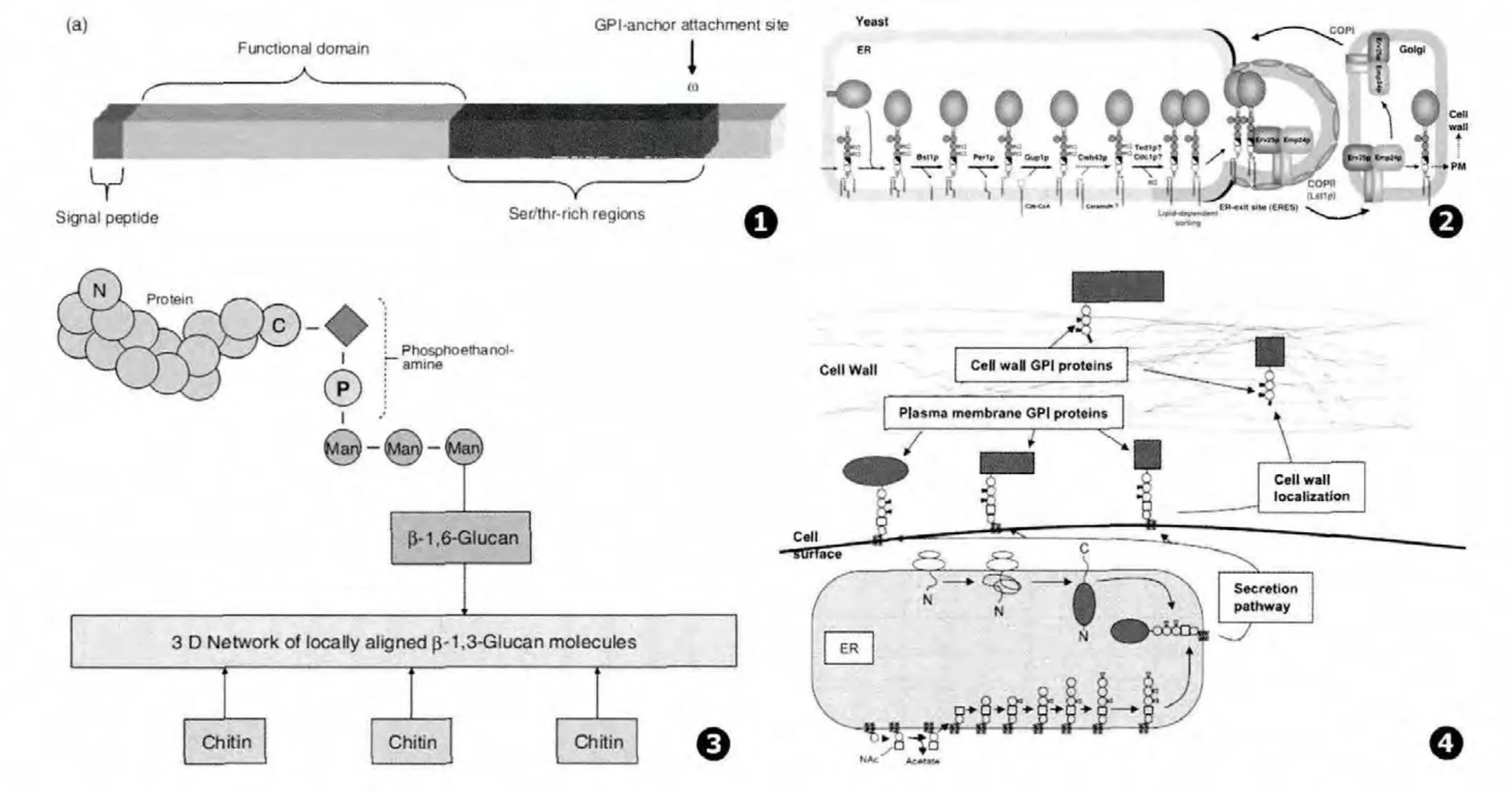
图1 GPI锚定蛋白(Glycosylphosphatidylionsitol-anchored protein)核心结构的示意图[20] 图2 啤酒酵母菌细胞壁上GPI锚定蛋白的修饰与转运示意图[19] 图3 GPI锚定蛋白与真菌细胞壁的连接方式示意图[20] 图4 真核生物质膜GPI锚定蛋白和细胞壁GPI锚定蛋白的位置和结构示意图[1]Fig.1 The nuclear structure of Glycosylphosphatidylionsitol-anchored protein Fig.2 The modification and transfer of GPI-anchored proteins on Saccharomyces cerevisiae's cell wall Fig.3 The connection of between GPI-anchored protein and cell wall in fungi Fig.4 The location and structure between Plasma membrane GPI proteins and Cell wall GPI proteins in eukaryotic cells
综上所述,不论在真菌还是在哺乳动物体内,GPI锚定蛋白作为重要的细胞表面蛋白,显示出了重要的研究意义,也开始受到研究人员越来多的关注。
[1] Richard ML,Plaine A.Comprehensive analysis of glycosylphosphatidylinositol-anchored proteins in Candida albicans[J].Eukaryot Cell,2007,6(2):119-133.
[2] Tanaka S,Maeda Y,Tashima Y,et al.Inositol deacylation of glycosylphosphatidylinositol-anchored proteins is mediated by mammalian PGAP1 and yeast Bst1p[J].J Biol Chem,2004,279(14):14256-14263.
[3] Fujita M,Umemura M,Yoko-o T,et al.PER1 is required for GPI-phospholipase A2 activity and involved in lipid remodeling of GPI-anchored proteins[J].Mol Biol Cell,2006,17(12):5253-5264.
[4] Zhu Y,Vionnet C,Conzelmann A.Ethanolaminephosphate side chain added to glycosylphosphatidylinositol(GPI)anchor by mcd4p is required for ceramide remodeling and forward transport of GPI proteins from endoplasmic reticulum to Golgi[J].J Biol Chem,2006,281(29):19830-19839.
[5] Castillon GA,Aguilera-Romero A,Manzano-Lopez J,et al.The yeast p24 complex regulates GPI-anchored protein transport and quality control by monitoring anchor remodeling[J].Mol Biol Cell,2011,22(16):2924-2936.
[6] Horisberger M,Clerc MF.Ultrastructural localization of anionic sites on the surface of yeast,hyphal and germ-tube forming cells of Candida albicans[J].Eur JCell Biol,1988,46(3):444-452.
[7] Cutler JE.N-glycosylation of yeast,with emphasis on Candida albicans[J].Med Mycol,2001,39(Suppl 1):75-86.
[8] Kapteyn JC,Hoyer LL,Hecht JE,et al.The cell wall architecture of Candida albicans wild-type cells and cell wall-defective mutants[J].Mol Microbiol,2000,35(3):601-611.
[9] Hancock JF.GPI-anchor synthesis:Ras takes charge[J].Dev Cell,2004,6(6):743-745.
[10] Hoyer LL.The ALSgene family of Candida albicans[J].Trends Microbiol,2001,9(4):176-180.
[11] Fu Y,Ibrahim AS,Sheppard DC,et al.Candida albicans Als1p:an adhesin that is a downstream effector of the EFG1 filamentation pathway[J].Mol Microbiol,2002,44(1):61-72.
[12] Sundstrom P,Balish E,Allen CM.Essential role of the Candida albicans transglutaminase substrate,hyphal wall protein 1,in lethal oroesophageal candidiasis in immunodeficient mice[J].JInfect Dis,2002,185(4):521-530.
[13] Phan QT,Myers CL,Fu Y,et al.Als3 is a Candida albicans invasin that binds to cadherins and induces endocytosis by host cells[J].PLoSBiol,2007,5(3):e64.
[14] Fonzi WA.PHR1 and PHR2 of Candida albicans encode putative glycosidases required for proper cross-linking of beta-1,3-and beta-1,6-glucans[J].JBacteriol,1999,181(22):7070-7079.
[15] Albrecht A,Felk A,Pichova I,et al.Glycosylphosphatidylinositolanchored proteases of Candida albicans target proteins necessary for both cellular processes and host-pathogen interactions[J].J Biol Chem,2006,281(2):688-694.
[16] Martchenko M,Alarco AM,Harcus D,et al.Superoxide dismutases in Candida albicans:transcriptional regulation and functional characterization of the hyphal-induced SOD5 gene[J].Mol Biol Cell,2004,15(2):456-467.
[17] Fradin C,De Groot P,MacCallum D,et al.Granulocytes govern the transcriptional response,morphology and proliferation of Candida albicans in human blood[J].Mol Microbiol,2005,56(2):397-415.
[18] Sundstrom P.Adhesion in Candida spp[J].Cell Microbiol,2002,4(8):461-469.
[19] Fujita M,Kinoshita T.GPI-anchor remodeling:potential functions of GPI-anchors in intracellular trafficking and membrane dynamics[J].Biochim Biophys Acta,2012,1821(8):1050-1058.
[20] Nather K,Munro CA.Generating cell surface diversity in Candida albicans and other fungal pathogens[J].FEMS Microbiol Lett,2008,285(2):137-145.
[21] Maeda Y,Tashima Y,Houjou T,et al.Fatty acid remodeling of GPI-anchored proteins is required for their raft association[J].Mol Biol Cell,2007,18(4):1497-1506.
——疾病防治的新靶标

