乙型肝炎病毒表面抗原T131N/M133T变异株糖基化和抗原性研究
康耀月,郭红英,张咏梅,张继明
1.复旦大学附属华山医院感染科,上海200040;2.上海市公共卫生临床中心,上海 200083
乙型肝炎病毒表面抗原T131N/M133T变异株糖基化和抗原性研究
康耀月1,郭红英2,张咏梅1,张继明1
1.复旦大学附属华山医院感染科,上海200040;2.上海市公共卫生临床中心,上海 200083
为探讨乙型肝炎病毒表面抗原(HBsAg)T131N/M133T变异株的糖基化和抗原性,本研究构建了T131N/M133T变异的HBsAg过表达质粒,将质粒转染细胞,用蛋白免疫印迹法检测HBsAg表达和糖基化情况,用酶联免疫吸附试验(ELISA)和免疫荧光法检测HBsAg的抗原性。结果显示,T131N/M133T变异使HBsAg产生了新的N-糖基化修饰,该变异质粒转染细胞内HBsAg水平显著低于野生型,上清液中HBsAg水平也有一定程度降低。结果提示,T131N/M133T变异使HBsAg发生了新的N-糖基化修饰,该变异产生的糖基化可能影响HBsAg的胞内稳定性,对HBsAg的抗原性也有一定影响。
乙型肝炎病毒表面抗原;T131N/M133T;糖基化;抗原性
乙型肝炎病毒表面抗原(hepatitis B virus surface antigen,HBsAg)是乙型肝炎病毒(hepatitis B virus,HBV)包膜蛋白的主要成分,由226个氨基酸组成,其中第124~147位氨基酸被称为“a”抗原决定簇,是抗体中和的主要位点。该区域内氨基酸变异往往会影响HBsAg的抗原性或免疫原性。其中报道较多的是HBsAg的G145R变异(145位氨基酸由甘氨酸G变异为精氨酸R),该变异使HBsAg抗原性降低,导致HBV疫苗免疫失败或免疫球蛋白治疗无效[1-4]。氨基酸变异为天冬氨酸N的情况也较多见。HBsAg的T123N变异在1例接受乙型肝炎免疫球蛋白治疗的肝移植患者中发现[5],该变异降低了HBsAg的抗原性[6,7]。T123N变异后产生N-X-S/T(天冬酰胺-除脯氨酸以外的任意氨基酸-丝氨酸/苏氨酸)序列,这是一种经典的N-糖基化位点[8-11],该位点产生的HBsAg糖基化修饰可能降低其抗原性[12],从而影响HBsAg检测。本课题组曾在临床上收集到1例低水平HBsAg慢性乙型肝炎患者的血清,分离HBV后对其S区基因进行测序发现多种变异,其中T131N和M133T联合变异(T131N/M133T)产生了N-X-S/T序列。因此,本研究在已知序列的HBV野生株基础上,通过定点诱变技术构建T131N/M133T变异株,研究其对HBsAg糖基化及抗原性的影响。
1 材料与方法
1.1 材料
1.1.1 质粒和细胞系HBV野生型全基因质粒由本实验室构建,pXF3H质粒为德国Essen大学陆蒙吉教授馈赠,Huh7细胞和HeLa细胞由本实验室保藏,DH5α感受态细胞购自天根生化科技(北京)有限公司。
1.1.2 试剂构建质粒过程中的内切酶EcoRⅠ、PstⅠ及连接酶T4均购自美国NEB公司,转染试剂Lipofectamine 2000购自美国Invitrogen公司,蛋白免疫印迹和免疫荧光所用anti-HA单克隆抗体(简称单抗)购自美国CST公司,免疫荧光所用anti-S1单抗由中国科学院武汉病毒研究所提供,Alexa Fluor 568、Alexa Fluor 488及Hochest 33258抗体均购自美国Invitrogen公司。

表1 构建质粒所需引物序列Tab.1 Primers for the construction of the expression vectors
1.2 方法
1.2.1 构建重组质粒 pHBsAg-WT、pHBsAg-T131N/M133T及pHBsAg-T123N在野生型全基因质粒536207(GenBank登录号:AY220698)基础上,通过SP1/SP2(表1)扩增S基因,然后通过PstⅠ和EcoRⅠ双酶切将S基因连接到载体pXF3H上,构建HBsAg真核表达载体,命名为 pHBsAg-WT[6]。通过定点诱变和诱变引物T131NM133TF、T131NM133T-R及T123N-F、T123N-R(表1),获得包含单个变异位点T131N/M133T和T123N的质粒,分别命名为 pHBsAg-T131N/M133T和pHBsAg-T123N。
1.2.2 蛋白免疫印迹法检测HBsAg表达Huh7细胞按常规培养于DMEM培养基,添加10%胎牛血清(Gibco公司)和抗生素,青霉素终浓度为100 U/ml,链霉素终浓度为100 μg/ml。细胞置于37℃、5%CO2培养箱中培养,0.125%胰酶消化传代。转染前1 d,在6孔板上每孔接种2×105个细胞。用Lipofectamine 2000转染试剂将 pHBsAg-WT、pHBsAg-T131N/M133T和pHBsAg-T123N质粒分别转染Huh7细胞,每孔转染质粒1.5 μg,空载体质粒作为对照同时转染细胞。取30 μl细胞上清液和含30 μg蛋白的细胞裂解液,分别加 Loading Buffer,煮沸变性10 min,行12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE),转移至硝酸纤维素(nitrocellulose,NC)膜,封闭,与anti-HA单抗孵育,以β-actin为内参,4℃孵育过夜。次日洗膜,辣根过氧化物酶(horseradish peroxidase,HRP)标记抗体,室温孵育1 h后用化学发光液显影。另取2等份含30 μg蛋白的细胞裂解液,分别加入G7、NP40、PNGase F,以及G5、Endo H,37℃消化过夜,用anti-HA单抗行蛋白免疫印迹检测。同法,将上述质粒转染细胞,在转染后6 h每孔加入N-糖基化抑制剂衣霉素(tunicamycin),转染后48 h收集细胞裂解液,取30 μg行蛋白免疫印迹检测,以Fermentas预染蛋白Marker SM0671为标记。
1.2.3 酶联免疫吸附试验检测HBsAg在细胞上清液中的水平质粒转染Huh7细胞48 h后收集细胞上清液,取600 μl送上海艾迪康医学检验中心用美国雅培ARCHITECT进行HBsAg定量检测。另取一定量的细胞上清液稀释10倍后,分别用科华生物HBsAg酶 联 免 疫 吸 附 试 验 (enzyme-linked immunosorbent assay,ELISA)试剂盒及中国科学院武汉病毒研究所单抗室制备的3种抗HBsAg单抗S1、S11和A11包被的96孔板检测HBsAg。按说明书操作,检测结果用样品的光密度(optical density,OD)值与阴性对照 OD值的比值(S/N)表示。
1.2.4 免疫荧光检测HBsAg的表达和分布同1.2.2方法,将各种质粒转染HeLa细胞,48 h后收集细胞,用含3.5%多聚甲醛的磷酸盐缓冲液(phosphate buffered saline,PBS)室温固定15 min;然后用含5%正常山羊血清(normal goat serum,NGS)和0.5%Triton X-100的PBS在室温下透化并封闭1 h,依次孵育2种一抗(anti-HA单抗、anti-HBsAg S1单抗)及 2种二抗(Alexa Fluor 568、Alexa Fluor 488);最后用Hochest 33258染核后在荧光显微镜下观察HBsAg的表达和分布。
2 结果
2.1pHBsAg-WT、 pHBsAg-T131N/M133T 和pHBsAg-T123N质粒的构建
pHBsAg-WT过表达质粒及在其基础上诱变的pHBsAg-T131N/M133T、pHBsAg-T123N质粒经上海博尚生物技术有限公司测序正确,且未引起S基因其他位点突变,证实质粒构建成功。
2.2 HBsAg在细胞内的表达及细胞上清液中的分泌
野生型和变异型质粒瞬时转染Huh7细胞48 h后,分别收集细胞上清液(图1A)和细胞裂解液(图1B)。蛋白免疫印迹检测结果显示,细胞上清液和细胞裂解液中野生型质粒表达产生相对分子质量为26 000和29 000的HBsAg条带,分别代表HBsAg的非糖基化和糖基化形式[12]。T131N/M133T和T123N变异质粒表达产生26 000、29 000及32 000的HBsAg条带。经糖苷酶抑制剂衣霉素(图1C)及2种N-糖苷水解酶PNGase F(图1D)、Endo H(图1E)处理后,野生型与变异型质粒的29 000和32 000条带均消失,证实T131N/M133T变异产生了新的N-糖基化。另外,未经衣霉素处理的T131N/M133T使细胞内HBsAg水平显著低于野生型和T123N变异型质粒;而经衣霉素处理后,三者无显著差异(图1)。
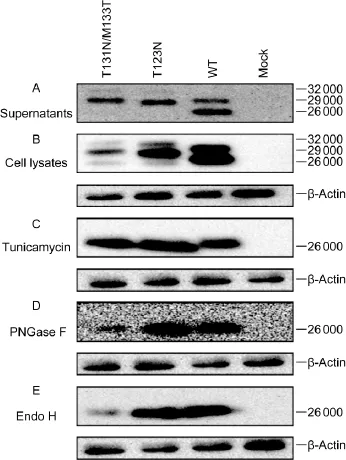
图1 HBsAg在细胞内及细胞上清液中的表达和分泌Fig.1 Expression of HBsAg in transfected Huh7 cells and culture supernatants
2.3 细胞上清液中HBsAg水平
ELISA试剂盒(图2A)、3种抗HBsAg单抗(图2B)及雅培ARCHITECT(图2C)的HBsAg定量检测显示,T123N变异型用3种抗HBsAg单抗S1、S11和A11检测的结果明显低于野生型,与既往报道一致[12];T131N/M133T变异型用3种抗HBsAg单抗和雅培 ARCHITECT检测的结果略低于野生型。
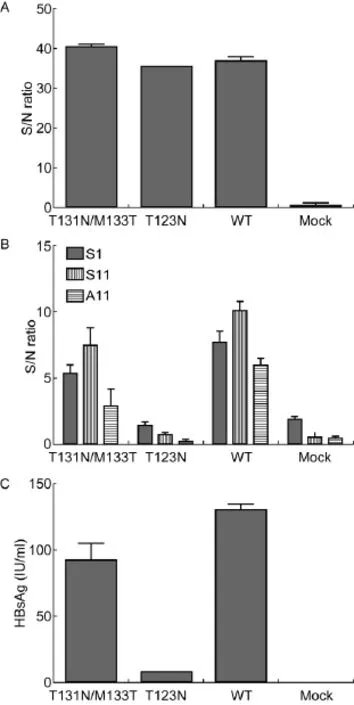
图2 ELISA检测细胞上清液中HBsAg水平Fig.2 Reactivity of expressed wild-type HBsAg and mt-HBsAg to a commercial ELISA kit or to mAbs or to the ARCHITECT assay
2.4 细胞内HBsAg的表达和分布
anti-HA荧光染色结果显示,T131N/M133T变异质粒的荧光强度较野生型和T123N变异型弱。另外,野生型质粒的荧光主要呈胞质内均匀分布,而T131N/M133T呈核周聚集分布。T131N/M133T变异质粒用anti-S1与anti-HA抗体荧光染色的强度无显著差异(图3)。
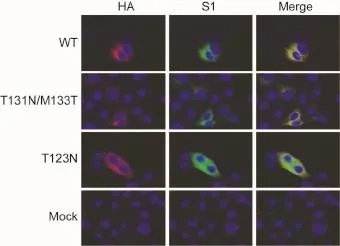
图3 HA单抗和HBsAg-S1单抗免疫荧光染色结果(× 1 000)Fig.3 Immunofluorescence staining of wt-and mt-HBsAg with anti-HA mAb and anti-S1 mAb(×1 000)
3 讨论
本研究构建了HBsAg的T131N/M133T变异过表达质粒,同时将T123N质粒作为阳性参照,研究HBsAg的T131N/M133T变异产生的糖基化对其抗原性的影响。
野生型HBsAg有非糖基化的26 000及糖基化的29 000形式[7,13]。T131N/M133T变异后,HBsAg产生了32 000的新糖基化形式。经糖苷酶抑制剂和2种N-糖苷水解酶处理后,32 000的蛋白条带消失,证实这种新的糖基化形式为N-糖基化。在B和C型HBV序列中,必须同时存在T131N和M133T双突变才能产生N-X-S/T糖基化位点;而在其他基因型HBV序列中,天然存在T131N位点,只需M133T单突变即可产生N-X-S/T糖基化位点。在后续研究中将进一步构建T131N和(或)M133T单突变作为对照,理论上这2个单突变不会产生新的糖基化修饰。
蛋白免疫印迹检测显示,未经糖苷酶抑制剂处理组T131N/M133T使细胞内HBsAg水平显著低于野生型和T123N突变型,与免疫荧光法检测结果一致:HA和S1抗体检测均显示T131M/M133T的荧光强度比野生型和T123N变异型弱。另一方面,经糖苷酶抑制剂处理后,三者表达没有差异。结果提示,T131N/M133T变异可能影响HBsAg稳定性或促进其分泌,但分泌到上清液中的HBsAg水平在T131N/M133T变异型、野生型与T123N变异型之间没有很大差异,表明T131N/M133T变异可能影响了糖基化HBsAg的胞内稳定性。这个推断与该临床变异株HBsAg水平低的现象一致。既往有研究报道糖基化状态改变会降低蛋白的稳定性[14]。
近期研究指出,HBsAg发生糖基化变异后其抗原性降低[12]。本研究中,采用敏感度较高的HBsAg ELISA试剂盒、特异度较高的3种抗HBsAg单抗及雅培 ARCHITECT对野生型和 T131N/ M133T变异型质粒转染细胞上清液中HBsAg水平进行检测,结果提示上清液中HBsAg水平虽无显著差异,但仍有一定程度降低。因此,HBsAg的T131N/M133T变异产生的糖基化使其抗原性降低,从而影响检测,与该临床变异株HBsAg水平低的现象一致。
糖基化对蛋白功能具有重要意义。已知免疫系统中几乎所有关键因子均为糖蛋白[15]。HBsAg“a”抗原决定簇内的N-糖基化变异可引起HBV免疫逃逸,从而使变异株在人群中水平传播[16]。本研究中,T131N/M133T变异使HBsAg产生N-糖基化,使其抗原性降低,但对其免疫原性的影响尚有待进一步研究。
[1] Carman WF,Zanetti AR,Karayiannis P,Waters J,Manzillo G,Tanzi E,Zuckerman AJ,Thomas HC.Vaccine-induced escape mutant of hepatitis B virus[J].Lancet,1990,336(8711):325-329.
[2] Cooreman MP,Leroux-Roels G,Paulij WP.Vaccine-and hepatitis B immune globulin-induced escape mutations of hepatitis B virus surface antigen[J].J Biomed Sci,2001,8(3): 237-247.
[3] Zoulim F,Buti M,Lok AS.Antiviral-resistant hepatitis B virus:can we prevent this monster from growing[J]?J Viral Hepat,2007,14(Suppl 1):29-36.
[4] Wu C,Deng W,Deng L,Cao L,Qin B,Li S,Wang Y,Pei R,Yang D,Lu M,Chen X.Amino acid substitutions at positions 122 and 145 of hepatitis B virus surface antigen (HBsAg) determine the antigenicity and immunogenicity of HBsAg and influence in vivo HBsAg clearance[J].J Virol,2012,86(8):4658-4669.
[5] Carman WF,Owsianka A,Wallace LA,Dow BC,Mutimer DJ.Antigenic characterization of pre-and post-liver transplant hepatitis B surface antigen sequences from patients treated with hepatitis B immune globulin[J].J Hepatol,1999,31(2):195-201.
[6] Ireland JH,O’Donnell B,Basuni AA,Kean JD,Wallace LA,Lau GK,Carman WF.Reactivity of 13 in vitro expressed hepatitis B surface antigen variants in 7 commercial diagnostic assays[J].Hepatology,2000,31(5):1176-1182.
[7] Tian Y,Xu Y,Zhang Z,Meng Z,Qin L,Lu M,Yang D.The amino acid residues at positions 120 to 123 are crucial for the antigenicity of hepatitis B surface antigen[J].J Clin Microbiol,2007,45(9):2971-2978.
[8] Marshall RD.The nature and metabolism of the carbohydratepeptide linkages of glycoproteins[J].Biochem Soc Symp,1974,40:17-26.
[9] Kaplan HA, Welply JK, Lennarz WJ. Oligosaccharyl transferase:the central enzyme in the pathway of glycoprotein assembly[J].Biochim Biophys Acta,1987,906(2):161-173.
[10] Gavel Y,von Heijne G.Sequence differencesbetween glycosylated and non-glycosylated Asn-X-Thr/Ser acceptor sites: implications for protein engineering[J].Protein Eng,1990,3 (5):433-442.
[11] Mellquist JL,Kasturi L,Spitalnik SL,Shakin-Eshleman SH.The aminoacid followingan Asn-X-Ser/Thr sequon is an important determinant of N-linked core glycosylation efficiency[J].Biochemistry,1998,37(19):6833-6837.
[12] Wu C,Zhang X,Tian Y,Song J,Yang D,Roggendorf M,Lu M, Chen X. Biologicalsignificance ofamino acid substitutions in hepatitisB surfaceantigen (HBsAg) for glycosylation,secretion,antigenicityand immunogenicityof HBsAg and hepatitis B virus replication[J].J Gen Virol,2010,91(Pt 2):483-492.
[13] Peterson DL.Isolation and characterization of the major protein and glycoprotein of hepatitis B surface antigen[J].J Biol Chem,1981,256(13):6975-6983.
[14] Morgan RG,Molnár E,Jones RF,Collard TJ,Lane JD,Greenhough A,Paraskeva C,Williams AC.Nutrient stress alters the glycosylation status of LGR5 resulting in reduced protein stability and membrane localisation in colorectal tumour cells: implications for targeting cancer stem cells[J].Br J Cancer,2015,112(4):714-719.
[15] Rudd PM,Elliott T,Cresswell P,Wilson IA,Dwek RA.Glycosylation and the immune system[J].Science,2001,291 (5512):2370-2376.
[16] Yu DM,Li XH,Mom V,Lu ZH,Liao XW,Han Y,Pichoud C,Gong QM,Zhang DH,Zhang Y,Deny P,Zoulim F,Zhang XX.N-glycosylation mutations within hepatitis B virus surface major hydrophilic region contribute mostly to immune escape[J].J Hepatol,2014,60(3):515-522.
Effects of T131N/M133T substitutions in hepatitis B virus surface antigen on glycosylation and antigenicity
KANG Yao-Yue1,GUO Hong-Ying2,ZHANG Yong-Mei1,ZHANG Ji-Ming1
1.Department of InfectiousDiseases,Huashan Hospital,Fudan University,Shanghai 200040,China;
2.Shanghai Public Health Clinic Center,Shanghai 200083,China
To study the impact of T131N/M133T substitutions in hepatitis B virus surface antigen(HBsAg),the proteins expressed in Huh7 and HeLa cells were subjected to Western blotting,enzyme-linked immunosorbent assay (ELISA)and immunofluorescence(IF)staining.The results showed that T131N/M133T substitutions created a new site for N-glycosylation.The detected level of T131N/M133T was significantly low,indicating a potential negative impact on stability and antigenicity of HBsAg.
Hepatitis B virus surface antigen;T131N/M133T;Glycosylation;Antigenicity
.ZHANG Ji-Ming,E-mail:jmzhang@fudan.edu.cn
2015-01-15)
国家自然科学基金(81271833),“十二五”国家科技重大专项(2013ZX10002001、2012ZX10002007-001-002),国家重大新药创制科技重大专项(2012ZX09303004-001)
张继明

