放线菌与诺卡菌所致感染性皮肤肉芽肿的鉴别诊断及治疗
马英,吴湜,黄海辉,杨洋,陈连军
1.复旦大学附属华山医院皮肤科,上海 200040;2.复旦大学附属华山医院抗生素研究所,国家卫生和计划生育委员会抗生素临床药理重点实验室,上海 200040
放线菌与诺卡菌所致感染性皮肤肉芽肿的鉴别诊断及治疗
马英1,吴湜2,黄海辉2,杨洋2,陈连军1
1.复旦大学附属华山医院皮肤科,上海 200040;2.复旦大学附属华山医院抗生素研究所,国家卫生和计划生育委员会抗生素临床药理重点实验室,上海 200040
感染性肉芽肿是一类慢性增生性炎症。放线菌和诺卡菌所致感染性肉芽肿实属少见,但两者临床症状、体征相似,易误诊或漏诊。本文报道1例放线菌与1例诺卡菌所致皮肤感染性肉芽肿,通过皮肤组织病理学检查、细菌培养、生化鉴定及细菌分子生物学检测,最终明确诊断。进一步分析2种感染的病因学、流行病学、临床表现、诊断和鉴别诊断及治疗,并结合最新研究进展,可帮助临床医师更好地认识放线菌属细菌所致感染性皮肤肉芽肿,以便于及时诊断、及时治疗。这2种感染有很多相似之处,也有各自特点,需临床医师求同存异,仔细鉴别;还需与其他感染性肉芽肿如皮肤结核、孢子丝菌病或着色芽生菌病等鉴别诊断。
放线菌;诺卡菌;感染性皮肤肉芽肿
肉芽肿是巨噬细胞和其他炎症细胞参与的慢性 炎症过程。在抗原暴露后,T细胞、巨噬细胞、上皮细胞和多核巨细胞被激活,从而形成肉芽肿。肉芽肿被认为是机体的一种防御机制,可抵抗外界病原体,保护组织和器官。皮肤肉芽肿分为感染性肉芽肿和非感染性肉芽肿。感染性肉芽肿主要由金黄色葡萄球菌、假单胞菌、放线菌、真菌(如曲霉)等感染所致[1]。放线菌和诺卡菌是放线菌属的2种少见的能导致肉芽肿的病原体,在感染性皮肤肉芽肿中很少作为常规鉴别诊断。两者的临床症状、体征与其他感染性肉芽肿性皮肤病相似,易误诊。本文分析1例皮肤放线菌与1例诺卡菌感染病例,总结这2类疾病的病原学、流行病学、临床表现、诊断和鉴别诊断、治疗及最新进展,以帮助临床医师提高认识,及时给予患者最佳治疗。
1 材料与方法
1.1 组织病理学检查
将皮肤组织块投入预先配好的10%甲醛溶液中固定。以低浓度到高浓度乙醇为脱水剂,逐渐脱去其中水分,置二甲苯中替换出乙醇至其透明。将已透明的组织块置于溶化石蜡中,待石蜡完全浸入组织块后进行包埋,冷却后凝固成块。将包埋好的蜡块固定于切片机上,切成4 μm薄片,置载玻片上,于60℃恒温箱中烤3 h。用二甲苯脱去切片中的石蜡,经高浓度到低浓度乙醇脱水,最后流水冲洗干净,行苏木精(hematoxylin)染色;经1%盐酸乙醇脱色,饱和碳酸锂蓝化,再次流水冲洗干净,入伊红(eosin)染液复色,再用二甲苯使切片透明。将已透明的切片滴上中性树胶,盖上盖玻片封固。
1.2 细菌培养及生化鉴定
用碘酒对患者皮肤肉芽组织处进行局部消毒,1 ml针头刺破皮肤表面,挤出脓液,以无菌棉拭子沾取脓血,接种血琼脂平板,置于厌氧(5%CO2、10% H2、85%N2)和需氧环境,37℃孵育48~72 h后观察菌落。分离细菌并经涂片、革兰染色(革兰染色液为上海科兴生物科技有限公司产品)后镜检,用API-20A鉴定条(法国梅里埃生物有限公司)鉴定,然后置于40%甘油肉汤,-70℃冰箱保存菌种。
1.3 细菌分子生物学鉴定
1.3.1 细菌DNA提取采用细菌基因组DNA提取试剂盒(天根生化科技有限公司)提取基因组DNA,作为聚合酶链反应(polymerase chain reaction,PCR)的模板。
1.3.2 PCR扩增16S rDNA通用引物序列为27F:5'-AGAGTTTGATCCTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3',引物由上海迈浦生物科技有限公司合成。PCR反应体系(宝生物工程有限公司)(20 μl):Premix Taq 10 μl,上、下游引物各1 μl,模板1 μl,双蒸水补至20 μl。16S rDNA的PCR扩增条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸100 s,30个循环;72℃延伸10 min。4℃保存。PCR产物割胶纯化,经2%琼脂糖凝胶电泳,取目的条带,按天根回收试剂盒(DP214-03)纯化回收。
1.3.3 PCR产物测序采用Sanger法。测序用试剂盒为 BigDye v3.1 Chemistry Kit(Applied Biosystems,CA)。
1.3.4 细菌16S rDNA测序由上海迈浦生物科技有限公司进行测序。测序结果与美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中的数据进行比对。
2 结果
2.1 临床表现及实验室检查
临床表现:患者均有皮下结节,质硬,后结节逐渐软化,破溃伴流脓,并有局部压痛。病例一为女性患者,56岁,发病前2个月无明显诱因下左鼻唇沟处出现皮下结节伴流脓,局部有压痛。病程中无发热、咳嗽及胸痛、关节酸痛等全身症状。发疹后2周至复旦大学附属肿瘤医院行局部穿刺术,镜下未见恶性依据。既往患者有因上颌窦癌而行局部放疗病史,无高血压、糖尿病及其他慢性病史。病例二为男性患者,45岁,发病前2年右足背部出现皮下硬结,有流脓及局部压痛,病情迁延不愈。患者2年半前农作时右足部受外伤,当时局部清创后愈合。病程中无发热、关节酸痛等全身不适。既往无高血压、糖尿病及其他慢性病史。
体格检查:2例患者神清,精神可,巩膜无黄染,全身淋巴结未及肿大,心、肺、腹部检查均无异常。病例一皮肤科检查发现左鼻唇沟处见红色条索状结节,轻轻挤压可见黄色脓液流出,伴有轻压痛(图1)。病例二皮肤科检查发现右足背部暗红色斑块,局部形成条索状结节,挤压后可见黄色脓液流出,局部伴有压痛(图2)。
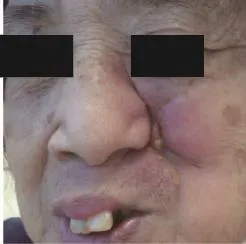
图1 左鼻唇沟处见红色条索状结节,轻轻挤压可见黄色脓液流出Fig.1 Red funicular nodule in the left nasolabial groove,discharged pus when gently squeezed
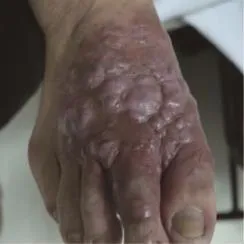
图2 右足背部暗红色斑块,局部形成条索状结节,挤压后可见黄色脓液流出Fig.2 Dark red plaques on the back of right foot with the local formation of funicular nodules,discharged pus when squeezed
实验室常规检查:2例患者的血尿粪常规、肝肾功能、电解质、血脂、血糖、糖化血红蛋白、免疫球蛋白、补体检查均正常。快速血浆反应素(rapid plasma reagin,RPR)试验阴性,人类免疫缺陷病毒(human immunodeficiency virus,HIV)阴性。胸部CT、腹部B超检查均未见异常。
病理学检查:病例一示真皮内弥漫性炎症细胞浸润,部分区域形成中性粒细胞脓疡伴多核巨细胞,可见菊花样菌团结构,内见放射状排列的菌丝(图3)。病例二示表皮乳头瘤样生长,真皮内弥漫性炎症细胞浸润,局部形成中性粒细胞脓疡,其间可见菌团样颗粒结构(图4)。

图3 菊花样菌团结构,内见放射状排列的菌丝Fig.3 Chrysanthemum-like cenobium with radial arrangement of hyphae

图4 真皮内弥漫性炎症细胞浸润,局部形成中性粒细胞脓疡,其间可见菌团样结构Fig.4 Diffuse infiltration of inflammatory cells in the dermis with the neutrophil abscess,cenobium-like particles
微生物学检查:2例患者结核分枝杆菌感染T细胞斑点试验均阴性。真菌学镜检及培养均为阴性。取脓液行常规细菌培养,结果为阴性。病例一再次取脓液划线接种于脑心浸液血琼脂平板,置厌氧袋中,37℃培养48 h后可见灰白色结节状或臼齿状菌落,纯化后细菌生长呈形态单一的似硫磺颗粒样粗糙菌落。革兰染色为阳性丝状杆菌,其单一的菌丝体无隔,有分枝,呈特征性“V”或“Y”形(图5)。菌种鉴定为溶齿放线菌(Actinomyces odontolyticus)。病例二再次取脓液划线接种于脑心浸液血琼脂平板上,置5%CO2孵箱中,37℃培养72 h后可见淡黄色粗糙菌落,表面干燥,边缘陷入培养基中。革兰染色为阳性杆菌,其单一的菌丝体细长,有气生菌丝(图6)。菌种鉴定为星形诺卡菌(Nocardia asteroides)。
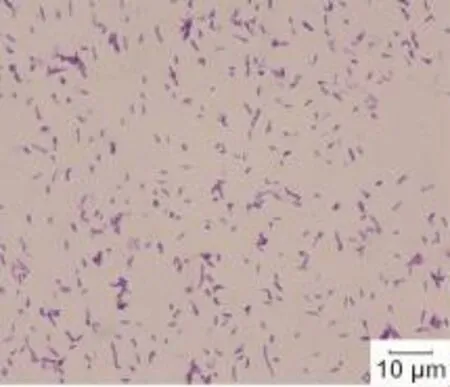
图5 革兰染色阳性的丝状杆菌,菌丝体有分枝,呈“V”或“Y”形Fig.5 Gram-positive filamentous bacillus,mycelium with branching shaped like“V”or“Y”
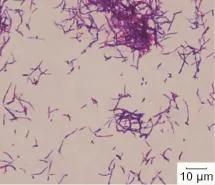
图6 革兰染色阳性的杆菌,菌丝体细长,有气生菌丝Fig.6 Gram-positive bacillus,slender mycelium with aerial mycelium
分子生物学诊断:提取细菌DNA测序,病例一BLAST结果与溶齿放线菌有99%的同源性。病例二BLAST结果与星形诺卡菌有99%的同源性。
据此诊断,病例一为原发性皮肤型放线菌病,病例二为原发性皮肤型诺卡菌病。
2.2 治疗经过及预后
2例患者均予以切开患处排脓,用双氧水反复冲洗。其中病例一予以青霉素钠960万U,早晚静脉注射,治疗2周后窦道停止排脓并闭合,后改用口服阿莫西林/克拉维酸钾片(含阿莫西林200 mg、克拉维酸钾28.5 mg)4片,分2次服用维持治疗。病例二予以口服复方磺胺甲唑片(含磺胺甲唑0.4 g、甲氧苄啶80 mg)6片,分3次服用,治疗2周后好转,脓液明显减少,现维持治疗中。
3 讨论
放线菌与诺卡菌均属放线菌目,革兰染色阳性,为单细胞原核微生物,是细菌的一种特殊类型,广泛存在于土壤、植物、空气及江河湖泊等自然环境中,人体在免疫力下降或免疫缺陷时易感染致病。两者导致的皮肤感染临床表现相似,均为慢性肉芽肿性改变伴破溃、流脓及局部压痛,有特征性的“硫磺颗粒”排出,且生长缓慢,培养周期较长,临床医师易混淆,从而漏诊或误诊。但两者又有各自特点,需仔细鉴别(表1)。
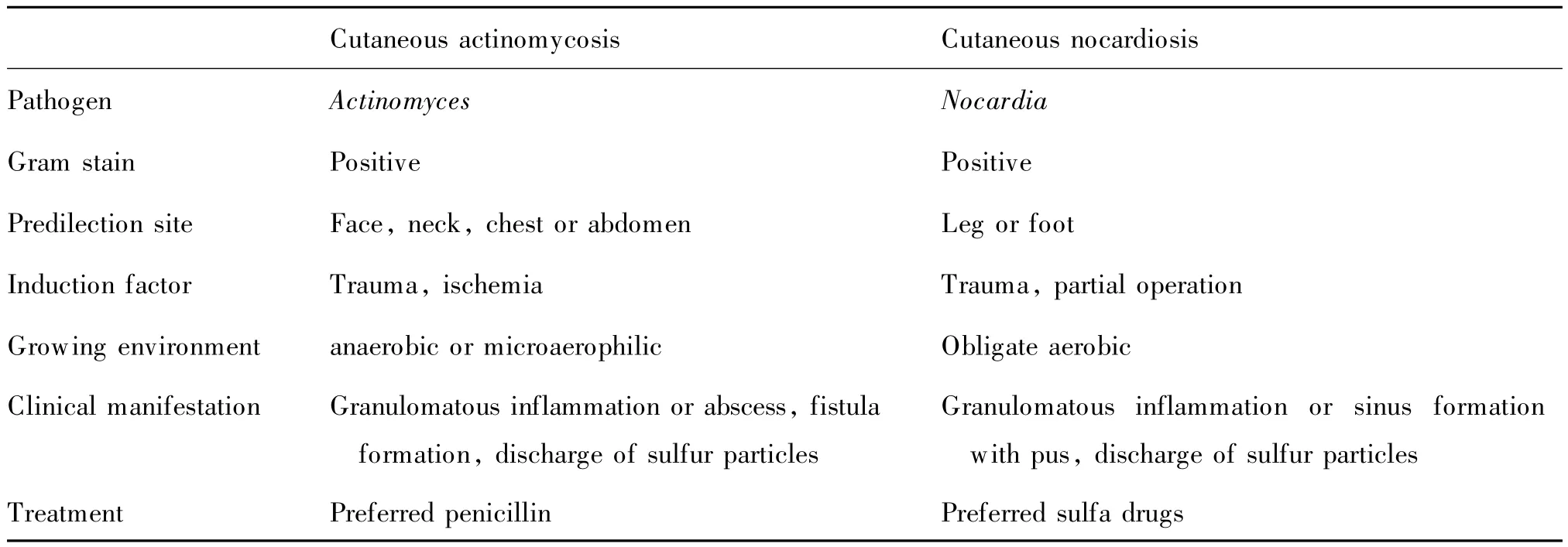
表1 皮肤放线菌病与诺卡菌病的鉴别诊断Tab.1 Differential diagnosis of cutaneous actinomycosis and nocardiosis
放线菌病是由放线菌引起人畜共患的一种渐进性、化脓性、肉芽肿性的亚急性至慢性感染性疾病。由Langenbeek在1845年首先叙述,有报道患病男女比为3∶1。其诊断有赖于特异性的临床表现、组织病理学检查和微生物学检查[2]。目前陆续有多个国家报道这种感染,典型感染位于面颈部、胸部和腹部。其主要表现为肉芽肿性炎症或脓肿及窦道形成,排出特征性的“硫磺颗粒”[3]。原发于皮肤的放线菌病较少见,通常与外源性创伤和局部缺血有关。放线菌属于原核生物界、厚壁菌门、放线菌纲、放线菌目,因不含分枝菌酸而归于放线菌属。最常见的为衣氏放线菌(A.israelii)和戈氏放线菌(A.gerencseriae),其次为内氏放线菌(A.naeslundii)、溶齿放线菌、黏放线菌(A.viscous)、迈氏放线菌(A.meyeri))和丙酸杆菌 (Propionibacterium propionicun)。在体内,这些放线菌聚集成1~2 mm大小的菌落,形成所谓的“硫磺颗粒”,这些颗粒几乎是特征性的,但没有这些颗粒并不能完全排除放线菌病的诊断,因为其检测有时非常困难[4]。根据组织学上的慢性窦道形成、纤维化及皮下肉芽组织伴菊花样菌团结构,结合微生物学检测到放线菌可作出诊断。皮肤感染放线菌通常与外源性创伤和局部缺血有关。本文1例患者原有上颌窦癌,放疗后组织结构改变导致局部缺血可能是致病原因之一。
放线菌病的治疗常采用药物、手术及支持疗法等综合措施。药物疗法中青霉素为首选药,用量和疗程依病情轻重而定。为加强青霉素的疗效,亦可与磺胺类药物合用,后者每日1 g口服。当出现青霉素过敏、青霉素治疗无效或其他原因不能耐受时,可选用红霉素、四环素、林可霉素及利福平等广谱抗菌药物。对于所有浅部病灶及窦道脓肿等,均应切除或切开引流。对于严重、泛发感染患者,应注意补充营养,并适当应用免疫调节剂以增强抵抗力。因为放线菌生长于厌氧或微需氧环境,常伴发其他细菌感染,如消化链球菌、普雷沃菌、梭杆菌、拟杆菌、葡萄球菌、链球菌和肠杆菌等,且取决于放线菌感染的部位,所以放线菌病的治疗需同时针对其他病原体。有学者推荐氨基青霉素类和β-内酰胺酶抑制剂用于一线治疗[5],由于氨基糖苷类或林可霉素的良好组织渗透性,可作为联合用药[6]。但即使采用了合适的、高剂量的抗生素治疗,若诊断不及时也易导致疾病演变成慢性迁延,故早期诊断和治疗是关键。
诺卡菌病是由放线菌目中的诺卡菌[7]引起的人或动物中少见的感染性疾病。皮肤诺卡菌病好发于腿部和足部,故又称足分枝菌病。诺卡菌革兰染色阳性,抗酸染色阳性,为专性需氧菌。体内分离获得的诺卡菌病病原体中,35%为星形诺卡菌,其他还有巴西诺卡菌(N.brasiliensis)、鼻疽诺卡菌(N.farcinica)、豚鼠诺卡菌(N.caviae)等,可引起局灶性或播散性感染。局部外伤、手术、静脉置管术、动物抓伤或昆虫叮咬是皮肤诺卡菌感染的常见途径[8]。诺卡菌病的全球发病率还没有确切数据,美国每年有500~1 000例诺卡菌病报道[9],可发生于各人种及各年龄组,男女比为2∶1~3∶1[10]。研究显示,艾滋病、感染、饮酒、器官移植、淋巴系统肿瘤可导致播散性诺卡菌病[11,12]。细胞介导的免疫反应是机体抵御诺卡菌感染的主要方式。研究证明,特异性T细胞抗原可增强无胸腺裸鼠对诺卡菌感染的致敏性,免疫兔后发现其T细胞可增加巨噬细胞对诺卡菌吞噬及生长的抑制作用[7]。因此,在细胞免疫缺陷患者中,白细胞介素12(interleukin 12,IL-12)、γ干扰素(interferon γ,IFN-γ)的缺失使感染概率增加,尤其是系统性感染。健康人群也有诺卡菌感染的报道,主要是局部感染,如皮肤及软组织感染。
诺卡菌不是人体正常菌群,但缓慢的生长特性使其感染不易诊断,导致不能及时有效地给予治疗。因此,进行适当的组织标本取材,从组织或体液分泌物中检出病原体,及时诊治疾病是防止其扩散的有效措施[13]。目前磺胺类药物是治疗诺卡菌病的一线药物,首选甲氧苄啶-磺胺甲唑[14],推荐剂量为每日甲氧苄啶5~10 mg/kg加磺胺甲唑20~50 mg/kg,分2~4次给予。给药途径主要依据患者的临床状态。给予最初治疗,7~10 d内起效,后根据临床缓解情况于3~6周后改为维持治疗。阿米卡星、亚胺培南、米诺环素、利奈唑胺、头孢菌素类药物可作为联合用药或替代治疗。有报道,小剂量的利奈唑胺成功治疗了中枢神经系统诺卡菌感染[15]。但也有报道经4周利奈唑胺治疗后,血中药物浓度易达中毒剂量,故不能用于常规治疗。此外,成功治愈诺卡菌病需联合内科药物及适时的外科引流手术的治疗。
放线菌病和诺卡菌病还需与其他一些感染性皮肤肉芽肿性疾病鉴别。①皮肤结核(cutaneous tuberculosis):是由结核分枝杆菌直接侵犯皮肤或由其他脏器结核灶内的结核分枝杆菌经血行或淋巴系统播散至皮肤组织所致的皮肤损害,临床表现各异。其中疣状皮肤结核及寻常狼疮亦表现为慢性肉芽肿性改变,呈斑块状伴有破溃、流脓。通过皮肤组织病理学检查、组织或脓液结核分枝杆菌培养、结核菌素试验、结核分枝杆菌DNA的PCR检测等可作出诊断。早期、足量、规则、全程的抗结核治疗有效。②孢子丝菌病(sporotrichosis):是由申克孢子丝菌引起的皮肤、皮下组织及其附近淋巴管的慢性感染,可引起化脓、破溃及渗出。依据临床表现,结合真菌培养和组织病理学检查可确诊,系统性抗真菌治疗或碘化钾治疗有效。③着色芽生菌病(chromoblastomycosis):是由暗色孢科真菌引起的皮肤及皮下组织感染,好发于身体暴露部位,最常见于小腿、足部和前臂。表现为疣状或乳头瘤样增生斑块,压之有脓液溢出。根据临床表现,真菌学检查和组织病理学中见到硬核体及培养出现暗色孢科真菌生长可确诊,系统性抗真菌治疗有效。
因此,若临床表现为慢性炎性肉芽肿病变,而结核分枝杆菌及真菌学检查均阴性,需提高警惕,判别是否为放线菌类感染。随着技术进步及对放线菌病和诺卡菌病认识的加深,相信会有更便利的检查方法及更有效的治疗方案出现。本文不足之处在于针对放线菌病和诺卡菌病的各自局部宿主微环境改变和细胞因子表达差异研究不够,有待进一步探讨。
[1] Song E,Jaishankar GB,Saleh H,Jithpratuck W,Sahni R,Krishnaswamy G.Chronic granulomatous disease:a review of the infectious and inflammatory complications[J].Clin Mol Allergy,2011,9(1):10.
[2] Schaal KP,Lee HJ.Actinomycete infections in humans—a review[J].Gene,1992,115(1-2):201-211.
[3] Fazeli MS,Bateni H.Actinomycosis:a rare soft tissue infection[J].Dermatol Online J,2005,11(3):18.
[4] Clarridge JE 3rd,Zhang Q.Genotypic diversity of clinical Actinomyces species:phenotype,source,and disease correlation among genospecies[J].J Clin Microbiol,2002,40(9): 3442-3448.
[5] Smith AJ,Hall V,Thakker B,Gemmell CG.Antimicrobial susceptibility testing of Actinomyces species with 12 antimicrobial agents[J].J Antimicrob Chemother,2005,56(2):407-409.
[6] Al-Niaimi F,Patel A,Blessing K,Fox R,Burden AD.Cutaneous actinomycosis presenting as chronic mastitis[J].Clin Exp Dermatol,2010,35(2):149-151.
[7] Beaman BL,Beaman L.Nocardiaspecies: host-parasite relationships[J].Clin Microbiol Rev,1994,7(2):213-264.
[8] Paredes BE,Hunger RE,Braathen LR,Brand CU.Cutaneous nocardiosis caused by Nocardia brasiliensis after an insect bite[J].Dermatology,1999,198(2):159-161.
[9] Beaman BL,Burnside J,Edwards B,Causey W.Nocardial infections in the United States,1972-1974[J].J Infect Dis,1976,134(3):286-289.
[10] Matulionyte R,Rohner P,Uçkay I,Lew D,Garbino J.Secular trends of nocardia infection over 15 years in a tertiary care hospital[J].J Clin Pathol,2004,57(8):807-812.
[11] Boiron P,Provost F,Chevrier G,Dupont B.Review of nocardial infections in France 1987 to 1990[J].Eur J Clin Microbiol Infect Dis,1992,11(8):709-714.
[12] Dias M,Nagarathna S,Mahadevan A,Chandramouli BA,Chandramuki A.Nocardial brain abscess in an immunocompetent host[J].Indian J Med Microbiol,2008,26(3):274-277.
[13] Guide SV,Stock F,Gill VJ,Anderson VL,Malech HL,Gallin JI,Holland SM.Reinfection,rather than persistent infection,in patients with chronic granulomatous disease[J].J Infect Dis,2003,187(5):845-853.
[14] Alavi Darazam I,Shamaei M,Mobarhan M,Ghasemi S,Tabarsi P,Motavasseli M,Mansouri D.Nocardiosis:risk factors,clinical characteristics and outcome[J].Iran Red Crescent Med J,2013,15(5):436-439.
[15] Pea F,Cojutti P,Pagotto A,Cristini F,Furlanut M,Viale P.Successfullong-term treatmentofcerebralnocardiosiswith unexpectedly low doses of linezolid in an immunocompromised patient receiving complex polytherapy[J].Antimicrob Agents Chemother,2012,56(6):3438-3440.
·国外研究信息·
肿瘤坏死因子受体相关因子3调节调节性T细胞的效应器功能和体液免疫应答
调节性T细胞(Treg细胞)控制免疫应答的不同方面,但其如何调控效应器功能尚不完全明确。该研究鉴定了肿瘤坏死因子受体相关因子3(TRAF3)是Treg细胞的功能效应器。在Treg细胞中特异性敲除TRAF3后,CD4+T细胞稳态受损,表现为Th1型效应/记忆T细胞增加。此外,Treg细胞中TRAF3敲除还增加抗原刺激引起的滤泡辅助性T细胞(TFH细胞)激活,伴随着生发中心形成增加及高亲和性IgG抗体产生。虽然TRAF3敲除并没有减少Treg细胞的总比例,但减少滤泡调节性T细胞(TFR细胞)的抗原刺激产生。Treg细胞中TRAF3信号通路是保持较高水平可诱导共刺激分子(ICOS)所必需的,也是TFR细胞生成和抑制抗体反应所必需的。该研究表明,TRAF3作为Treg细胞的功能效应器,具有调节抗体反应的功能,提示其在Treg细胞介导ICOS表达中起重要作用。
(Chang JH,et al.J Exp Med,2014,211(1):137-151.)
Differential diagnosis and treatment of infectious cutaneous granuloma caused by Actinomyces and Nocardia
MA Ying1,WU Shi2,HUANG Hai-Hui2,YANG Yang2,CHEN Lian-Jun1
1.Department of Dermatology,Huashan Hospital,Fudan University,Shanghai 200040,China;2.Institute of Antibiotics,Key Laboratory of Clinical Pharmacology of Antibiotics,National Health and Family Planning Commission,Huashan Hospital,Fudan University,Shanghai 200040,China
Infections granuloma is a kind of chronic hyperplastic inflammation which is rarely caused by Actinomyces and Nocardia.As clinical symptoms and physical examination results of infectious granuloma caused by Actinomyces and Nocardia are similar,it is easily to lead to misdiagnosis or missed diagnosis.Here we presented a case of infectious granuloma caused by Actinomyces and a case of infectious granuloma caused by Nocardia.The final diagnosis was confirmed by pathological examination,bacterial culture and identification,and gene sequencing.We also summarized the etiology,epidemiology,clinical features,differential diagnosis,treatment and recent advances in these two infections,which could help to make the correct diagnosis without delay and choose the optimal treatment.There two infections have many similarities,and we need to distinguish them for proper therapy.The differential diagnosis with other granulomatous infections,such as tuberculosis,cutaneous sporotrichosis or chromoblastomycosis was also discussed.
Actinomyces;Nocardia;Infectious cutaneous granuloma
.CHEN Lian-Jun,E-mail:lianjunchan@163.com
2014-10-13)
“十二五”国家科技重大专项(2012ZX09303004-001),复旦大学附属华山医院启动基金(2013QD07)
陈连军

