RhoA/ROCK信号通路在左心疾病致大鼠肺动脉高压模型中的作用
吴进福,周晓慧,范慧敏,,林芳,宝璐尔,张林,姜丽华*,刘中民,*
(1.郑州大学第三附属医院麻醉科,郑州 450052;2.上海市心力衰竭研究中心,上海 200120;3.同济东方转化医学研究中心,上海 200120;4.同济大学附属东方医院心外科,上海 200120)
研究报告
RhoA/ROCK信号通路在左心疾病致大鼠肺动脉高压模型中的作用
吴进福1,周晓慧2,3,范慧敏2,3,4,林芳2,3,宝璐尔4,张林2,3,姜丽华1*,刘中民2,3,4*
(1.郑州大学第三附属医院麻醉科,郑州 450052;2.上海市心力衰竭研究中心,上海 200120;3.同济东方转化医学研究中心,上海 200120;4.同济大学附属东方医院心外科,上海 200120)
目的探讨RhoA/ROCK信号通路在左心疾病相关的大鼠肺动脉高压模型中的表达水平和作用。方法3~4周龄雄性SD大鼠20只,体重90~100 g,随机分为对照组(C组:n=10)、肺高压组(H组:n=10)。H组采用升主动脉固定缩窄术建造左心疾病相关肺动脉高压大鼠模型,C组大鼠行假手术处理(钛夹固定于血管旁纵隔组织而非升主动脉,其他所有手术操作同H组),在建模后60 d,对各组大鼠进行血流动力学(右心室收缩压、肺动脉压力)检测,处死大鼠并用PBS行在体心肺灌洗致双肺变白,左肺组织固定于4%多聚甲醛行病理切片以观察肺组织病理形态学变化、右肺组织冻存以备生物分子学检测(Rho激酶mRNA、RhoA mRNA、ET-A受体mRNA)。结果与C组相比,H组肺动脉压力、右心室收缩压明显增高(P<0.01),肺小动脉壁明显增厚,肺小动脉管腔狭窄甚至闭塞,管壁肥厚指数明显增大(P<0.01);与C组相比,H组肺组织的Rho激酶mRNA表达水平明显增加,RhoA mRNA、ET-A受体mRNA表达水平亦明显增加,差异均有统计学意义(P<0.01)。结论采用升主动脉固定缩窄术成功建造了左心疾病相关肺动脉高压大鼠模型;与C组相比,H组肺小血管壁明显增厚,肺组织的Rho激酶mRNA、RhoA mRNA、ET-A受体mRNA表达明显增高,该信号通路可能参与了左心疾病相关肺动脉高压的形成过程。
肺动脉高压;升主动脉缩窄;Rho激酶;RhoA;大鼠
肺动脉高压(pulmonary hypertension,PH)是由多种病因导致的一种极度严重的疾病,以肺血管阻力进行性加重为其临床特征,是死亡率较高的一种慢性消耗性疾病[1],其发病机制尚未完全阐明。已有研究表明,RhoA/ROCK信号通路的异常激活与肺血管内皮功能受损、肺血管收缩性增强以及肺血管壁结构重组等病理生理过程密切相关,在肺动脉高压发病机制中扮演重要角色[2]。RhoA/ROCK信号通路异常激活在肺动脉高压发生发展过程中所起的作用在多种肺动脉高压的动物模型中已经得到证明,如:丹佛海拔高度下诱导的fawn-hooded大鼠PH模型[3]、慢性低氧环境诱导的大鼠PH模型[4,5]、野百合碱诱导的大鼠PH模型[6]、血管内皮生长因子受体阻滞剂诱导的大鼠PH模型[7]等。然而,左心功能异常(收缩功能障碍、舒张功能障碍、心脏瓣膜病)是引发肺动脉高压的重要病因之一[8],RhoA/ ROCK信号通路的异常激活在左心疾病相关性PH中的作用却鲜有研究。另外,RhoA/ROCK信号通路与血管活性物质内皮素(ET-1)之间存在相互调节关系,抑制ROCK对心脏所起到的保护作用与间接下调ET-1的表达有关[9],而其在左心疾病相关性PH中是否有相似作用,尚不得而知。本研究拟通过升主动脉缩窄致大鼠肺动脉高压的模型,来探讨RhoA/ROCK信号通路在左心疾病致大鼠肺高压中的表达水平和作用。
1 材料与方法
1.1 材料
雄性SPF级SD大鼠20只,3~4周龄,体重90~100 g,由上海市实验动物中心提供【SCXK(沪) 2013-0016】,实验在同济大学实验动物中心进行【SYXK(沪)2009-0022】。随机分为2组:对照组(C组:n=10)、左心疾病相关肺高压组(H组:n= 10)。
1.2 模型制备
本研究采用冠状动脉开口以上的升主动脉缩窄手术来建造左心疾病相关大鼠肺动脉高压模型。腹腔注射1%戊巴比妥钠(CAS No:57-33-0,美国Sigma)对实验大鼠进行麻醉(用量:5 mL/100 g),用20G静脉留置针软管(批号:1200843,中国競玛)对麻醉后大鼠行经口气管插管术,接小动物呼吸机(产品型号:ALC-V8S,上海奥尔科特生物科技有限公司,参数设置:潮气量4~5 mL,频率70~80次/分),在胸部正中与前肢平行处行2~3 cm切口,钝性分离皮下肌肉组织充分暴露胸骨及气管,正中劈开胸骨1~2 cm,沿气管左侧向下逐渐钝性分离各组织,可去掉部分有碍术野的胸腺组织,充分暴露主动脉弓,迅速环绕升主动脉植入一个事先依据大鼠体重设定好内径(0.8 mm)的钛夹(产品标准号: YZB/国1931-2011,建德市康华医疗器械有限公司)以缩窄升主动脉的口径,在确认没有明显出血后于吸气末闭合胸腔,无菌外科逐层缝合切口,手术结束后各模型鼠单笼SPF级别饲养。对照组大鼠行假手术处理,即开胸分离升主动脉后,钛夹固定于周围纵隔组织而非升主动脉,其他操作同模型组。各组大鼠于手术操作60 d后行血流动力学检测及处死取材以备各指标的检测[10]。
1.3 血流动力学检测
在造模后第60天,对各组大鼠行血流动力学监测:腹腔注射1%戊巴比妥钠对大鼠进行麻醉(用量:5 mL/100 g),连接心电图电极,行心电监护,用75%的乙醇对大鼠颈部进行消毒,小心分离大鼠右颈外静脉,从右颈外静脉插入肝素化的聚乙烯测压管,测压管另一端连接换能器(保证换能器与心脏位置同高),由多导生理记录装置(Power Lab 8/30;AD Instruments,Sydney,Australia)进行检测记录,根据显示器波形变化判定测压管位置,先测定大鼠右心室收缩压,波形稳定后调整测压管位置,直至测压管进入肺动脉,待波形稳定,保存检测结果,分析波形,计算各组压力值(本步测压、分析波形、计算数据由上海市肺科医院肺循环实验室提供技术)。
1.4 病理学检查
各组大鼠用15 mL PBS液进行心肺灌洗,去除心肺组织内的血液,整体取下大鼠心肺组织,然后,新鲜左肺浸入4%多聚甲醛固定液中固定,固定时间至少72 h,之后制成蜡块并切片,用于HE染色行病理学检查,使用Image-Pro Plus 6.0对肺小动脉的直径及管壁进行测量,从而计算小动脉中层增厚的程度。
1.5 m RNA检测
(右肺组织行Rho激酶mRNA、RhoA mRNA、ET-A受体mRNA表达的检测)右肺组织置于无菌冻存管,液氮速冻之后于 -80℃冻存用于QPCR检测。引物由上海英潍基贸易有限公司合成,Rho激酶mRNA引物品号 A12925:上游序列为5’-CTGCGGGTACGAAGGTATCG-3’,下游序列为5’-AGCATCCAATCCATCCAGCA-3’;RhoA mRNA引物品号A12925:上游序列为5’-ACCAGTTCCCAGAGGTGTATG-3’,下游序列为5’-TTGGGACAGAAGTGCTTGACTTC-3’;ET-A受体mRNA引物品号A12925:上游序列为5’-CCGAGGAGCTCTAAGGGGAA-3’,下游序列为5’-CCAAAAGGACGCCAGAAAGC-3’;GAPDH引物品号 A12926:上游序列 5’-GCCATCAACGACCCCTTCATTG-3’,下游序列 5’-TGCCAGTGAGCTTCCCGTTC-3’;根据 TRNzol-A+总RNA提取试剂盒(目录号:66020,美国Ambion®)说明书的步骤进行大鼠肺组织总RNA提取;根据逆转录试剂盒(货号:AK2702,日本TaKaRa)说明书的步骤进行RNA反转录;根据Power SYBR® Green PCR Master Mix(货号:1407463,英国Applied Biosystems®)说明书步骤进行QPCR操作;测定样本mRNA的表达量。
1.6 统计学处理
本研究所得数据用SPSS 15.0统计学软件进行分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 右心室收缩压、肺动脉压检测结果
经右颈外静脉插入肝素化的聚乙烯测压管至右心室、肺动脉,测压管另一端连接换能器,由多导生理记录装置进行检测记录,结果显示,H组与C组相比,平均肺动脉压、右心室收缩压均显著升高,P<0.01(表1所示)。结果证明,利用升主动脉固定缩窄术成功建造大鼠肺动脉高压模型。
表1 两组血流动力学的比较(±s,mmHg,n=10) Tab.1 Hemodynamics of the two groups
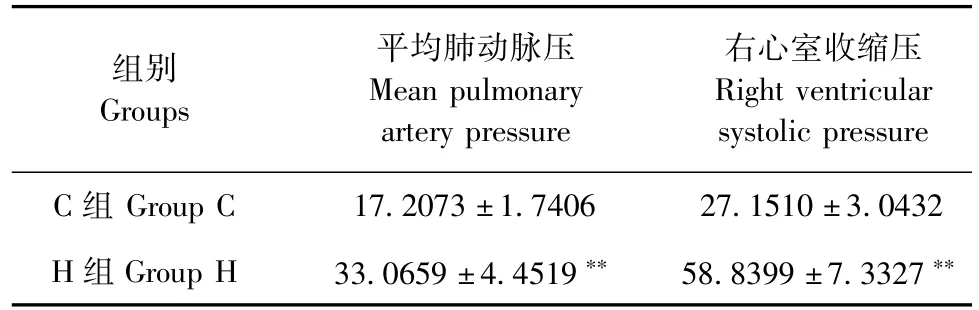
表1 两组血流动力学的比较(±s,mmHg,n=10) Tab.1 Hemodynamics of the two groups
注:与C组相比,**P<0.01。Note.**P<0.01,Compared with the group C.
右心室收缩压Right ventricular systolic pressure C组Group C 17.2073±1.7406 27.1510±3.0432 H组Group H 33.0659±4.4519**58.8399±7.3327**组别Groups平均肺动脉压Mean pulmonary artery pressure
2.2 肺组织病理学改变
经多聚甲醛固定后的大鼠肺组织进行石蜡包埋、切片、HE染色,染色后的切片使用软件Image-Pro Plus 6.0对肺小动脉的直径及管壁进行测量,从而计算并比较小动脉中层增厚的程度(肺小动脉管壁与血管直径的比值),结果显示,与C组(0.1655 ±0.03633)相比,H组(0.3864±0.06659)小动脉中层明显增厚,P<0.01(图1所示)。图1A、B分别显示HE染色的C组和H组肺组织,图1C为C组和H组肺小动脉中层厚度与肺小动脉直径比值的统计学结果。
2.3 肺组织Rho激酶mRNA、RhoA m RNA、ET-A受体mRNA表达的检测结果
RT-PCR测Rho激酶mRNA、RhoAmRNA、ET-A受体mRNA水平的表达:以GAPDH为内参对照,结果以Rho激酶mRNA、RhoA mRNA、ET-A受体mRNA与GAPDH mRNA的2-△△CT表示其相对表达量。结果显示,H组与C组相比,Rho激酶mRNA、RhoA mRNA、ET-A受体mRNA的相对表达量均明显增高,P<0.01(表2所示)。
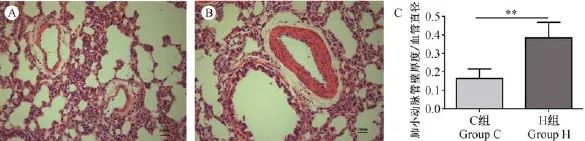
图1 肺组织病理改变Fig.1 Morphometric analysis of the pulmonary arteries
表2 两组Rho激酶mRNA、RhoA mRNA、ET-A受体mRNA相对表达量的比较(±s,n=10)Tab.2 mRNA levels of Rho kinase,RhoA and ET-AR in lungs of the two groups

表2 两组Rho激酶mRNA、RhoA mRNA、ET-A受体mRNA相对表达量的比较(±s,n=10)Tab.2 mRNA levels of Rho kinase,RhoA and ET-AR in lungs of the two groups
注:与C组相比,**P<0.01。Note.**P<0.01,compared with the group C.
ET-A受体mRNA相对表达量ET-AR mRNA levels C组Group C 1.0140±0.1377 0.9667±0.1412 1.0040±0.08159组别Groups Rho激酶mRNA相对表达量mRNA levels of Rho kinase RhoA mRNA相对表达量RhoA mRNA levels H组Group H 17.9391±1.2489**38.4689±3.0000**2.3926±0.2775**
3 讨论
依据病理表现、血流动力学特征以及临床诊治策略肺动脉高压分五大类:①动脉性肺动脉高压;②左心疾病所致肺动脉高压;③缺氧和/或肺部疾病引起的肺动脉高压;④慢性血栓栓塞性肺动脉高压;⑤多种机制和/或不明机制引起的肺动脉高压[11]。其中,作为第二大类肺高压的左心疾病所致的肺高压在临床上比单纯的动脉型肺动脉高压还要多见,并且这种病患群体的发病率和死亡率日益增加[12]。目前,常规治疗肺动脉高压的药物在左心疾病相关性PH治疗中的作用差强人意,因此,进一步探究本病的发病机制、探索新的治疗靶点十分必要。前期大量研究已表明,RhoA/ROCK信号通路异常激活在多种肺动脉高压大鼠模型中均起到至关重要的作用[3-7],该信号通路在左心疾病所致肺动脉高压的发生过程中是否发挥相似作用,仍需进一步的研究。
采用金属钛夹将大鼠升主动脉进行固定缩窄,以增加左心室后负荷,进而导致左心室压力增高、心室壁代偿肥大,久之会进一步发展为肺动脉高压,符合左心疾病相关肺动脉高压病人的病理发展过程,许多研究已证明了此建模方法的可行性[9,13-15]。本研究中我们采用金属钛夹缩窄大鼠升主动脉建立大鼠PH模型,并于建模后60 d比较C组与H组之间右心室收缩压及肺动脉压的差异,结果显示,该方法可成功建造大鼠肺动脉高压模型,血流动力学结果和病理学结果显示采用升主动脉缩窄术建造的大鼠肺动脉高压模型,与人类左心疾病所致肺动脉高压的病理生理状态相似,与文献报道一致。
ROCK(即Rho激酶)属于丝氨酸/苏氨酸激酶类家族,是小GTP结合蛋白RhoA一个重要的下游信号蛋白[16]。G蛋白偶联受体被激动因子(如ET-1、5-HT等)可通过 ET受体活化 RhoA进而激活ROCK,活化的ROCK可使平滑肌细胞内肌球蛋白轻链磷酸化酶(MLCP)的一个亚基—MYPT-1发生磷酸化,进而使MLCP失活、胞内磷酸化肌球蛋白轻链(p-MLC)水平增高,介导非Ca2+浓度依赖性的平滑肌细胞收缩;另一方面,活化的ROCK可激活细胞膜Ca2+通道增加Ca2+内流,胞内Ca2+浓度增加从而激活肌球蛋白轻链激酶(MLCK),活化的ML-CK促使MLC磷酸化,胞内p-MLC水平增高,介导Ca2+浓度依赖性的平滑肌细胞收缩;同时,ROCK可促进平滑肌细胞的分化、增生与移行,并参与调节内皮细胞移行和血管内皮屏障功能[17-19]。RhoA/ ROCK信号通路通过多条途径影响血管平滑肌的收缩,从而在PH的发生发展过程中起到关键作用。但有关该信号通路在左心疾病相关肺高压中的研究较少,本研究中,我们发现,与对照组相比,肺动脉高压组Rho激酶mRNA、RhoA mRNA、ET-A受体mRNA的表达水平显著升高,提示RhoA/ROCK信号通路的异常激活在此类肺高压模型中亦起到了至关重要的作用,且此信号通路的活化可能与ET-1分子表达量增高有关。另外,病理组织切片结果显示,肺动脉高压时存在肺小动脉血管重构的改变,此现象可能与RhoA/ROCK信号通路的异常激活有关,该结果为进一步在左心疾病所致肺高压中研究RhoA/ ROCK信号通路在肺微血管病变中的作用机制提供了部分实验数据。
因此,本研究的结果表明,通过缩窄升主动脉可成功建立大鼠肺动脉高压模型;在大鼠左心疾病所致的肺高压的发生模型中,Rho激酶mRNA、RhoA mRNA、ET-A受体mRNA的表达水平明显升高,提示RhoA/ROCK信号通路异常激活(可能与ET-1因子表达量增高有关),进而可能参与肺小动脉的血管重构,有关RhoA/ROCK信号通路如何介导左心疾病相关肺高压的发展过程,以及如何阻断该信号通路进而改善左心疾病相关肺高压的作用仍需进一步的研究。
[1] Raja SG,Dreyfus GD.Current status of bosentan for treatmentof pulmonary hypertension[J].Ann Card Anaesth,2008,11:6-14.
[2] Duong-Quy S,Bei Y,Liu Z,et al.Role of Rho-kinase and its inhibitors in pulmonary hypertension[J].Pharmacol Ther,2013,137:352-364.
[3] Nagaoka T,Gebb SA,Karoor V,et al.Involvement of RhoA/ Rho kinase signaling in pulmonary hypertension of the fawn-hooded rat[J].JAppl Physiol,2006,100:996-1002.
[4] Nagaoka T,Morio Y,Casanova N,etal.Rho/Rho kinase signalingmediates increased basal pulmonary vascular tone in chronically hypoxic rats[J].Am J Physiol Lung Cell Mol Physiol,2004,287:L665-L672.
[5] Hyvelin JM,Howell K,Nichol A,et al.Inhibition of Rho-kinase attenuates hypoxia-induced angiogenesis in the pulmonary circulation.Circ Res,2005;97:185-191.
[6] Nagaoka T,Fagan KA,Gebb SA,et al.Inhaled Rho kinase inhibitors are potent and selective vasodilators in rat pulmonary hypertension[J].Am JRespir Crit Care Med,2005,171:494-499.
[7] Barst RJ,McGoon M,Torbicki A,etal.Diagnosisand differential assessmentof pulmonary arterial hypertension[J].JAm Coll Cardiol,2004,43:40S-47S.
[8] McLaughlin VV,Archer SL,Badesch DB,et al.ACCF/AHA 2009 expert consensus document on pulmonary hypertension:a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians;American Thoracic Society,Inc.;and the Pulmonary Hypertension Association[J].J Am Coll Cardiol,2009,53:1573-1619.
[9] Mita S,KobayashiN,Yoshida K,etal.Cardioprotectivemechanisms of Rho-kinase inhibition associated with eNOS and oxidative stress-LOX-1 pathway in Dahl salt-sensitive hypertensive rats [J].JHypertens,2005,23:87-96.
[10] 张蕙,陈良万.左心疾病所致的肺动脉高压大鼠模型的制备方法[J].临床和实验医学杂志,2014,13(5):352-355.
[11] Simonneau G,Robbins IM,BeghettiM,et al.Updated clinical classification of pulmonary hypertension[J].JAm Coll Cardiol,2009,54:S43-S54.
[12] Gerges C,Gerges M,Lang MB,et al.Diastolic pulmonary vascular pressure gradient:a predictor of prognosis in“out-of-proportion”pulmonary hypertension[J].Chest,2013,143(3): 758-766.
[13] 包伟珂,柏树令,王军.升主动脉缩窄心衰鼠模型制作及临床意义[J].中国临床解剖学,1999,17:3662367.
[14] Collins JF,Pawlosk-Dahm C,Davis MG,et al.The role of the cytoskeleton in left ventricular pressure overload hypertrophy and failure[J].JMol cell Cardiol,1996,28(7):1435-1443.
[15] 张曼,屈晨,曾定尹.Rho/Rho激酶在压力负荷心力衰竭大鼠心肌组织的表达[J].中华心血管病杂志,2005,33(1): 73-76.
[16] Satoh K,Fukumoto Y,Shimokawa H.Rho-kinase:important new therapeutic target in cardiovascular diseases[J].Am J Physiol Heart Circ Physiol,2011,301:H287-296.
[17] Loirand G,Guérin P and Pacaud P.Rho kinases in cardiovascular physiology and pathophysiology[J].Circ Res,2006,98: 322-334.
[18] Ghisdal P,Vandenberg G,Morel N.Rho-dependent kinase is involved in agonist-activated calcium entry in rat arteries[J].J Physiol,2003,551:855-867.
[19] Luykenaar KD,Brett SE,Wu BN,et al.Pyrimidine nucleotides suppress KDR currents and depolarize rat cerebral arteries by activating Rho kinase[J].Am J Physiol Heart Circ Physiol,2004,286:H1088-H1100.
The role of RhoA/ROCK pathwaj in the ratmodels of left heart disease-associated pulmonarj hjpertension
WU Jin-fu1,ZHOU Xiao-hui2,3,FAN Hui-min2,3,4,LIN Fang2,3,BAO Lu-er4,ZHANG Lin2,3,JIANG Li-hua1*,LIU Zhong-min2,3,4*
(1.Department of Anesthesiology,the Third Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China;2.Shanghai Heart Failure Research Center;3.Research Center for Translational Medicine;4.Department of Cardiac Surgery,Shanghai East Hospital,Tongji University School of Medicine,Shanghai200120)
ObjectiveTo investigate the role of RhoA/Rho-kinase pathway in ratmodels of left heart disease-associated pulmonary hypertension(PH-LHD).MethodsTwentymale SD rats(3-4 week-old,90-100 g)were randomly divided into two groups(10 rats in each group):the group C(control group)with sham operation,and group H(pulmonary arterial hypertension).The ratmodel of leftheartdisease-associated pulmonary hypertension was established by supracoronary aortic banding in the group H,and the sham surgerywas applied for the rats in the group C(The titanium clip wasfixed at themediastinal tissue adjacent to the artery rather than the ascending aorta).On day 60 after the operation,the cardiac functions,including rightventricular systolic pressure and pulmonary artery pressurewere evaluated.After that,all rats were sacrificed and treated with cardiopulmonary lavage in vivo until the lung became white.Then the left lung tissues were fixed in 4%paraformaldehyde for pathological observation while the right lung tissues were frozen formRNA detection.ResultsCompared with the group C,both ventricular systolic pressure and pulmonary artery pressure in the group H were increased significantly(P<0.01).Pathological data demonstrated that the pulmonary artery walls in H group were much thicker than that in the group C.Moreover,vascular wall hypertrophy index in the group H was increased greatly compared with that in the group C(P<0.01).QPCR data showed thatmRNA levels of Rho kinase,RhoA and ET-A R in the group H were up-regulated compared with the group C(P<0.01).ConclusionsRatmodelof leftheartdisease-associated pulmonary arterial hypertension can be successfully established by supracoronary aortic banding.Rho-kinase-mediated pathwaymay contribute to the pathogenesis and progress of leftheart disease-associated pulmonary arterial hypertension.
Pulmonary arterial hypertension;Supracoronary aortic banding;Rho kinase;RhoA;Rat
Q95-33
A
1005-4847(2015)06-0612-05
10.3969/j.issn.1005-4847.2015.06.013
2015-07-07
科技部国际合作项目(2012DFG31440);上海市科委(13411951402);上海市领军人才(2012053);上海市浦东新区国际合作项目(Pkj2013-z03)。
吴进福(1988-),男,硕士研究生,专业:麻醉学。
姜丽华(1963-),女,教授,硕士研究生导师,主要研究方向:围术期器官保护。Email:geda66@126.com;刘中民,1965-,男,教授,博士生导师,主要研究方向:心力衰竭。Email:zhongmin_liu@sina.com,

