糖尿病后肢缺血大鼠模型的建立与评估
齐一侠,张超,崔世军,罗涛,谷涌泉,李建新,张建,汪忠镐
(首都医科大学宣武医院血管外科,首都医科大学血管外科研究所,北京 100053)
研究报告
糖尿病后肢缺血大鼠模型的建立与评估
齐一侠,张超,崔世军,罗涛,谷涌泉,李建新,张建,汪忠镐*
(首都医科大学宣武医院血管外科,首都医科大学血管外科研究所,北京 100053)
目的研究糖尿病肢体缺血模型的建立方法,为糖尿病下肢缺血和糖尿病足研究提供试验方法。方法 取25只Wistar大鼠分为模型组、对照组及假手术组,模型组腹腔注射链脲佐菌素(60 mg/kg)诱发糖尿病,血糖达16.8 mmol/L模型成功。糖尿病造模成功后,手术结扎大鼠左侧股动脉、剪断周围动脉分支,建立左后肢缺血模型。术后激光多普勒监测动态监测双后肢血流,同时观察血糖、体重及尿量变化。术后21 d取后肢腓肠肌行肌肉HE染色,取结扎处股动脉免疫荧光染色观察血管平滑肌增殖情况,CD31免疫组织化学染色检测后肢肌肉毛细血管密度。结果在治疗后21 d时,无论是最大膀胱容量、漏尿点压力还是收缩力/肌重比,IGF-1组、电刺激组治疗效果更佳;而IGF-1组与电刺激组两组之间比较差异无显著性 (P>0.05)。结论成功建立有效、简便易行的糖尿病后肢缺血模型,可用于糖尿病肢体缺血及糖尿病足的药物干预研究。
糖尿病;肢体缺血;大鼠模型
糖尿病是以慢性高血糖状态为特征的代谢异常综合征,随着病情进展,血糖异常增高损伤了血管新生的能力,导致糖尿病并发症冠状动脉疾病(CAD)和外周动脉疾病(PAD)发生率明显升高。PAD是除外心、脑动脉外的四肢、躯干动脉多发狭窄、闭塞及动脉瘤扩张为特征的外周动脉缺血性病变,以双下肢膝关节以下为多见。模拟糖尿病并发外周动脉疾病的动物模型,对糖尿病血管疾病研究至关重要,由此可帮助我们理解潜在的发病机制和研发新的治疗方法。本实验在目前常用的糖尿病大鼠模型的基础上建立后肢缺血模型,以探索动物模型制备的最佳条件;监测血流动态演变及观察组织病理改变,并与单纯肢体缺血模型比较,为后续的干预实验打下基础。
1 材料与方法
1.1 材料
1.1.1 动物
SPF级雄性8周龄 Wistar大鼠20只,200~250 g,北京维通利华动物技术有限公司提供[SCXK(京)2010-0002],实验在首都医科大学宣武医院动物实验中心[SYXK(京)2010-0013]进行。
1.1.2 试剂与仪器
链脲佐菌素(streptozotocin,STZ,Sigma),CD31兔抗鼠多克隆抗体 (PECAM-1,sc-1506R,Santa Cruz),a-SMA人抗鼠单克隆抗体(A5228,Sigma),FITC-/Rho交联二抗(Jackson Immuno-Research Laboratories),二步法免疫组化检测试剂盒(PV-9001,北京中山金桥生物技术有限公司);卓越IV型血糖仪(德国罗氏),激光多普勒血流成像仪(瑞典百灵威),小动物气体麻醉机,4倍手术放大镜,正置荧光显微镜 (80i,Nikon 80i),NIS-Elements BR图像处理软件系统(Nikon)。
1.2 方法
1.2.1 大鼠糖尿病模型建立与分组
采用随机抽样原则,抽取12只设为模型组,其8只设为对照组,5只为假手术组。造模前大鼠禁食,不禁水,确保大鼠禁食8 h。STZ溶于pH=4.5的的柠檬酸缓冲液中,配制成浓度为8 mg/mL的 STZ溶液,模型组大鼠按60 mg/kg腹腔单次注射,建立糖尿病模型大鼠12只,于注射后3、7 d测随机血糖>16.8 mmol/L水平为成模标准,不符予以剔除;对照组腹腔注射生理盐水。检测STZ注射前,注射后第1、3、7、14、21天大鼠称重、测量非禁食血糖。
1.2.2 建立下肢缺血模型
腹腔注射STZ后3 d,模型组、对照组大鼠10%水合氯醛腹腔麻醉。取左下肢腹股沟韧带中点皮肤切口,分离脂肪及筋膜层,4倍手术放大镜下暴露、分离股动脉及其分支,在分出旋髂浅动脉之前、分出隐动脉之前结扎股动脉并剪断结扎股动脉,并结扎所有股动脉分支,术毕缝合皮肤,同时取5只同体重大鼠作为假手术组,仅切开股鞘,之后并缝合皮肤。分别在大鼠股动脉结扎术前、术后、术后第3、7、14、21天,在室温26~28℃相对恒定下,恩氟烷气体麻醉大鼠,采用激光多普勒血流成像仪激光探头放于动物的足底,连续测量5 min;记录双侧血流基础值(PU值),计算患侧/健侧比率。
1.2.3 病理学检测
术后21 d,取大鼠左下肢腓肠肌及左侧结扎段股动脉及右侧股动脉,4%甲醛固定,石蜡包埋,连续横切5μm厚切片,行HE和免疫组织化学染色(1∶500稀释)免疫组化染色,每张切片随机取6个不同的高倍视野(×400),NIS-Elements BR图像处理软件统计每个视野内 CD31阳性毛细血管数(个/ HPF);行免疫荧光染色检测血管平滑肌增殖情况。
1.3 统计学处理
采用SPSS13.0统计软件对实验结果进行分析,各组计量资料以均数±标准差(±s)表示。组间比较采用两独立样本均数的t检验,检验显著性取α=0.05,P<0.05为差异有显著性。
2 结果
2.1 糖尿病模型指标监测结果
根据对照组与模型组24~48 h的尿量情况(图1),可直接观测到模型组在腹腔注射STZ后,尿量较对照组明显增多,而且粪便密度也较对照组明显增多。由表1可见对照组体重量正常增长,在腹腔注射STZ后1 d体重出现轻微下降,随之体重增长缓慢,第3~21天模型组与对照组比较差异有统计学意义,由此可见模型组大鼠出现典型的“三高一低”糖尿病症状。同时我们也对大鼠血糖进行验证(表1),STZ腹腔注射后模型大鼠血糖升高,并维持在较高水平,血糖值>16.8 mmol/L,并且可维持21 d,而对照组大鼠血糖始终保持在正常范围,二者比较差异明显,有统计学意义,证实了糖尿病模型建立成功。

图1 糖尿病大鼠模型尿量改变情况Fig.1 Changes of urinary volume in the STZ-induced diabetic rats
2.2 后肢缺血模型指标监测结果
图2A可见,激光多普勒测血流值测得模型组和对照组患肢血流在术后1d下降至最低,随后血流值恢复,术后7~21 d患肢血流明显增多。在股动脉结扎切除前,模型组和对照组患侧/健侧比趋近于1;术后,在模型组和对照组血流比值均减少,两组并无明显差别。而在术后第7、14、21天模型组血流比值较对照组明显减弱,差异有显著性,表明患侧血流值恢复情况较对照组差;而假手术组术前术后各时间点血流比值差异无显著性。通过21 d获取大鼠患侧后肢腓肠肌进行横断切片,CD31免疫组织化学染色统计毛细血管发现(图2B),对照组糖尿病组大鼠患侧和健侧的毛细血管较对照组、假手术组明显减少。而通过计算患侧/健侧毛细血管数比值:对照组为 75.8%、模型组为 63.1%、假手术组为103.8%,表明糖尿病减弱大鼠毛细血管新生功能,下肢血流恢复受损。此外,我们对肌肉进行HE染色发现(图3A):与假手术组比较,对照组、模型组肌肉组织体积缩小,肌纤维萎缩,肌纤维间隙变宽,均呈现缺血性变化。模型组手术侧肌纤维萎缩较对照组明显,并呈现肌束膜内肌原纤维萎缩。
2.3 后肢股动脉组织病理改变
大鼠在术后21 d取其结扎处股动脉主干HE染色(图3B)可见:与假手术组比较,对照组、模型组股动脉均出现不同程度的内膜增厚,增厚的组织均为有核结构,模型组增厚程度较对照组明显严重。进而对该部分组织进行免疫荧光化学染色(图3C)发现增殖内膜均为a-SMA阳性的血管平滑肌细胞,并非沉积血小板及血栓结构,模型组血管平滑肌增殖情况较对照组更加严重。由此说明血糖升高能够促进血管平滑肌增殖。
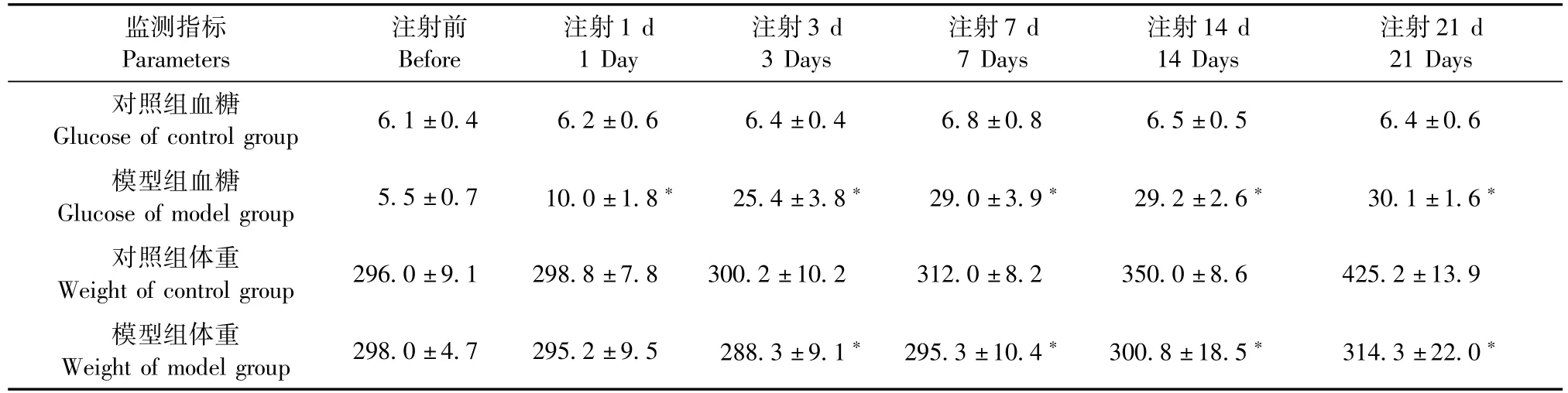
表1 大鼠血糖、体重指标的比较Tab.1 Comparison of blood glucose and body weight between themodel and control groups
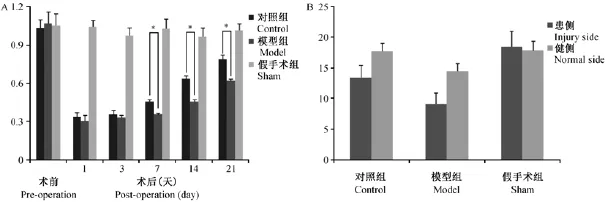
图2 糖尿病大鼠缺血模型血流指标变化情况Fig.2 Changes of blood flow after operation in the STZ-induced diabetic ischemic rats.
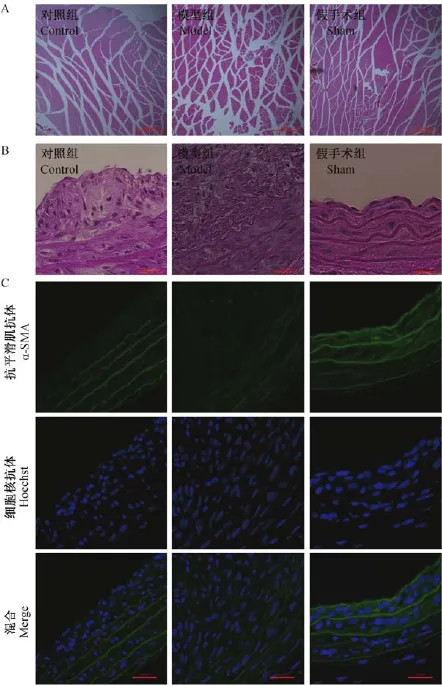
图3 糖尿病大鼠血管肌肉病理改变情况(A×100,B-C×400)Fig.3 Pathological changes of the diabetic ischemia ratmodels
3 讨论
本研究经过系统摸索,通过评估糖尿病大鼠血糖、体重、后肢血流及血管组织病理检测新生毛细血管的基础上,建立了糖尿病肢体缺血模型,为糖尿病血管病变相关研究提供了重要的实验基础。
在STZ已经广泛用于制作大鼠的糖尿病模型[1],从大鼠腹腔注射STZ后的体重、尿量、便量可以观察到大鼠明显的“多饮、多食、多尿,生长缓慢”的典型糖尿病症状可作为糖尿病模型的初筛标准。血糖值可作为衡量造模成功与否的确定标准,而国内外文献对血糖值变化标准不一:国内把空腹血糖>7.8 mmol/L或随机血糖>16.67 mmol/L作为成模的标准[2];国外则采用:随机血糖>200 mg/dL或空腹血糖>150 mg/dL(血糖换算18 mg/dL=1 mmol/L)作为成模的标准[3]。本实验采用非空腹血糖作为判断糖尿病模型成功与否的标准的优点在于时间控制灵活,可操作性强,影响因素少,更重要是可对后续肢体缺血手术避免不必要应激,减少术中、术后死亡,连续测量2次随机血糖可以较好的反应血糖水平。
连续观测随机血糖,模型组和对照组差别明显表明糖尿病模型稳定,可以维持21 d以上,可以作为后续施加药物治疗及各种干预因素,建立糖尿病各种并发症模型方法。而STZ注射后3 d大鼠出现体重减轻,尿便量明显增多,而后期模型组体重增加缓慢,较模型组仍有统计学意义。
急性缺血是肢体缺血模型的主流,最早源于家兔的缺血模型[4]。其制作方法大体上以结扎并切除后肢的供血动脉主干或其分支为主[5]。而大鼠的股动脉除延续为腘动脉外,还分为旋髂浅动脉、肌支、腹壁浅动脉、膝最上动脉、隐动脉,分离结扎时须处理这些分支[6]。本实验采用连续检测下肢血流的方法,单纯结扎股动脉,血流值改变不明显,而去除其他分支血管后,可见血流值明显下降,其原因可能与大鼠后肢供血动脉分支之间以及盆部与下肢动脉分支之间存在丰富的吻合有关[7]。而本实验在手术中发现:股动脉的各个分支中,腹壁浅动脉位置表浅易于处理,而旋髂浅动脉多分布在腹股沟韧带内侧上方,处理时易忽略,而造成术后血流改变不明显,术中应注意予以确切结扎。而股动脉结扎后的缺血模型标准评价可以应用激光多普勒测定血流值(PU值)评价,本实验结果表明术后基础血流值小于15,可以认为缺血模型建立成功。
然而持续肢体缺血的动物模型必须具备以下4个条件[8]:(1)出现一定程度的缺血;(2)缺血可以保持一段时间;(3)缺血可以通过实验测得的数值所证实;(4)缺血的肢体和正常的肢体可以进行比较。本实验还发现,在利用患侧/健侧血流比值消除环境、机体差异的基础上,连续测量下肢血流显示了正常大鼠在术后最初的1~3 d患肢血流改善不明显,到术后7~14 d患肢血流明显增多,血流有一个快速的增加,可能代表了对缺血状态的反应,显示出患肢侧支循环的再通和扩张。术后14~21 d患肢血流趋近平台期。而糖尿病大鼠在第7、14、21天、血流值都显著低于对照组,进一步的病理学研究发现HE染色:模型组的较对照组肌肉萎缩明显,并出现肌束膜内肌原纤维萎缩。免疫组织化学标记对照组大鼠在股动脉切除后21 d毛细血管密度明显增加,表明糖尿病损伤了大鼠对肢体缺血的血管新生应答。这与近年国外研究糖尿病肢体缺血文献结果一致,这可能与1型糖尿病损伤了VEGF依赖的血管新生机制有关,导致侧支建立恢复障碍[5,9]。同时通过免疫荧光染色验证了血管狭窄的主要病理改变为血管平滑肌增殖。
除本研究类似的糖尿病肢体缺血建模方法外,也存在其他研究糖尿病缺血方法,Lau[10]采用STZ诱导的糖尿病Wistar大鼠于足背部切除其全层皮肤造成糖尿病足溃疡模型。Katsuya在转基因糖尿病C57BLKS/Jdb/db小鼠的基础上,大腿背侧局部加压造成溃疡模型[11],但二者均没有阻断下肢血运。而在肢体缺血的研究中,Masaki在C57BL/6小鼠的基础上,结扎切断股动脉、股静脉同样导致了非重症肢体缺血,结扎切断髂动脉、髂静脉导致严重肢体缺血[12]。但此模型虽能完全模拟糖尿病肢体缺血的股动脉狭窄,但同时也造成了远端的静脉回流障碍,不符合糖尿病肢体缺血的静脉表现。
综上所述,本文所建立的糖尿病肢体缺血模型实验结果稳定、重复性好,是一种有效、简便、易行、廉价的糖尿病缺血模型制作方法,为利用此模型进行相关干预手段的研究提供良好的实验基础。
[1] Wu KK,Huan Y.Streptozotocin-Induced Diabetic Models in Mice and Rats[M].John Wiley&Sons,Inc.,2001.
[2] 农慧,盛庆寿,梁健,等.STZ诱导糖尿病大鼠模型的研究[J].广西医科大学学报,2010,27(1):4-5.
[3] 高秀莹,周迎生.2型糖尿病鼠类模型的研究进展[J].中国实验动物学报,2014,22(4):71-76.
[4] Madeddu P,Emanueli C,Spillmann F,et al.Murinemodels of myocardial and limb ischemia:diagnostic end-points and relevance to clinical problems[J].Vascul Pharmacol,2006,45(5):281-301.
[5] Couffinhal T,Silver M,Zheng LP,et al.Mousemodel of angiogenesis[J].Am JPathol,1998,152(6):1667-1679.
[6] 王增涛,郝丽文,李桂石,等,主编.WISTAR大鼠解剖图谱[M].山东:山东科学技术出版社,2009.
[7] 杨盛家,陈兵,罗涛,等.大鼠后肢急性缺血模型的构建及评估[J].中国普通外科杂志,2009,18(6):580-583.
[8] Pu L Q,Jackson S,Lachapelle KJ,et al.A persistent hindlimb ischemiamodel in the rabbit[J].J Invest Surg,1994,7(1):49 -60.
[9] Biscetti F,Straface G,De Cristofaro R,et al.High-mobility group box-1 protein promotes angiogenesis after peripheral ischemia in diabetic mice through a VEGF-dependent mechanism [J].Diabetes,2010,59(6):1496-1505.
[0] Lau TW,Sahota DS,Lau CH,et al.An in vivo investigation on the wound-healing effect of twomedicinal herbs using an animal model with footulcer[J].Eur Surg Res,2008,41(1):15-23.
[1] Kawai K,Suzuki S,Tabata Y,etal.Accelerated wound healing through the incorporation of basic fibroblastgrowth factor-impregnated gelatin microspheres into artificial dermis using a pressureinduced decubitus ulcermodel in genetically diabeticmice[J]. Br JPlast Surg,2005,58(8):1115-1123.
[2] Masaki I,Yonemitsu Y,Yamashita A,et al.Angiogenic gene therapy for experimental critical limb ischemia:acceleration of limb loss by overexpression of vascular endothelial growth factor 165 but notof fibroblastgrowth factor-2[J].Circ Res,2002,90(9):966-973.
Establishment and evaluation of a diabetic ratmodel of hindlimb ischemia
QIYi-xia,ZHANG Chao,CUIShi-jun,LUO Tao,GU Yong-quan,LI Jian-xin,ZHANG Jian,WANG Zhong-gao*
Department of Vascular Surgery,Xuanwu Hospital of Capital Medical University,Beijing 100053,China
ObjectiveTo establish a diabetic ratmodel of hindlimb ischemia,and provide a testmethod for diabetic limb ischemia and diabetic foot study.MethodsTwenty-fiveWistar ratswere divided into three groups:themodel group and control group(n=10),and sham operated group(n=5).The rats ofmodel group were induced by intraperitoneal injection of streptozotocin(STZ,60 mg/kg),with the blood glucose level over16.8mmol/L,while the rats of control group were injected with normal saline.All the rats had the left femoral artery and its branches ligated,and then Doppler scan blood flow analysiswas performed for the two hind limbs after operation at different time points.In themeantime,the changes of body weight and blood glucose were observed.The animals were sacrificed at 21days after operation.HE staining was used to observe the pathological changes ofgastrocnemius and femoral arteries.Capillary density and intima hyperplasia were examined using immunostaining for CD31 and a-SMA.ResultsBlood glucose of themodelgroup ratswas significantly increased as well as the quantity of urine and feces,and associated with weight loss,which were maintained for more than 21 days.The blood flow of control ratswasmarkedly decreased immediatly after operation,reached to the lowest point after surgery,and recovered from 7-14 days after operation.In contrast to the control group,the model group showed amarked reduction in blood flow in the ischemic hind limb.Pathological examination revealed remarkable vascular atrophy and a significantly reduced number of vessels per high power field in the gastrocnemiusmuscle ofmodel group rats with respect to the control group,and the femoral arteries ofmodel rats weremore narrowed than that of the control rats.ConclusionsIn this study,an effective,convenient diabetic ratmodel of hindlimb ischemia is successfully established which will facilitate the studies of drug intervention for diabetic limb ischemia and diabetic foot in the future.
Diabetesmellitus;Limb ischemia;Ratmodel
Q95-33
A
1005-4847(2015)06-0586-06
10.3969/j.issn.1005-4847.2015.06.008
2015-07-12
国家自然科学基金项目(编号:81470587)。
齐一侠(1979-),男,主治医师,硕士研究生,主要从事血管外科研究。Email:qiyixia@126.com
汪忠镐(1937-),男,主任医师,博士生导师,主要从事血管外科研究。Email:huakeqin@126.com

