iRhom2及其突变基因重组慢病毒的包装和稳定表达细胞系的建立
游颖,马雨楠,曾林,孙兆增
(军事医学科学院实验动物中心,北京 100071)
研究报告
iRhom2及其突变基因重组慢病毒的包装和稳定表达细胞系的建立
游颖,马雨楠,曾林*,孙兆增*
(军事医学科学院实验动物中心,北京 100071)
目的通过重组慢病毒感染,建立iRhom2及其突变基因的Vero细胞稳定细胞表达系,用于iRhom2的功能研究。方法将iRhom2及其突变基因克隆到慢病毒载体Lenti-OE-Flag,构建重组慢病毒载体Lenti-OE-iRhom2和Lenti-OE-iRhom2mut,将重组质粒瞬时转染HEK-293T包装细胞,获得重组慢病毒。将重组病毒感染Vero细胞,利用puromycin进行加压筛选,获得二者的重组表达细胞系。结果构建了iRhom2及其突变基因的逆转录病毒载体,并获得了重组逆转录病毒,并利用该病毒获得了二者的稳定表达细胞系。Western-blot实验证实,二者能够在Vero细胞内稳定表达。结论利用重组逆转录病毒感染,成功获得了iRhom2及其突变系的Vero细胞稳定表达株,为进一步研究iRhom2的生物学功能及其机制奠定了良好的基础。
iRhom2;慢病毒载体;包装细胞;稳定表达
UNCV无毛突变系小鼠是军事医学科学院实验动物中心培育的一种自发突变动物模型[1,2],遗传学研究表明该突变是单基因的常染色体半显性遗传。UNCV的纯合突变外观表现为无毛表型,杂合突变表现为稀毛表型。与常见的裸鼠不同,该动物模型的免疫系统基本正常。因此,在化妆品、皮肤药物和一些皮肤真菌的研究中具有特殊的应用[3]。
在前期的研究中,将UNCV无毛突变系小鼠的突变基因定位到11号染色体,并通过基因组扫描方式定位了突变基因 iRhom2[4-6](GeneID: 109602)。UNCV无毛突变系小鼠的iRhom2基因的N端309 bp的缺失,导致了无毛性状的产生。文献报道iRhom2可能通过TACE调节Notch1和Wnt信号通路,从而影响毛囊的分化[7,8]。课题组前期的工作也证实iRhom2能够影响TACE基因的成熟[9],但最近文献报道 iRhom2的基因敲除小鼠,反而具有被毛[10]。根据这些结果推测,iRhom2基因的N端309 bp的缺失,可能使突变蛋白具有了新的功能。本实验室已经克隆出小鼠iRhom2基因[11]。故课题组拟构建iRhom2基因及其突变基因的稳定表达细胞系,为iRhom2突变基因功能的比较研究奠定基础。
1 材料与方法
1.1 材料
慢病毒载体Lenti-OE(图1)购自北京普瑞金科技有限公司,iRhom2及其突变基因质粒由本室保存。感受态购自北京博迈德生物科技有限公司。慢病毒包装细胞293T,Vero细胞购自中国科学院上海细胞库。限制性内切酶Xba I、Bgl II购自NEB公司,T4 DNA连接酶购自 Takara公司。Lipofectamine 2000购自Invitrogen公司。无内毒素质粒提取试剂盒、胶回收试剂盒购自Biomiga公司。

图1 Lenti-OE载体示意图Fig.1 The diagram of Lenti-OE vector
1.2 方法
1.2.1 引物设计
根据iRhom2及其突变基因的全长基因序列,结合Lenti-OE载体的读框、多克隆位点,设计引物。Rhbdf2-F:GCTCTAGAGCCACCATGGCCTCAGCTGACAAGAATG;Rhbdf2-R:GCGCATAGATCTTTAGTGTAGCACCTGGTCTAG。
1.2.2 Rhbdf2慢病毒表达载体的构建
用Xba I和Bgl II双酶切iRhom2质粒。1.0%琼脂糖凝胶电泳回收iRhom2的DNA片段(野生型约2500 bp,突变型约2300 bp),将这些片段用T4 DNA连接酶连接到同样用Xba I和Bgl II酶切的Lenti-OE质粒,16℃过夜,将连接产物转化感受态细胞,涂氨苄平板,挑克隆,摇菌。
1.2.3 重组质粒的鉴定
基于模糊综合评价法的PPP项目绩效评价体系研究——以广西壮族自治区那考河流域治理项目为例梁素萍 李钦琳23-55
利用Xba I和Bgl II双酶切及PCR的方法鉴定重组质粒。PCR反应条件为94℃变性2 min,50℃退火30 s,68℃延伸3 min 30 s,循环5次;然后98℃变性10 s,60℃退火30 s,68℃延伸3.5 min,循环30次,最后68℃终止延伸10 min。
1.2.4 病毒包装
包装病毒前1 d,取7×105HEK-293T细胞种植于60 mm平皿。第2天,观察细胞密度约为60%~70%时,使用lipofectamine 2000转染试剂转染质粒(Lenti-OE control或 Lenti-OE-iRhom2、Lenti-OE-iRhom2mut质粒各1μg,加pMD2.0G和psPAX2质粒各1μg),第2天换用新鲜培养基2.5mL,继续培养3 d,收获细胞培养上清2 mL,分装,-80℃保存。
1.2.5 病毒感染
感染前1 d,胰蛋白酶消化Vero细胞,接种于细胞培养板上,置于37℃,5%CO2培养箱中培养。种植Vero细胞2×105于6孔板;过夜培养,细胞贴壁后移去旧培养基,换用含病毒培养基(1.5 mL培养基含polybrene 10μg/mL+病毒液200μL),混匀,加至细胞,感染过夜,第2天,移去含病毒培养基,换新鲜培养基,待48~72 h后,puromycin加药筛选。
1.2.6 稳定细胞系的建立
用puromycin筛选(预先摸索puromycin有效浓度,一般选用2~3 d可以杀死全部细胞的浓度为最优浓度,Vero细胞的puromycin有效浓度为3μg/mL)。细胞在6孔板内长满后,加药筛选,传代培养至10 cm平皿,继续加入puromycin,待长满后,传为2个10 cm平皿,长满后,冻存对照、wt、mut过表达的细胞各2支,留取部分细胞WB鉴定过表达效果。
2 结果
2.1 重组质粒鉴定
利用 PCR的方法,鉴定 Lenti-OE-iRhom2和Lenti-OE-iRhom2mut重组质粒,分别在特定区域出现条带(wt约2500 bp,Mut约2300 bp),见图2。
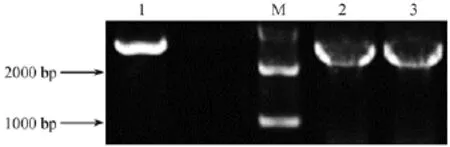
图2 菌液PCR鉴定阳性克隆结果Fig.2 Identification results of the bacterial liquid by PCR
2.2 重组慢病毒的包装结果
将Lenti-OE-irhom2转入293T包装细胞以后,在荧光显微镜下观察,发现视野内荧光强度达到80%左右,证实病毒包装成功。结果如图3所示。
2.3 病毒滴度测定时结果
病毒包装后,取加病毒原液的细胞,在荧光显微镜下观察结果,并数出最后两个有荧光的荧光细胞克隆数。假设为X和Y,则滴度(cfu/mL)=(X+Y ×10)×1000/2/X孔的病毒液的含量(μL)。其结果两种慢病毒Lenti-OE-Null、Lenti-OE-irhom2、Lenti-OE-irhom2mut的病毒滴度分别为4.8×106cfu/mL、1.3×106cfu/mL、1.3×106cfu/mL。见图4。
2.4 病毒感染Vero细胞的观察结果
病毒感染细胞经药物筛选后,在荧光显微镜下观察到GFP的表达(见图5)。
2.5 Flag-iRhom2蛋白表达的检测
Western blot结果显示,Lenti-OE-Flag-iRhom2编码蛋白质(大小约为49×103)在Vero细胞中有表达(图6)。
3 讨论
慢病毒载体是以HIV-1(人类免疫缺陷I型病毒)为基础发展起来的基因治疗载体,目前在基因治疗中研究较多。区别一般的逆转录病毒载体,它的优点在于能够感染多种难感染的细胞,对分裂细胞和非分裂细胞均具有感染能力。且慢病毒能够将外源基因插入细胞基因组内,实现目的基因的稳定表达。与此同时,慢病毒安全性很高,不产生任何有效的细胞免疫应答[12]。本实验所采用的慢病毒载体Lenti-OE,在宿主细胞内,能以病毒RNA为模板在自身反转录酶的作用下合成cDNA,再以此cDNA为模板合成双链DNA,经环化后通过病毒整合酶作用整合在宿主细胞的染色体上并长期表达。
病毒包装是一个病毒载体与包装细胞间的相互作用过程。因此,293T包装细胞的密度是一个重要的限制因素。充分利用培养基所构成的立体空间,在一定范围内可以大量地增加细胞数量,这样就提高了与外源DNA结合的机会,增加了进入细胞的质粒数量,获得更高的病毒滴度。重组慢病毒载体经包装细胞包装后,能用于基因转染的有效病毒滴度一般需达到 105~107cfu/mL[13]。在本实验中,HEK-293T产生的重组慢病毒Lenti-OE-Null、Lenti-OE-irhom2、Lenti-OE-irhom2的滴度分别为 4.8× 106、1.3×106、1.3×106cfu/mL。提示我们重组的慢病毒载体经NIH/3T 3细胞包装,能够获得有效的病毒滴度和较高的转效率,可用于后续iRhom2基因转染实验。Vero细胞是一种异倍体细胞,用途广泛。Vero细胞系是连续的非正倍体细胞,连续细胞系可以经过许多分裂周期而不衰老。在本研究中,采用的是病毒感染和加入puromycin的方法获得能够稳定表达iRhom2的Vero细胞,相对于脂质体转染,病毒感染效率更高,这种细胞系更利于获得可靠的实验结果。
实验将 irhom2基因克隆至慢病毒表达载体Lenti-OE,包装后筛选出一株感染性重组病毒产生细胞系,对其细胞及其上清感染的vero细胞基因组DNA进行irhom2基因PCR分析,flag标签的蛋白检测,结果表明外源基因已整合到转染细胞DNA中,证实了重组病毒的活性及其转导靶细胞的可行性,为进一步应用irhom2基因、阐明irhom2分子的功能奠定了基础。

图3 重组慢病毒包装结果Fig.3 The packaging results of the recombinant lentivirus

图4 病毒滴度测定时图Fig.4 Results of virus titration

图5 病毒感染Vero细胞后的观察结果Fig.5 Fluorescence images of the virus-infected Vero cells

图6 目的蛋白表达的鉴定Fig.6 Identification of the target protein expression
[1] 李善如,仇志华,王冬平.一种新的被毛突变小鼠及其生物学特性的初步研究 [J].军事医学科学院院刊,1995,19: 26-28.
[2] 李善如,王冬平,史燕燕,等.一种新的被毛突变小鼠遗传特性研究[J].中国兽医学报,1995,15:287-290.
[3] 刘冰.iRhom2突变导致小鼠毛囊分化障碍[D].军事医学科学院,2014.
[4] Jones JM,Elder JT,Simin K,et al.Insertionalmutation of the hairless locus on mouse chromosome 14[J].Mamm Genome, 1993,4(11):639-643.
[5] 李善如,王冬平,兰宏,等.一种新的小鼠被毛突变基因定位[J].科学通报,1999,44(7):750-755.
[6] 藤晓坤.导致小鼠无毛突变的关键基因的定位和克隆以及在小鼠毛发发育中作用的研究[D].上海交通大学,2008.
[7] Stern CD.Neural induction:old problem,new findings,yet more questions[J].Development,2005,132(9):2007-2021.
[8] Fuchs E.Scratching the surface of skin development[J].Nature,2007,445(130):834-842.
[9] Yang L,Liu B,Li Y,et al.iRhom2 mutation leads to aberrant hair follicle differentiation in mice[J].Plos ONE,2014,9(12):e115114.
[10] Siggs OM,Grieve A,Xu H,etal.Genetic interaction implicates iRhom2 in the regulation of EGF receptor signalling inmice[J]. Biol Open,2014,3(12):1151-1157.
[11] 徐嫄,刘冰,李文龙,等.小鼠 Uncv基因克隆及真核表达[J].中国实验动物学报,2012,20(1):81-83.
[12] 跃萍,宋丽萍,邱曙东,等.慢病毒载体在肿瘤基因治疗中的应用[J].现代肿瘤医学,2006,14(12):1615-1617.
[13] 张蕊,龚道清.慢病毒载体的研究进展及应用[J].中国畜牧兽医,2010,37(6):227-231.
Packaging of the recombinant lentivirus of iRhom2 and its mutant and establishment of a stable iRhom2-expressing cell line
YOU Ying,MA Yu-nan,ZENG Lin*,SUN Zhao-zeng*
(Laboratory Animal Center of the Academy of Military Medical Sciences,Beijing 100071,China)
ObjectiveTo establish a stable transfection cell line of iRhom2 and itsmutant through recombinant lentivirus infection.M ethodsThe full-length gene of iRhom2 and itsmutantwere cloned into the lentivirus vector Lenti-OE-Flag,and got recombinant lentiviral vector of Lenti-OE-iRhom2 and Lenti-OE-iRhom2mut.The constructed recombinant lentivirus vectorswere transfected into HEK-293T packaging cells to obtain the recombinant virus.Vero cellswere infected with recombinant virus.The stable expressing cell lines were obtained by pressure screening with puromycin.ResultsThe recombinant lentivirus vectorswere constructed and the recombinant viruswas obtained.The stable expressing cell lines were obtained using virus infection and the protein expression was testified with Western blotting.ConclusionsStable iRhom2-expressing Vero cell line and itsmutant are achieved by recombinant lentivirus infection.It paves the way for future study on biological functions and mechanism of iRhom2.
iRhom2;Lentivirus vetor;Packaging cell;Vero cell line
Q95-33
A
1005-4847(2015)06-0597-05
10.3969/j.issn.1005-4847.2015.06.010
2015-06-23
国家自然科学基金重点项目(31030058);国家科技支撑计划(2011BA115B03)。
游颖(1990-),女,硕士研究生,研究方向:实验动物学,E-mail:youying0723@163.com
曾林(1965-),男,研究员,博士生导师,研究方向:实验动物科学,E-mail:zenglin1965@126.com;孙兆增(1977-),男,副研究员,硕士生导师,研究方向:实验动物分子遗传学,Email:laxszz@aliyun.com

