武汉地区耐异烟肼结核分枝杆菌临床分离株katG基因突变的分子特征分析
马峻 陈高瞻 董洁莉 袁红梅 芦莲 朱才会 余晓丽
·短篇论著·
武汉地区耐异烟肼结核分枝杆菌临床分离株katG基因突变的分子特征分析
马峻 陈高瞻 董洁莉 袁红梅 芦莲 朱才会 余晓丽
结核病是由Mtb感染所致的慢性传染性疾病。近年来,随着MDR和XDR的不断产生,结核病以更严峻的形式威胁着人类的健康。异烟肼(isoniazid,INH)是一个不可或缺的抗结核一线药物。文献报道,异烟肼耐药主要与katG基因突变密切相关[1]。同时不同分型技术的研究结果显示全世界结核病的流行主要是由几种特殊的Mtb家族所引起[2],并且不同的基因家族具有独特的分子特征、地区性分布和致病性,其中北京基因型菌株具有更强的毒力、传播力,且与耐药性有关。因此,Mtb北京基因型菌株可能与耐药表型存在一定的联系,但不同区域的研究结果又有所不同。
笔者旨在探讨武汉地区Mtb临床分离株耐异烟肼katG基因突变特点,为进一步研究Mtb耐药机制及耐药结核病的快速检测提供依据;通过对武汉地区Mtb临床分离菌株的基因分型,初步分析北京基因型菌株在武汉地区的流行趋势,并探讨耐异烟肼katG315基因突变与北京基因型之间的相关性。
材料和方法
一、菌株来源
临床Mtb菌株于2012年6月至2013年6月分离自武汉市医疗救治中心3995例结核病患者痰标本,该组标本总阳性率32.0% (1278/3995),其中耐药菌株474株(37.1%,474/1278)。利用Excel软件中的RAND函数从474株耐药菌株中采用数字表法随机抽取64株;从804株敏感菌株中采用数字表法随机抽取21株,共计85株。分枝杆菌培养、菌种鉴定、绝对浓度法药物敏感性试验均按《结核病诊断实验室检验规程》[3]进行。H37Rv标准菌株 (ATCC27294)购自中国药品生物制品鉴定所。
二、方法
1. DNA制备:菌株接种在改良的罗氏培养基上,37 ℃培养2~3周至对数生长期,取出少量菌株,加入适量TE缓冲液,80 ℃灭活40 min。采用十六烷基三甲基溴化铵(CTAB)法提取分离菌株的DNA,Thermo NanoDrop 2000微量分光光度计(美国赛默飞世尔科技公司生产)测定DNA的浓度和纯度,并将浓度稀释至10 ng/μl,放置于-20 ℃保存待检。
2. PCR扩增:katG扩增引物用Primer Premier 5.0软件设计,上游引物序列P1:5′-TCGGCGATGAGCGTTACAG-3′(katG-F);下游引物序列P2: 5′-CGTCCTTGGCGGTGTATTG-3′(katG-R),产物长度为459 bp,包含katG315位点。PCR体系(50 μl):10×PCR Buffer(5 μl),10 mmol/L dNTP mix(4 μl),10 μmol/L上游引(1 μl),10 μmol/L下游引(1 μl),2.5 U/μl Taq酶(0.3 μl),10 ng/μl DNA(1 μl);PCR扩增条件:94 ℃预变性5 min,94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸1 min,30个循环,68 ℃延伸10 min。1%琼脂糖凝胶电泳检测PCR扩增产物。
3.DNA序列分析:将katG的PCR扩增产物经PCR纯化试剂盒纯化后,送生工生物工程股份有限公司进行测序。使用美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的局部序列比对基本检索工具(basic local alignment search tool, BLAST)(http://blast.ncbi.nlm.nih.gov/),将测序结果与Mtb标准株H37Rv相应基因进行序列比对,判断突变基因突变位点及形式。
4.分子分型:参考文献[4]的方法,基于缺失基因片段的多重PCR(DTM-PCR)方法鉴定北京基因型菌株。PCR产物经1%琼脂糖凝胶电泳检测,PCR反应扩增得到761 bp片段为北京基因型,扩增得到1466 bp片段则为非北京基因型。
5.统计学分析:实验结果采用SPSS 13.0统计软件,通过卡方检验对katG315基因突变与北京基因型相关性分析,P<0.05代表有显著相关性。
结 果
一、药敏结果
根据绝对浓度法药敏结果显示:85株Mtb临床分离株中,对异烟肼耐药者有64株,其中有5株为低耐药,59株高耐药;其余21株对异烟肼敏感。
二、katG核酸序列的突变结果
64株对异烟肼耐药的菌株中,65.6%(42/64)katG检测到突变。katG315位点突变最为普遍,突变率达到60.9%(39/64);其中S315T(AGC→ACC)是katG315最常见的突变类型,katG315位点还检测到了其他3种突变类型:S315T(AGC→ACA)、S315A(AGC→AAC)、S315G(AGC→GGC)。katG基因内还发现了3种新的突变位点:G273S、I266T和P232S。测序结果见表1。21株异烟肼敏感菌株中katG未检测到突变。
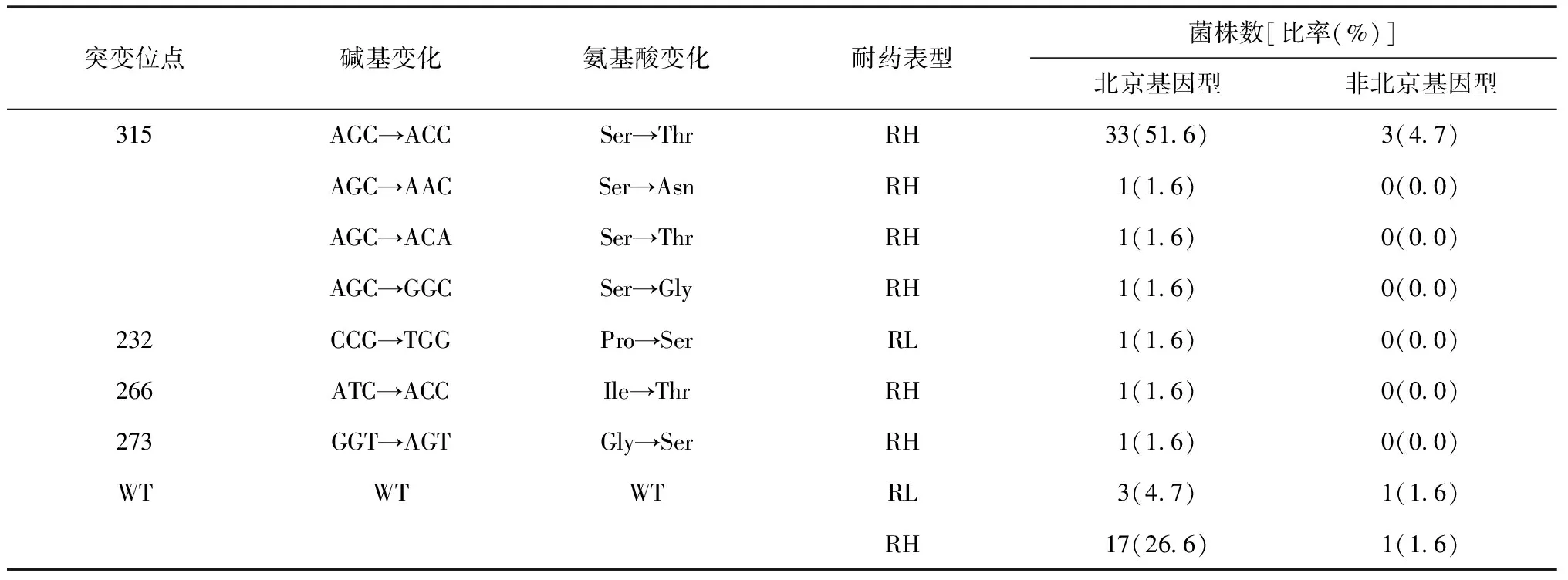
表1 耐异烟肼的64株Mtb分离株katG基因突变结果
注 WT:野生型;RH:异烟肼高浓度耐药(10 μg/ml);RL:异烟肼低浓度耐药(1 μg/ml)
三、RD105基因缺失法分型结果
85株Mtb菌株中有75株(88.2%)为北京基因型;10株(11.8%)为非北京基因型。耐异烟肼的菌株中北京基因型菌株占92.2%(59/64)。部分北京基因型和非北京基因型菌株扩增产物电泳条带见图1。
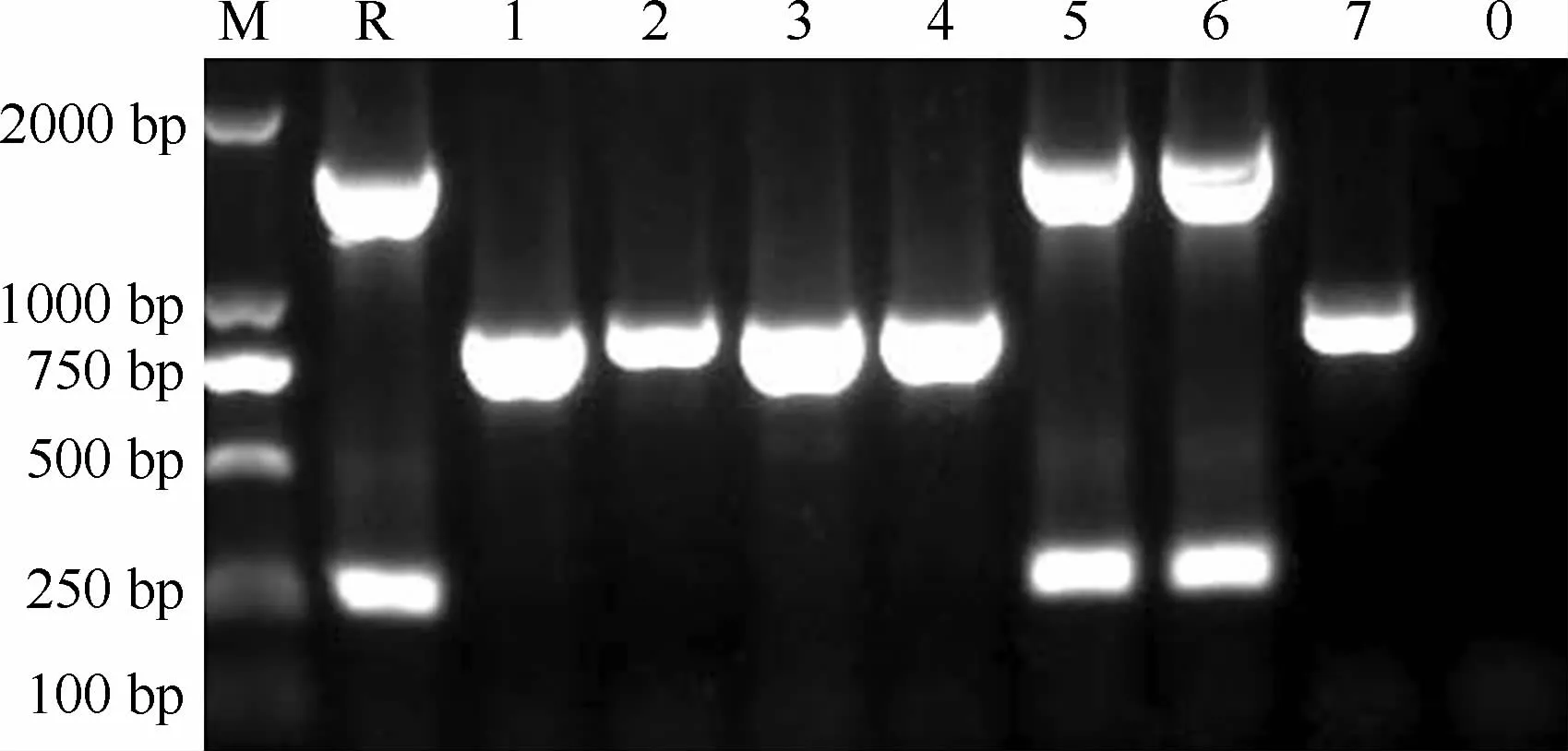
M:DNA Marker;R:标准株H37Rv;1~7:临床分离株编号;0:空白对照图1 RD105缺失基因检测PCR扩增产物电泳图
四、统计学分析结果
北京基因型、非北京基因型与katG315基因突变的相关性分析结果,显示两者差异无统计学意义(χ2=0.54,P>0.05),即没有显著相关性。
讨 论
异烟肼作为不可或缺的一线抗结核药物,其耐药机制也是所有抗菌药物中最为复杂的一个,至今尚未完全阐明清楚[5]。有研究报道其常见的突变位点为第315位密码子[6-7]。本研究中INH耐药分离株中katG突变率为65.6%(42/64),其主要的突变位点315突变率为60.9%(39/64),这与浙江地区(69.3%)和美国加利福利亚地区(68.7%)315突变位点突变率相当,但低于巴西(78.5%)和印度(82.95%)等国家的报道[8-11]。这表明katG315突变存在一定的地理差异。
本研究同时发现katG基因的3种新的突变位点:G273S(GGT→AGT)、I266T(ATC→ACC)和P232S(CCG→TGG),其中发生G273S和I266T点突变的菌株表型为异烟肼高耐药,但突变位点是否与异烟肼高耐药有关仍待进一步验证。耐异烟肼Mtb突变位点的研究将为进一步探讨耐药机制及耐药结核病的快速检测提供依据。
北京基因型菌株流行广泛,但在世界不同区域北京基因型菌株的比例差异较大。在中国不同地区北京基因型也有明显的地域性差异,如北京市92.6%[12],宁夏78.3%[13],内蒙古85.5%[14],吉林89.8%[12],陕西80.0%[12],新疆65.3%[12],福建54.5%[12],广西55.3%[15]。本研究利用RD105基因缺失检测法鉴定出分离株中北京基因型的比率为88.2%,北京基因型菌株为武汉地区Mtb的优势菌株。同时,Zhao等[16]报道福建、贵州、辽宁、上海、西藏5个省(直辖市、自治区)katG315与北京基因型没有显著相关性,和本研究结果一致。
综上,武汉地区流行的异烟肼耐药菌株中katG突变率为65.6%(42/64);本研究发现了3个新的突变位点,是否与异烟肼耐药有关需要进一步研究;katG主要突变位点315的突变率为60.9%(39/64),存在一定的地理差异,与北京基因型无显著相关性。
[1] Hoshide M, Qian L, Rodrigues C, et al. Geographical dif-ferences associated with single-nucleotide polymorphisms (SNPs) in nine gene targets among resistant clinical isolates of Mycobacterium tuberculosis. J Clin Microbiol, 2014, 52(5): 1322-1329.
[2] Hanekom M, Streicher EM, Van de Berg D, et al. Population structure of mixed Mycobacterium tuberculosis infection is strain genotype and culture medium dependent. PLoS One, 2013, 8(7): e70178.
[3] 中国防痨协会基础专业委员会. 结核病诊断实验室检验规程. 北京: 中国教育文化出版社,2006.
[4] Chen J, Tsolaki AG, Shen X, et al. Deletion-targeted multiplex PCR (DTM-PCR) for identification of Beijing/W genotypes of Mycobacterium tuberculosis. Tuberculosis(Edinb), 2007, 87(5): 446-449.
[5] Almeida Da Silva PE, Palomino JC. Molecular basis and me-chanisms of drug resistance in Mycobacterium tuberculosis: classical and new drugs. J Antimicrob Chemother, 2011, 66(7): 1417-1430.
[6] Zakerbostanabad S, Titov LP, Bahrmand AR. Frequency and molecular characterization of isoniazid resistance in katG region of MDR isolates from tuberculosis patients in southern endemic border of Iran. Infect Genet Evol,2008, 8(1): 15-19.
[7] Escalante P, McKean-Cowdin R, Ramaswamy SV, et al. Can mycobacterial katG genetic changes in isoniazid-resistant tuberculosis influence human disease features? Int J Tuberc Lung Dis, 2013, 17(5): 644-651.
[8] 戎奇吉, 吕火祥, 孙爱华. 基因芯片快速检测结核分枝杆菌katG基因突变及其与异烟肼耐药相关性. 中国人兽共患病学报, 2011, 27(3): 233-237.
[9] Perizzolo PF, Dalla Costa ER, Ribeiro AW, et al. Charac-teristics of multidrug-resistant Mycobacterium tuberculosis in southern Brazil. Tuberculosis(Edinb), 2012, 92(1): 56-59.
[10] Metcalfe JZ, Kim EY, Lin SY, et al. Determinants of multidrug-resistant tuberculosis clusters, California, USA, 2004—2007. Emerg Infect Dis, 2010, 16(9): 1403-1409.
[11] Gupta A, Prakash P, Singh SK, et al. Rapid genotypic detection of rpoB and katG gene mutations in Mycobacterium tuberculosis clinical isolates from Northern India as determined by MAS-PCR. J Clin Lab Anal, 2013, 27(1): 31-37.
[12] 赵秀芹, 董海燕, 刘志广, 等. 中国部分地区结核分枝杆菌北京基因型菌株分布初步分析. 实用预防医学, 2012, 19(5): 662-664.
[13] 王晓平, 逄宇, 赵晓, 等. 宁夏回族自治区结核分枝杆菌基因分型及与耐药性关系的研究. 中国防痨杂志, 2013, 35(9): 655-659.
[14] 余琴, 苏云开, 吕冰, 等. 内蒙古自治区结核分枝杆菌 Spoli-gotyping 分型及北京家族分析. 中国防痨杂志, 2013, 35(4):276-281.
[15] Dong H, Liu Z, Lv B, et al. Spoligotypes of Mycobacterium tuberculosis from different provinces of China. J Clin Microbiol, 2010, 48(11): 4102-4106.
[16] Zhao LL, Chen Y, Liu HC, et al. Molecular characterization of multidrug-resistant Mycobacterium tuberculosis isolates from China. Antimicrob Agents Chemother, 2014, 58(4): 1997-2005.
(本文编辑:薛爱华)
10.3969/j.issn.1000-6621.2015.01.018
武汉市卫生局临床医学科研项目(WX12C09)
430023 武汉市医疗救治中心检验科(马峻、董洁莉),病理科(袁红梅);武汉轻工大学生物与制药工程学院(陈高瞻、芦莲、朱才会、余晓丽)
2014-07-22)

