自发性高血压幼鼠淋巴微循环自律运动特征
盛有明 孟凡星 赵永刚 王 冰 李爱玲 李宏伟 修瑞娟
高血压作为一种危害严重的慢性非传染性疾病,发病率高居心血管疾病之首[1]。由微血管、微淋巴管及其相关体液共同构成的微循环体系是机体循环系统进行外周阻力与血压调控、代谢物及信息交换、组织灌注调节等活动最主要、最直接的功能执行单元[2,3],微循环功能紊乱在高血压发生、发展中的作用正受到越来越强烈的广泛关注[4,5]。
微淋巴管在体液回流、输出组织间隙中的大分子蛋白质和颗粒物质、调节组织间隙压、发挥免疫功能、吸收乳糜颗粒中发挥着主要作用[6,7]。微淋巴管具有“泵”与“导管”的二重性[8,9],特别是集合淋巴管的快速、大幅度自律运动是收集淋巴液、克服近心端阻力、推动淋巴液回流的主要动力来源[10]。持续主动地吸纳组织液,并以淋巴液形式输出,对于维持组织间隙的正常微环境至关重要[9]。而整个血管网络也处在这一微环境之中。这种动态平衡一旦被打破,即会引起病理反应,如水肿的发生[8],还可能影响到血管的调控功能。因此,在探讨高血压病理机制时,除了对血管自身开展研究外,亦有必要深入探索微淋巴管功能状态与高血压发生发展之间的潜在联系。本课题组前期研究[11]表明,8周龄和13周龄成年自发性高血压大鼠(SHR)肠系膜集合淋巴管自律运动的收缩分数和收缩活性指数与对照组相比表现出不同程度地下降,提示持续高血压可致淋巴微循环功能紊乱。本文报道自发性高血压初期(3周龄)幼鼠淋巴微循环自律运动特征,旨在阐明高血压不同发展阶段的微淋巴管自律运动变化对高血压发病机制的作用。
本文选择的有关定量评价自律运动特征的指标能够直观地表现病理、生理条件下淋巴微循环的功能状态[12-14]。基于高速数字图像处理的自动化识别跟踪测量技术是当前对微循环自律运动进行动态监测最准确有效的手段[15,16],因而实验数据的可重复性和可信度均高,可以为不同发展阶段SHR肠系膜集合淋巴管自律运动功能状态研究提供可靠的技术方法和理论依据。
1 材料与方法
1.1 实验动物及分组
SPF级雄性3周龄SHR(SHR组,n=11,平均压130.8±10.7mmHg)和对照 Wistar大鼠 (Wistar组,n=11,平均压111.2±13.3mmHg)购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2012-0001。两组大鼠血压差异有统计学意义(t=-3.56,P<0.05)。适应性饲养2天后进行实验,SHR组与Wistar组逐只交叉进行。
1.2 肠系膜集合淋巴管活体观察方法
腹腔注射3%戊巴比妥钠(3mg/100g)麻醉。左侧颈动脉插管并连接生理记录仪(MP-150,BⅠOPAC,美国)测量血压。按照 Xiu等[17]的方法手术暴露肠系膜集合淋巴管后置于装有摄像头(KY-100,JⅤC, 日 本)的 活 体 显 微 镜 (ACM,ZEⅠSS,德国)观察平台上,采用37.5℃±0.2℃恒温、pH 7.4±0.2的林格氏液持续灌流。静息30min后进行自律运动的观察。
1.3 自律运动视频录像、动态跟踪测量
选择持续自律运动的集合淋巴管区段进行连续录像。必要时追加麻醉。所录视频以XⅤⅠD编码器编码后保存为AⅤⅠ格式文件,供回放观察和测量分析。24位真彩色视频图像分辨率为720×576像素,RGB三通道,每通道256级灰度,PAL制式标准帧率25帧/s。使用基于改良的块匹配相关算法的ⅤasTrack技术[16]对视频中集合淋巴管目标位点的管径动态变化进行连续跟踪测量。处于自律运动状态的淋巴管管径变化表现为管径沿时间轴方向的类周期性波形图(图1)。各例随机选取其中15个连续完整的收缩/舒张循环(即一次自律运动)波形进行统计。依次计算单次自律运动过程的特征指标。
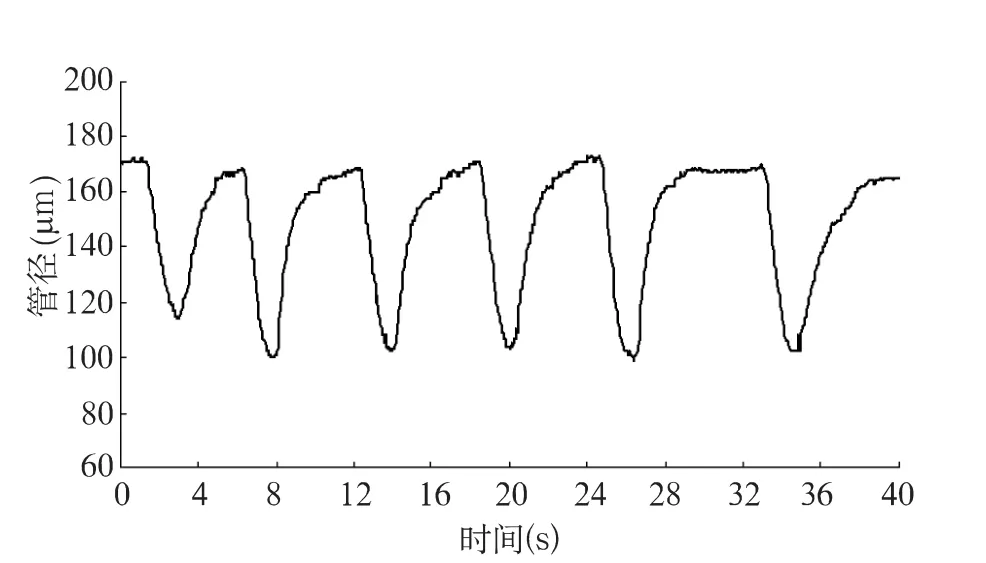
图1 包含6次收缩/舒张循环的自律运动跟踪测量结果局部波形示例图
1.4 自律运动特征参数计算方法
各项特征指标的计算参见图2及下述公式:(1)基本特征指标:相对振幅(RA= 收缩振幅/收缩前静息期管径)、收缩频率(Freq=每分钟所完成的收缩循环的次数);(2)运动力学特征指标:收缩振幅(As)、舒张振幅(AD)、收缩时长(Ts)、舒张时长(TD)、收缩速度(Ⅴs= As/Ts)、舒张速度(ⅤD= AD/TD)、收缩/舒张时长比(RS/D= Ts/TD);(3)收缩活性指标[12]:收缩分数[F=(收缩期起点管径的平方-波谷管径的平方)/收缩期起点管径的平方]、收缩活力指数(Ⅰnd=F×Freq)。
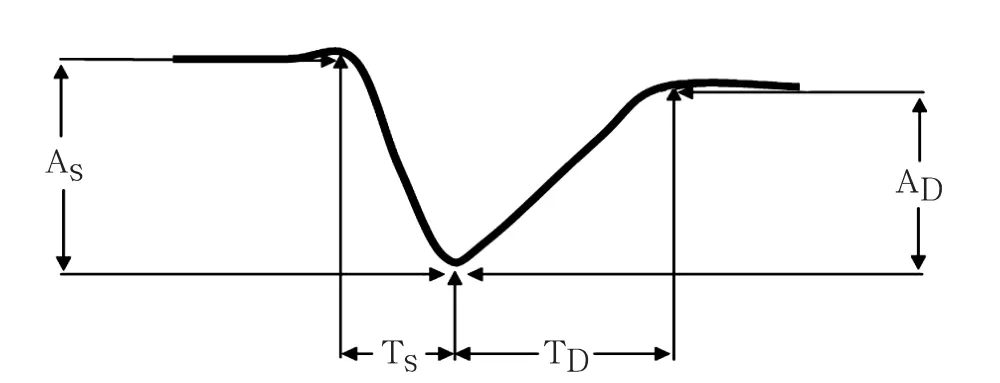
图2 集合淋巴管自律运动中单次收缩/舒张循环基本参数定义示意图
1.5 统计学处理
采用SPSS 17.0统计软件。计量数据以均数±标准差(±s)表示,所有数据呈正态分布且方差齐,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组自律运动基本特征比较
SHR组收缩频率较Wistar组有所上升(14.20±6.00次/min vs 10.80±3.70次/min),但差异无统计学意义(t=-1.61,P>0.05),见图3;两组相对振幅差异亦无统计学意义(39.60%±16.50%vs 43.10%±14.90%,t=0.54,P>0.05),见图4。

图3 SHR组与Wistar组自律运动频率

图4 SHR组与Wistar组自律运动相对振幅
2.2 两组自律运动力学特征比较
2.2.1 收缩振幅、舒张振幅:SHR组收缩振幅较Wistar组下降(38.40±15.00μm vs 48.60±19.30μm),舒张振幅也下降(37.70±14.90μm vs 47.60±19.10μm),但差异均无统计学意义(t值分别为1.42和1.38,P 均>0.05),见图5。

图5 SHR组与Wistar组自律运动收缩振幅、舒张振幅
2.2.2 收缩时长、舒张时长:SHR组和 Wistar组大鼠收缩时长(1.43±0.30vs 1.54±0.23)和舒张时长(2.33±0.90vs 2.64±0.84)差异均无统计学意义(t值分别为0.95和0.84,P 均>0.05),见图6。
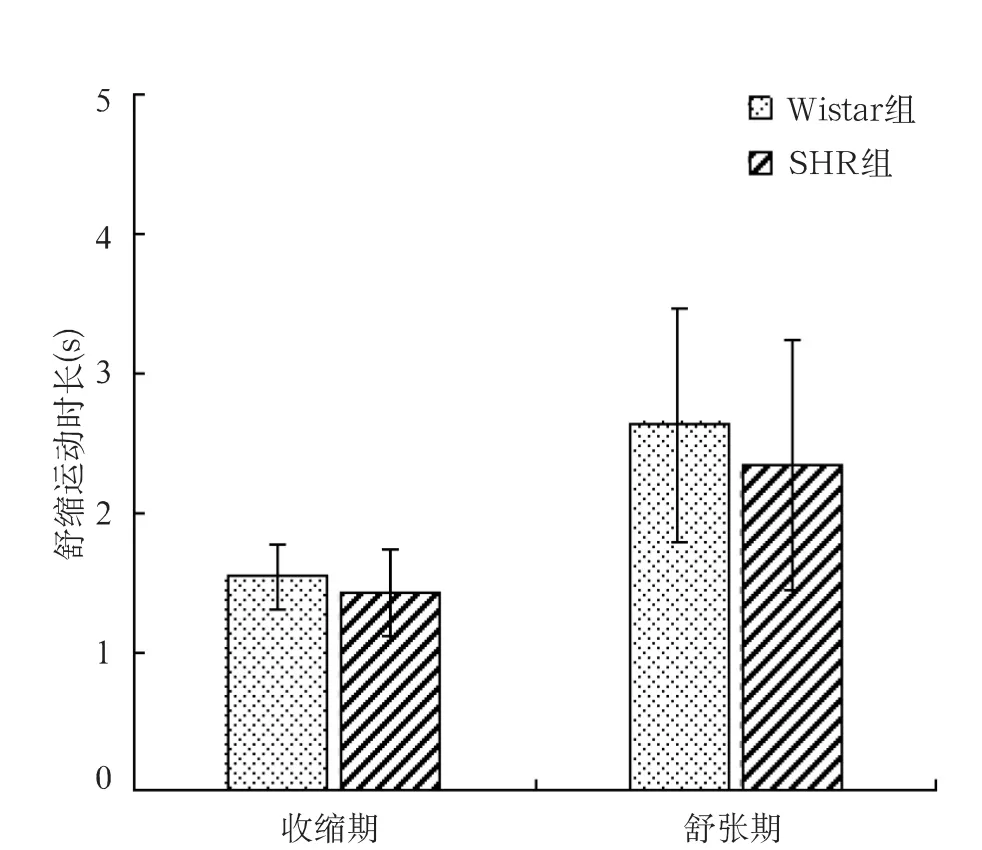
图6 SHR组与Wistar组自律运动收缩时长、舒张时长
2.2.3 收缩速度、舒张速度:SHR组的收缩速度较Wistar组有所下降,但差异无统计学意义(28.10±12.00μm/s vs 32.60±13.50μm/s,t=0.84,P>0.05),舒张速度也有下降,差异亦无统计学意义(18.70±9.60μm/s vs 20.40±9.70μm/s,t=0.67,P>0.05),见图7。

图7 SHR组与Wistar组自律运动收缩速度、舒张速度
2.2.4 收缩/舒张时长比:SHR组收缩/舒张时长比与Wistar组差异无统计学意义(0.71±0.23vs 0.67±0.18,t=-0.44,P>0.05),见图8。
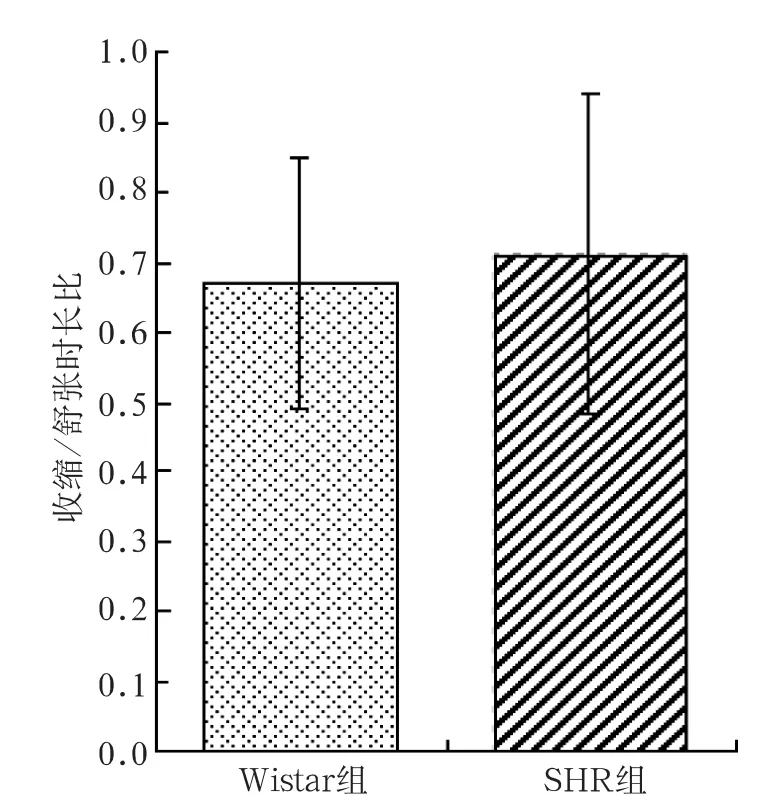
图8 SHR组与Wistar组自律运动收缩/舒张时长比
2.3 两组自律运动收缩活性比较
SHR组收缩分数与Wistar差异无统计学意义(0.61±0.20vs 0.66±0.18,t=0.58,P>0.05),见图9。SHR收缩活力指数虽较 Wistar组有所上升(8.62±4.27vs 6.93±2.64),但差异无统计学意义(t=-1.13,P>0.05),见图10。

图9 SHR组与Wistar组自律运动收缩分数

图10 SHR组与Wistar组自律运动收缩活力指数
3 讨 论
淋巴系统涉及脂类吸收与修饰、免疫、组织液回流、内环境稳定等诸多方面[18],其主要依托载体是淋巴液,处于淋巴管网络体系外周的微淋巴管自律运动是主动泵取淋巴液并克服近心端阻力,推动淋巴液回流的主要动力来源[10]。微循环研究者于上世纪中后期已经在微淋巴管的微观结构、功能和自律运动机制上取得了丰硕成果[19-21]。针对不同慢性病病理模型的微淋巴管自律运动变化及其潜在触发机制研究成为当前研究的热点[22,23]。Zawieja等[24]对代谢综合征大鼠模型的肠系膜集合淋巴管自律运动模式的研究结果表明,使用高果糖饮食诱导7周后,SD大鼠肠系膜集合淋巴管发生了重塑,Ca2+敏感性和淋巴管收缩功能下降,淋巴液输出减少约50%。提示特定病理状态下,集合淋巴管可能发生自律运动紊乱,并对体液循环有严重损害。但由于代谢综合征模型是多种病理因素的“超级混合体”,不仅包括血压升高,还包括血脂异常(甘油三酯升高和高密度脂蛋白胆固醇下降)、血糖升高和肥胖[25],因而,无法了解其中单个因素(如血压升高)与淋巴微循环功能紊乱之间的确切关系。为排除混杂因素的干扰,本研究选择医学界普遍认可的SHR进行集合淋巴管自律运动特征研究,单独观察血压升高与微淋巴管自律运动模式的内在联系。
集合淋巴管在大鼠肠系膜上的存在方式多种多样。大量脂肪组织和微血管不同程度与集合淋巴管的贴近或叠压,可能对目标区段的管壁运动造成难以预料的物理限制。同时,一些比较弯曲的区段,以及紧邻该区段上端、下端的汇合或分叉结构,都可能产生不同程度的湍流。而且,微淋巴管管腔内液体流态的任何微小变化都会直接引起剪切应力的改变,进而被微淋巴管敏锐地感知,并作出调节(即“Flow-mediated Autoregulation”)[26]。所 以,为 了尽可能保证各组待测目标管段所处基本物理条件的一致性,减少结果误差,本研究所选取的淋巴管目标区段均较平直,上端无汇合,下端无分叉,具有瓣膜,脂肪组织堆块和伴行的微血管均不直接紧贴管壁,无微血管跨压,且处于连续自律运动中。测量位点均统一限定在瓣膜下游附近淋巴管直径最大处。凡不满足以上任一要求的淋巴管段均予排除,以降低误导性结果出现的几率。
检测结果显示,SHR组集合淋巴管自律运动各项特征指标与Wistar组相比变化较大者包括收缩频率(增加31.50%)、收缩速度(降低13.80%)、收缩振幅(减小21.00%)、舒张振幅(减小20.80%)、收缩活力指数(上升24.40%),其余指标变化均在±10%以内。上述指标的组间差异虽无统计学意义(P>0.05),但SHR组的微小变化对分析微淋巴管自律运动还是有积极的提示作用。运动力学特征指标如收缩速度、收缩振幅、舒张振幅的下降可以反映SHR微淋巴管的收缩力已经出现了一定程度的减弱;收缩频率增加则可以理解为SHR经此方式代偿,由于收缩力减弱所导致的输出能力的下降。收缩活性指标中微淋巴管收缩分数的定义本质上类似于心脏的射血分数,用于近似估计每次收缩循环的淋巴液搏出量。本实验中两组收缩分数基本相同,但是单位时间内总搏出量(即收缩活力指数)在SHR组有所升高,收缩频率的代偿性增加可能是其原因之一。因为淋巴液高效的逆压力梯度搏出不仅依靠管壁的强烈收缩,同时还高度依赖瓣膜的协同开闭[18,27],所以瓣膜开闭运动与管壁舒缩运动的协调性直接决定淋巴液净输出量。
3周龄SHR处在高血压发展的初期阶段,其淋巴微循环只表现出些许变化,尚未出现功能障碍,应在可调控范围。体外研究表明,多种血管活性因子,如一氧化氮供体、前列腺素类、血栓素等,不仅对血管具有调节作用,亦能作用于微淋巴管上的同型受体,对淋巴管的自律收缩运动具有强烈的调节作用[6,28,29]。我们将进一步在体研究血管活性因子对微淋巴管自律运动的调节作用,并系统阐明高血压持续发展过程中淋巴微循环自律运动模式的转换,为探索淋巴微循环与高血压发展机制提供更全面的实验依据。

