乳脂肪球表皮生长因子Ⅷ在冠心病中的作用
周方元综述 李 艳审校
乳脂肪球表皮生长因子Ⅷ(Milk Fat Globule-epidermal Growth Factor-like-facter ⅤⅠⅠⅠ,MFG-E8),又称乳凝集素或p47、SED1等,是由John等[1]于1990年首先克隆的一种小鼠乳腺上皮细胞蛋白。MFG-E8作为体内病理生理反应的调节剂,参与炎症、免疫、细胞凋亡、增殖及肿瘤发生发展等多种过程,尤其对炎症反应有着重要的拮抗作用。冠心病(Coronary Heart Disease,CHD)是一种慢性炎症性疾病,炎症反应和细胞凋亡可增加其动脉粥样硬化(Atherosclerosis,AS)斑块形成速度和不稳定性[2,3]。MFG-E8在 CHD中的作用及其机制受到基础和临床研究的广泛重视,相关报道较多,本文简要综述如下。
1 MFG-E8的生物学特征
1.1 MFG-E8的结构特点
MFG-E8N末端含有一个可以引导其跨膜转移的信号肽序列,其后为两个类表皮生长因子(Epidermal Growth Factor,EGF)结构域,第二个类EGF结构域含有一个高度保守的精氨酸-精氨酸-天冬氨酸(RGD)基序,用以识别吞噬细胞膜上的整合素αvβ3和αvβ5;其C末端含有两个与凝血因子Ⅴ/Ⅷ同源性达70%的C样结构域,可以结合磷脂酰丝氨酸(Phosphatidylserine,PS)位点来绑定凋亡细胞,以此介导吞噬细胞清除凋亡细胞,控制各种炎症性疾病的进展[4]。此外,MFG-E8有长型(66KDa)及短型(53KDa)两种亚型,两者的主要差别在于长型的第二个类EGF结构域与第一个C样结构域之间插入了一段富含脯氨酸/苏氨酸(P/T)的重复序列(图1)。在人体及大多数动物体内主要是短型,大鼠及小鼠虽然两者皆有,但其长型具有组织和时间特异性,主要在孕期和哺乳晚期表达[5]。
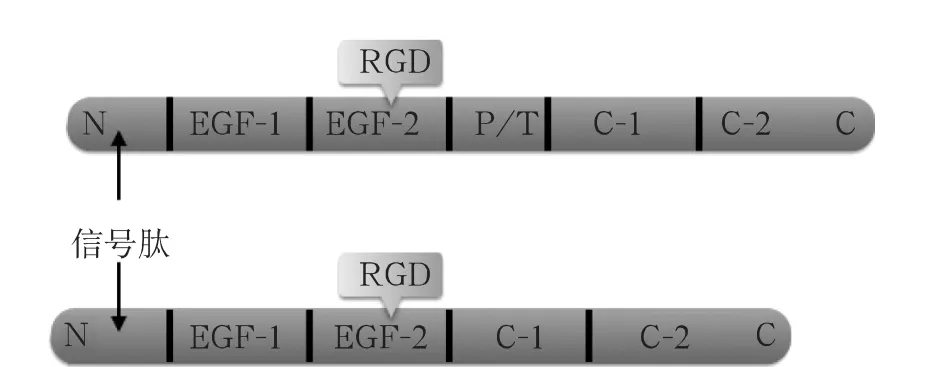
图1 MFG-E8基本结构以及长型(上)和短型(下)差别示意图
1.2 MFG-E8的表达特性
MFG-E8最初在乳脂肪球表面被发现,但在随后近10年的研究中发现,MFG-E8可在不同组织和细胞中广泛表达。Ait-Qufella等[6]研究表明,去除骨髓源性 MFG-E8小鼠,其白介素-10(ⅠL-10)的合成减少而干扰素合成增多,进而导致凋亡物质大量积累,使AS进程加快。较多研究证实MFG-E8在内皮细胞、巨噬细胞、血管平滑肌细胞等与CHD有关的细胞中都广泛表达[7-9],进一步提示其参与AS形成的全过程。MFG-E8在胚胎成纤维细胞系NⅠH/3T3、单核细胞巨噬细胞J774A.1等细胞系中不表达。
在不同病理状态下,MFG-E8具有表达差异。例如在皮肤压疮缺血再灌注损伤时,MFG-E8首先于缺血期在真皮层高表达,而在再灌注后表达量显著下降[10]。机体发生肿瘤时,肿瘤细胞中 MFG-E8持续高表达[11]。在不同炎症分期阶段,MFG-E8表达水平也有差异。急性炎症初期MFG-E8表达上调,而在慢性炎症或急性炎症加重后MFG-E8表达则下调[12],这可能与体内炎症对巨噬细胞的影响及自身的病理生理改变有关。AS晚期患者 MFG-E8表达水平较正常人群明显下降[13],而AS早期 MFG-E8的表达水平还未见报道,这可能与AS早期的炎症状态难以衡量,且斑块处于初级形成阶段,MFG-E8表达水平存在较大差异有关。
2 MFG-E8诊断CHD的初步探讨
目前,CHD的明确诊断主要依靠冠状动脉造影,对其早期诊断仍然缺乏有效方法和指标。有研究利用ELⅠSA检测发现CHD患者血清MFG-E8水平较健康人群显著降低,且急性心肌梗死(Acute Myocardial Ⅰnfarction,AMⅠ)患者更低于稳定性心绞痛者[13];动物实验也表明,合并心血管疾病的2型糖尿病(Type 2Diabetes Mellitus,T2DM)小鼠血清MFG-E8水平低于未合并心血管疾病小鼠[14],提示低水平血清MFG-E8可能增加心血管疾病,包括CHD的风险,因而早期检测该指标或可用于诊断CHD,以及评估CHD的严重程度。
3 MFG-E8在CHD中的主要作用
3.1 促进组织碎片清除
MFG-E8促进组织碎片清除的作用主要包括以下两方面:一是MFG-E8作为桥梁分子介导巨噬细胞吞噬凋亡细胞。凋亡细胞最主要的特征之一是PS位点外翻,传达一种所谓“吃我”信号,吸引 MFG-E8C末端的第二个C样结构域与其结合,而N末端的RGD基序则连接巨噬细胞表面的整合素αvβ3和αvβ5,改变整合素构象,激活CrkⅠⅠ-DOCK180-Rac1通路,活化Rac1蛋白,引起巨噬细胞骨架重组而转化为可以吞噬凋亡细胞的形态[7,15];同时 MFG-E8分子的第一个C样结构域还可以介导其自身与胶原蛋白结合形成复合物,使巨噬细胞可以直接吞噬该复合物[16],该功能不涉及RGD基序及整合素,MFG-E8也未介导凋亡细胞的清除,但确实减轻了胶原蛋白的积累,其具体机制尚待进一步探讨。组织碎片的积累是AS形成的主要因素,MFG-E8可以通过加速清除凋亡内皮细胞、胶原蛋白、微泡等,发挥预防或干预AS的效应。
3.2 抗炎
MFG-E8具有间接和直接抗炎作用。间接作用表现为MFG-E8在促进凋亡细胞被吞噬时,触发机体的免疫耐受,不但减少促炎因子,包括肿瘤坏死因子-α(TNF-α)、白介素-6(ⅠL-6)等的产生,同时增加抗炎细胞因子ⅠL-10的合成。此调节过程是由过氧化物酶体增生物激活受体D型(PPARD)介导,而且介导过程还可以反过来刺激 MFG-E8的表达,使之形成良性循环[17];另有细胞实验证实,重组人 MFG-E8预处理的巨噬细胞与凋亡细胞共培养,能显著降低由脂多糖(LPS)诱导的细胞内丝裂原活化蛋白激酶(MAPK)、p38MAPK、细胞外信号调节激酶1/2(ERK1/2)的磷酸化及活化,从而减少促炎因子的释放[18]。表明 MFG-E8可间接抗炎。
MFG-E8的直接抗炎作用可以不依赖于凋亡细胞的清除,而是通过与能诱发炎性因子竞争性结合整合素αvβ3来完成。例如晚期炎性介质高迁移率族蛋白B1(HMGB1)在缺血性心脏病中不仅介导心脏损伤,且引起巨噬细胞功能受损;MFG-E8可竞争性结合 HMGB1受体αvβ3使其失效,从而改善炎症状态并恢复巨噬细胞功能[19]。MFG-E8拮抗炎症反应的作用为慢性炎症性疾病CHD以及其它炎症性疾病的治疗提供了新方向。
3.3 促进血管再生
MFG-E8具有维持血管完整性的作用。血管内皮损伤被认为是CHD的始动因素,预防和修复血管内皮,对防治CHD具有重要意义。血管内皮生长因子(ⅤEGF)是促进血管新生的主要因子,动物实验表明,MFG-E8可能参与ⅤEGF受体介导的蛋白激酶B(PKB)磷酸化过程而促进内皮细胞生长,而MFG-E8缺陷小鼠的PKB未能有效活化,从而缺失相应作用[20]。因此,MFG-E8对于血管壁损伤的修复具有重要作用。
3.4 对血管平滑肌细胞的作用
研究发现,增殖型血管平滑肌细胞大量合成MFG-E8,静止型血管平滑肌细胞的MFG-E8基因被抑制而不表达MFG-E8。血管平滑肌细胞在AS斑块形成过程中转化为增殖合成表型后,大量分泌多种血管活性物质、生长因子等,使自身增殖、迁移、侵袭,从而加速AS斑块的形成,而且血管平滑肌细胞自身的凋亡也能促进AS的发展[21]。MFG-E8在AS过程中表现出两面性,一方面可以通过其清除能力,加速凋亡平滑肌细胞的清除,减缓或遏制AS进程;另一方面,MFG-E8可能介导血管紧张素Ⅱ(AngⅡ)和单核细胞趋化蛋白-1(MCP-1)通路,增强平滑肌细胞的侵袭能力,使之在血管壁堆积,导致血管壁增厚[22]。
4 小结与展望
MFG-E8作为一种混合型分泌蛋白,在人体组织内广泛表达,且在CHD发生发展的不同阶段发挥着重要作用。其可在体外检测,方法便捷、微创,耗时短,MFG-E8水平降低对CHD诊断和预后评估具有一定的潜在价值。同时,MFG-E8的多种功能,如延缓AS斑块形成,促进血管内皮再生等,预示其对CHD有潜在治疗作用。但目前对MFGE8的研究还存在不足,例如缺乏多中心大样本的血清学水平论证,缺乏检测方法和结果的金标准,难以进行标准化分析。随着研究的深入展开,MFG-E8的实验室监测和临床应用前景定能得到进一步拓展。

