全血γ-干扰素释放试验对结核病与恶性肿瘤患者检测结果的比较研究
黄毅 党丽云 郭琪 张耀辉 谢琨 王龙智
·论著·
全血γ-干扰素释放试验对结核病与恶性肿瘤患者检测结果的比较研究
黄毅 党丽云 郭琪 张耀辉 谢琨 王龙智
目的 对结核病、恶性肿瘤患者的全血γ-干扰素释放试验检测结果进行比较,分析其临床意义。方法 搜集2014年3月至2014年12月就诊于西安市结核病胸部肿瘤医院的结核病、肺炎、恶性肿瘤164例患者,以及同期来我院进行健康体检的人员50名。其中结核病组患者51例,恶性肿瘤组72例,肺炎组41例,健康对照组50例。所有研究对象均采用海口维瑅瑷生物研究院结核分枝杆菌特异性细胞免疫反应检测试剂盒。所有数据处理采用SPSS 13.0统计学软件进行分析;计数资料采用χ2检验,P<0.05为差异有统计学意义。结果 各组全血γ-干扰素释放试验的检测阳性率分别为结核病组98.0%(50/51)、恶性肿瘤组50.0%(36/72)、肺炎组29.3%(12/41)、健康对照组8.0%(4/50)。与健康对照组相比,结核病组、恶性肿瘤组和肺炎组患者的全血γ-干扰素释放试验检测阳性率均较高,差异有统计学意义(χ2值分别为82.26、23.62、7.03,P值均<0.05)。各类恶性肿瘤患者之间全血γ-干扰素释放试验检测的阳性率均相似,分别为:肺腺癌组54.8%(17/31);肺鳞癌组38.9%(7/18);小细胞肺癌组40.0%(4/10);其他恶性肿瘤组61.5%(8/13),差异无统计学意义(χ2=2.27,P>0.05)。结论 海口维瑅瑷全血γ-干扰素释放试验试剂盒对结核病诊断的敏感度很高,但特异度较低;在恶性肿瘤患者中的检测阳性率也较高,其原因有待进一步研究。
结核/诊断; 癌; 干扰素γ释放试验; 酶联免疫吸附测定
γ-干扰素释放试验(interferon gamma release assays,IGRAs)是近年来发展起来的用于检测结核感染的一种新方法,根据检测方法和原理不同分为2种:一种是IGRAs检测以酶联免疫吸附试验(ELISA)检测平台为主,即通过 ELISA 试验定量检测全血中γ-干扰素的释放水平(简称“全血γ-干扰素释放试验”或“IGRA-ELISA技术”);另外一种是通过酶联免疫斑点法(ELISPOT)对体外特异性免疫应答的T淋巴细胞进行计数来定量分析[简称“结核感染T细胞酶联免疫斑点试验(T-SPOT.TB)”]。目前,IGRAs技术已经被作为一种诊断结核病的工具应用于临床。国内外文献报道IGRAs对于诊断结核病,尤其是诊断潜伏性结核感染具有很高的敏感度和特异度[1]。我国是结核病高发国家,是世界上结核病22个高负担国之一,占全球总负担的15%[2];但是目前也有文献报道,在我国这种结核高感染率的背景下,应用T-SPOT.TB技术检测肺癌患者,其部分患者的检测结果呈阳性表现[3]。本研究通过分析IGRA-ELISA技术在结核病组、恶性肿瘤组、肺炎组和健康对照组中的阳性率比较,旨在为减少临床工作中的误诊,为患者的诊断提供一定的帮助,现将具体研究结果报道如下。
对象和方法
一、研究对象
搜集2014年3月至2014年12月就诊于西安市结核病胸部肿瘤医院的结核病、肺炎、恶性肿瘤164例患者,以及同期来我院进行健康体检的人员50名。所有研究对象均采用IGRA-ELISA技术进行检测。其中,结核病组患者51例,恶性肿瘤组患者72例,肺炎组患者41例,健康对照组受检者50名。所有受试者年龄均>18岁,且排除合并免疫性疾病。
结核病组和恶性肿瘤组所有受调查对象均进行血液结核抗体检验、浓缩集菌抗酸菌检测、痰结核分枝杆菌培养、痰结核分枝杆菌核酸检测。
结核病组:所有的患者都为经病理确诊或细菌学确诊的初治结核病患者,且在进行IGRA-ELISA技术检测前均未开始抗结核治疗。患者中位年龄为41岁。
恶性肿瘤组:所有的肿瘤患者均为初次诊断、病理确诊,且结核感染相关检测(PPD、结核抗体、PCR、RNA、浓缩集菌抗酸菌检测、痰培养)均为阴性,患者中位年龄为52岁。其中,肺腺癌31例,肺鳞癌18例,小细胞肺癌10例,其他恶性肿瘤(包括淋巴瘤、小细胞肝癌、肾癌等)13例。
肺炎组:所有患者均为不支持肺结核和肺部肿瘤的肺炎患者,患者中位年龄38岁。
健康对照组:电脑数字表法随机抽取2014年3—12月在我院体检人群,排除不合格者及影像学、实验室检查或临床表现提示有活动性病变者,中位年龄为44岁。
所有受调查对象均签署知情同意书,并获得西安市结核病胸部肿瘤医院伦理委员会批准。
二、研究方法
所有参与调查分析的对象均采用IGRA-ELISA技术进行检测,并对不同组别的检测阳性率进行分析比较。所用试剂为海口维瑅瑷生物研究院出品的结核分枝杆菌特异性细胞免疫反应检测试剂盒(酶联免疫法)。
具体试验方法:分为全血刺激和γ-干扰素检测2个步骤。无菌采集全血(肝素钠或肝素锂抗凝),且每份标本的总血量不少于3 ml。于2 h内分装于N(表示阴性对照管)、P(表示阳性对照管)和T(表示检测管)3个反应管内,分别加入阴性刺激剂、阳性刺激剂和含特异性蛋白抗原[培养滤液蛋白10(CFP-10)和早期分泌靶抗原6(ESAT-6)]的刺激剂,迅速颠倒混匀,37 ℃水浴24 h。培养后的培养管以1980×g离心5 min,取离心上清液进行ELISA检测,在450 nm处测定其吸光度值(A值);依据试剂盒中校准品所作标准曲线及标准曲线方程,依据各反应管内的A值得出γ-干扰素的浓度值(IU/ml)。
结果判读:当N<0.5 IU/ml时,(T-N)/(P-N)≥0.6时判为阳性,否则为阴性;当N≥0.5 IU/ml时,(T-N)/(P-N)≥0.85时判为阳性,否则为阴性;且当P-N≥10 IU/ml时,按P-N=10 IU/ml计算。
三、统计学分析方法
计数资料采用χ2检验,P<0.05为差异有统计学意义。统计结果由SPSS 13.0统计软件进行分析。
结 果
一、 IGRA-ELISA技术检测结果
结核病组、恶性肿瘤组、肺炎组、健康对照组的IGRA-ELISA技术检测结果阳性率分别为98.0%(50/51)、50.0%(36/72)、29.3%(12/41)、8.0%(4/50)。各患者组和健康对照组阳性率相比较差异均有统计学意义;恶性肿瘤组与肺炎组的阳性率比较,差异也有统计学意义。IGRA-ELISA技术在本研究中诊断结核病的敏感度和特异度分别为98.0%(50/51)、68.1%(111/163)(表1)。
二、不同恶性肿瘤患者进行IGRA-ELISA技术检测的结果比较
在不同肿瘤组别之间,IGRA-ELISA技术检测的阳性率差异无统计学意义(表2)。
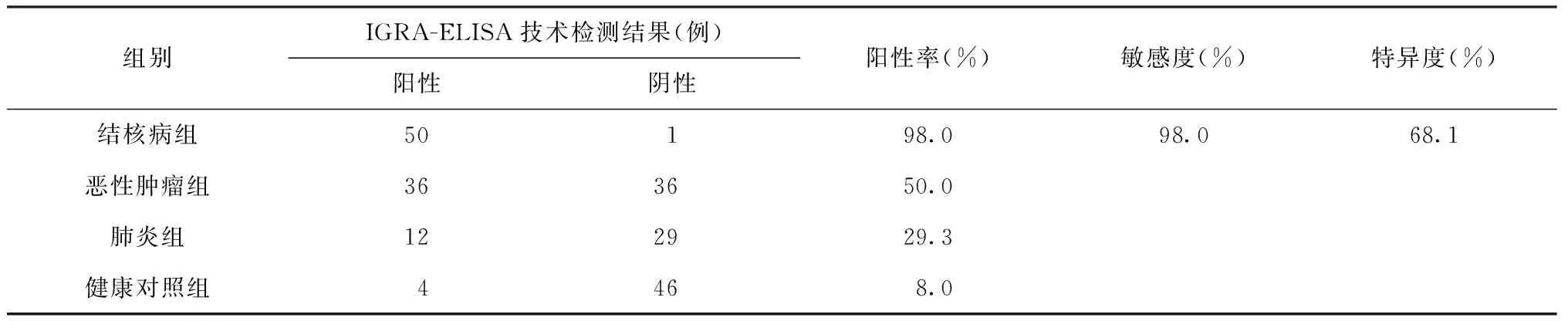
表1 不同组别IGRA-ELISA技术检测结果的比较
注 结核病组与健康对照组比较,χ2=82.26,P=0.001;恶性肿瘤组与健康对照组比较,χ2=23.62,P=0.001;肺炎组与健康对照组比较,χ2=7.03,P=0.008;恶性肿瘤组与肺炎组比较,χ2=4.59,P=0.032;计算特异度时将结核病外的其他组检测阳性视为假阳性(对于可能存在的潜伏结核感染已进行结核感染相关检测均为阴性,在此忽略不计)
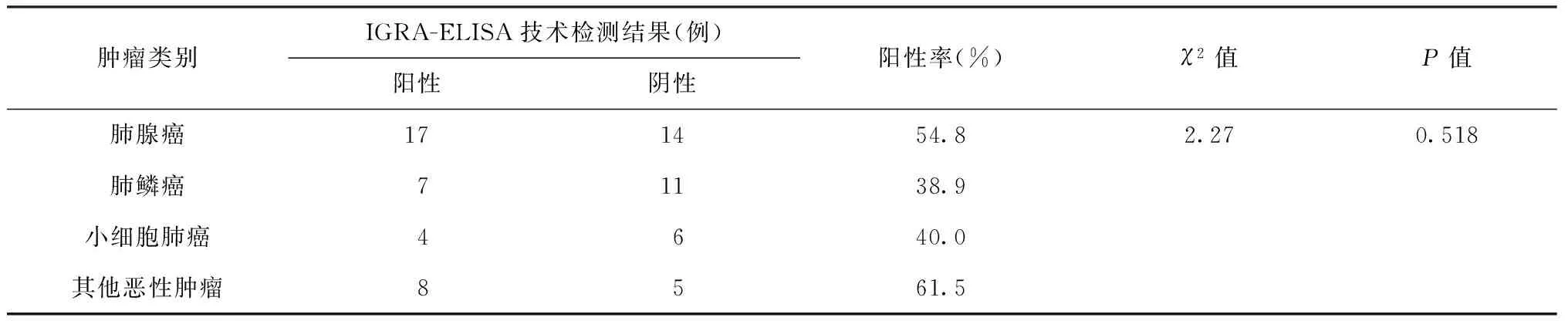
表2 不同类别恶性肿瘤患者IGRA-ELISA技术检测结果比较
讨 论
一、IGRAs诊断原理
目前,IGRAs被认为是结核分枝杆菌感染的诊断技术。这项技术的原理是机体感染结核分枝杆菌后,血液中的记忆性T淋巴细胞和单核细胞会再次接触结核分枝杆菌特异性抗原时产生和分泌相应的细胞因子(即γ-干扰素)。所以,该实验技术选取了存在于结核分枝杆菌但在卡介苗和大多数非结核分枝杆菌中普遍缺少的RD1区编码的ESAT-6和CFP-10蛋白作为刺激抗原,刺激受检者外周血中的T淋巴细胞,通过定量检测γ-干扰素含量或计数分泌γ-干扰素的T淋巴细胞数量来判断是否存在结核分枝杆菌特异性活化的效应T细胞,从而判断是否存在结核分枝杆菌感染[5-8]。
二、IGRAs检测技术的敏感度和特异度
结合IGRAs技术原理及目前文献报道、临床分析等,IGRAs对于结核病的诊断具有较高敏感度和特异度。国外文献报道显示,在活动性肺结核患者中IGRA-ELISA技术的整体敏感度为81%,特异度为95%[9]。本研究的结果显示,IGRA-ELISA技术对于诊断结核病的敏感度和特异度分别为98.0%和68.1%,其敏感度高于国外文献报道,而特异度偏低,其原因可能在于:(1)与本实验所采用的试剂盒所设定的临界值(cut-off值)偏低有关。(2)与本研究计算特异度时将结核病组之外的另外3组中可能存在的结核分枝杆菌隐性感染者作为假阳性有关。
三、恶性肿瘤患者IGRA-ELISA检测结果阳性原因分析
目前,未发现IGRA-ELISA技术在恶性肿瘤患者中应用的研究报告。本研究采用国产IGRA-ELISA试剂,在恶性肿瘤中其阳性率为50.0%(36/72),高于刘旭辉等[3]报道的T-SPOT.TB检测在肺癌患者的阳性率[27.3%(6/22)],其原因可能与样本量及方法学不同,或者是本研究所选取的肿瘤患者存在潜伏结核感染有关;本研究中恶性肿瘤组IGRA-ELISA技术的检测阳性率显著高于健康对照组的阳性率,与刘旭辉等[3]的报道基本一致。同时,本研究进一步对不同类别肺部恶性肿瘤进行分层研究,结果显示IGRA-ELISA技术检测对于不同类别恶性肿瘤[肺腺癌、肺鳞癌、小细胞肺癌、其他恶性肿瘤(如淋巴瘤、小细胞肝癌、肾癌等)]的诊断敏感度均相似,差异无统计学意义,说明肿瘤类别对该技术检测结果无显著影响。
结合文献报道分析研究结果,恶性肿瘤患者其IGRA-ELISA技术的检测阳性率较肺炎组及健康对照组高可能与下列因素有关:(1)我国是结核感染的高负担国家,恶性肿瘤患者IGRA-ELISA技术检测阳性可能与肿瘤患者免疫力低下更容易合并潜伏结核感染有关。(2)肿瘤效应T淋巴细胞的存在:肿瘤形成过程中,机体会产生抗肿瘤免疫,这种抗肿瘤免疫主要由T淋巴细胞所介导,其基础是CD8+细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTLs)和CD4+1型辅助性T细胞(Th1)所介导的1型适应性免疫应答。免疫记忆是适应性免疫应答的重要特征之一,而效应性T淋巴细胞是记忆T淋巴细胞的主要组成[10-12]。这与机体在初次感染结核分枝杆菌后产生的记忆性T淋巴细胞主要为CD4+、CD8+T淋巴细胞[13]具有相似的机制。所以,在肿瘤形成过程中是否会产生某种同源效应性T淋巴细胞在受到ESAT-6和CFP-10蛋白刺激后释放γ-干扰素,从而表现为IGRA-ELISA检测结果阳性?综上所述,使用海口维瑅瑷生物研究院结核分枝杆菌特异性细胞免疫反应检测试剂盒的IGRA-ELISA法敏感度较高,但特异度一般,对于恶性肿瘤患者不能确定是其否存在结核分枝杆菌感染。本研究结果提示IGRA-ELISA在恶性肿瘤患者中检测阳性率较高这一现象,还需进一步扩大恶性肿瘤组患者的样本量并且进行深入的机制研究来验证。
[1] Lalvani A. Diagnosing tuberculosis infection in the 21st century: new tools to tackle an old enemy. Chest, 2007, 131(6): 1898-1906.
[2] 龙云江. 浅谈结核病防制的健康教育. 中国医药指南, 2011, 9(19): 174-175.
[3] 刘旭晖, 乐军, 张忠顺, 等. γ-干扰素释放试验 (IGRA) 的诊断价值探讨 (高感染率背景下的研究结果). 中国防痨杂志, 2010,32 (12): 801-805.
[4] Dye C. Global epidemiology of tuberculosis. Lancet, 2006, 367(9514): 938-940.
[5] Mazurek GH, Jereb J, Lobue P, et al. Guidelines for using the QuantiFERON-TB Gold test for detectingMycobacteriumtuberculosisinfection, United States. MMWR Recomm Rep, 2005, 54(RR-15): 49-55.
[6] Mazurek GH, Jereb J, Vernon A, et al. Updated guidelines for using Interferon Gamma Release Assays to detectMycobacteriumtuberculosisinfection-United States, 2010. MMWR Recomm Rep, 2010, 59(RR-5):1-25.
[7] Diel R, Goletti D, Ferrara G, et al. Interferon-γ release assays for the diagnosis of latentMycobacteriumtuberculosisinfection: a systematic review and meta-analysis. Eur Respir J, 2011, 37(1): 88-99.
[8] 刘斌, 殷水泽, 马世武, 等. 全血 γ 干扰素释放试验在拟诊结核患者中的应用价值. 西南国防医药, 2014, 24(7): 721-723.
[9] Diel R, Loddenkemper R, Nienhaus A. Evidence-based comparison of commercial interferon-gamma release assays for detecting active TB: a metaanalysis. Chest, 2010, 137(4): 952-968.
[10] 李刚. 转录因子 T-bet, Eomes 和 IL-33 对 CD8+记忆和效应 T 细胞抗肿瘤的作用机制. 苏州:苏州大学, 2013.
[11] 李嫣红, 谢灿茂. Th1/Th2 免疫应答系统在结核性胸膜炎患者中的表达. 中华结核和呼吸杂志, 2004, 27(5): 324-327.
[12] Tong ZH, Shi HZ. Subpopulations of helper T lymphocytes in tuberculous pleurisy. Tuberculosis(Edinb), 2013, 93(3): 279-284.
[13] 林艳荣, 许丁空. 肺结核患者 T 淋巴细胞亚群的检测及临床意义.内科, 2007, 2(3): 320-321.
(本文编辑:薛爱华)
Comparative of the test results of tuberculosis and malignant tumor by interferon-gamma release assays
HUANG Yi, DANG Li-yun, GUO Qi, ZHANG Yao-hui, XIE Kun, WANG Long-zhi.
Xi’an Tuberculosis and Thoracic Tumor Hospital, Xi’an 710061, China
DANG Li-yun, Email: dangliyun@sina.com
Objective To compare the test results of tuberculosis (TB) patients, malignant tumor patients and healthy people by interferon-gamma release assays (IGRAs), and analyze the clinical significance. Methods A total of 164 patients who were treated and 50 people had health checkup in the Xi’an Tuberculosis and Thoracic Tumor Hospital from March 2014 to December 2014 was involved in this study. The patients were divided into TB group (51 cases), malignant tumor group (72 cases) and pneumonia group (41 cases), 50 people was in health group. We adopted the kits which were produced by HaiKou WeiTiYuan biological research institute. All data were analyzed with SPSS 13.0 software. Chi-square test was applied for categorical data.P<0.05 was statistically significant. Results The positive rates by IGRAs were 98.0% (50/51) for TB group, 50.0% (36/72) for malignant tumor group, 29.3% (12/41) for pneumonia group and 8.0% (4/50) for health group. Compared with health group, the positive rates of TB group, malignant tumor group and pneumonia group were significantly higher (χ2=82.26, 23.62, 7.03,P<0.05). However, the positive rates of various types of malignant tumor were similar (χ2=2.27,P>0.05), including 54.8% (17/31) for lung adenocarcinoma, 38.9% (7/18) for lung squamous carcinoma, 40.0% (4/10) in small cell lung cancer and 61.5% (8/13) for others. Conclusion The IGRAs has higher sensitivity and lower specificity in the diagnosis of TB. And it has high positive rate in the malignant tumor, which needs further research.
Tuberculosis/diagnosis; Carcinoma; Interferon-gamma release tests; Enzyme-linked immunosorbent assay
10.3969/j.issn.1000-6621.2015.07.012
710061 西安市结核病胸部肿瘤医院
党丽云,Email:dangliyun@sina.com
2015-02-09)

