铝与水反应演示实验装置的设计
叶永谦+张贤金+吴新建+叶燕珠
摘要:为改善铝与水反应演示实验的效果,使用氢氧化钠溶液、氯化汞溶液、煤油等试剂,将筒式分液漏斗等一些常见仪器进行组装,设计了铝与水在中性条件下反应的演示实验装置,可明显地观察到有氢气和氢氧化铝生成。
关键词:铝与水反应;演示实验;实验创新
文章编号:1005–6629(2015)2–0062–02 中图分类号:G633.8 文献标识码:B
铝作为一种较活泼金属,具有与水反应的性质。由于铝极易与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻碍了铝与水的反应[1],导致无法观察到铝与水直接反应的现象。即便破坏了铝表面的氧化膜,铝与水反应生成的氢氧化铝也会覆盖在铝表面导致反应难以进行。
本实验通过常见仪器的组装,设计出可以明显观察到铝与水反应生成氢氧化铝、氢气的装置,适合在课堂上演示,让学生真正感受铝与水反应的实质。
1 实验原理
本实验的难点在于:一是铝表面的氧化膜除去之后如何防止致密氧化膜重新生成;二是如何防止反应生成的氢氧化铝覆盖在铝表面;三是如何确保反应在无氧环境下进行。
1.1 防止氧化膜重新生成的设计原理
本实验先使用氢氧化钠溶液与铝箔反应破坏其氧化膜,再用沸水洗去氢氧化钠溶液,然后使去膜的铝箔与氯化汞溶液反应生成铝汞齐。通过铝汞齐的形成,使部分晶格铝原子的位置被汞原子占据,无法再形成致密的氧化物保护膜[2]。
1.2 防止氢氧化铝覆盖在铝表面的设计原理
本实验使用热的氯化钠溶液代替水与去膜的铝箔反应。由于氯离子能够穿破膜孔或者膜表面裂缝,使氢氧化铝从铝表面脱落[3],反应可以持续进行。
1.3 无氧环境的设计原理
本实验过程中铝箔始终浸没在煤油或者溶液中,并且反应所需的溶液溶剂均使用沸水,防止水中溶解的氧气氧化铝箔。
2 实验装置
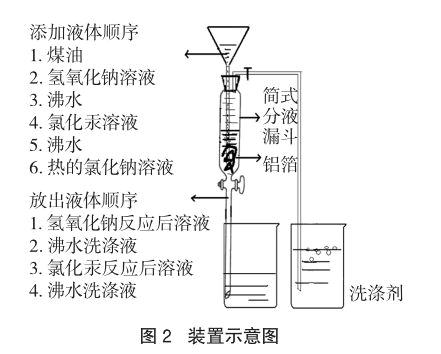
本装置所用仪器均为实验室常见仪器,其中筒式分液漏斗是装置的核心部分。筒式分液漏斗筒部容量大,可以作为反应发生装置并有利于观察到明显现象;底部的玻璃活塞可以反复分液,特别适用于本实验中液体多次变化的需要。装置实物图(图1)及装置示意图(图2)如下:
3 实验步骤及现象
3.1 使用氢氧化钠溶液破坏氧化膜
步骤:在筒式分液漏斗中装入长条状铝箔(宽约1厘米,长约20厘米),关闭玻璃活塞,打开导气管止水夹,往三角漏斗中加入煤油至浸没铝箔,然后加入10%氢氧化钠溶液至浸没铝箔,用于除去铝箔表面的氧化膜。
现象:铝箔浸没在煤油中无明显现象,接触到氢氧化钠后表面有气泡冒出(图3)。
3.2 使用沸水洗去铝箔表面的氢氧化钠溶液
步骤:当氢氧化钠与铝箔反应有大量气泡出现时,打开筒式分液漏斗活塞,使氢氧化钠反应后溶液迅速流出。关闭活塞,再往筒式分液漏斗中加入沸水至混合液体充满筒部,然后打开活塞使洗涤过的沸水流出,重复2~3次。
现象:沸水接触到铝箔有少量气泡冒出。通过洗涤,可以避免氢氧化钠溶液对后续反应的干扰。
3.3 使用氯化汞溶液在铝表面形成铝汞齐
步骤:关闭筒式分液漏斗活塞,往其中加入5%氯化汞溶液。
现象:铝与氯化汞溶液发生反应,铝箔少量溶解,表面有灰色物质析出(图4)。
3.4 使用沸水洗去铝表面的汞
具体步骤与3.2相同。
3.5 使用热的氯化钠溶液与铝反应
步骤:在铝表面的汞用沸水冲洗后,关闭筒式分液漏斗活塞,往其中加入使用沸水溶解配制的饱和氯化钠溶液至混合液体充满筒部,并关闭导气管止水夹,将导气管插入装有洗涤剂的烧杯中。一段时间后,打开止水夹,用燃烧着的木条接触洗涤剂液面。
现象:铝与热的饱和氯化钠溶液接触后,表面立即有气泡冒出,一段时间后,溶液呈现白色浑浊(图5)。三角漏斗中液面上升,上升的液体也呈现白色浑浊(图6)。打开止水夹后,三角漏斗中液面下降,导气管口有气体冒出并在洗涤剂表面形成气泡,用燃烧着的木条接触气泡可以观察到气泡破裂燃烧且伴随着明显的爆鸣声。
4 实验结论
通过铝与热的氯化钠溶液反应,观察到铝箔表面有气泡冒出、三角漏斗中液面上升、洗涤剂表面产生的气泡燃烧及爆鸣声可以判断铝与水反应产生的气体是氢气。通过筒式分液漏斗下层液体及三角漏斗液体中出现的白色浑浊,可以判断反应有氢氧化铝生成。综合以上现象,可以判断铝可以与水直接反应,铝与水反应不一定需要在碱性条件下进行。
参考文献:
[1]王祖浩主编.普通高中课程标准实验教科书·化学1(必修)[M].南京:江苏教育出版社,2009:67.
[2]荆入德.铝与水反应实验的设计[J].化学教学,2005,(11):7~8.
[3]季明余,朱永侃.卤素离子对镁、铝与水反应的影响研究[J].实验教学与仪器,2005,(4):32~33.

