含有轴向配体的酞菁金属材料的合成与应用进展
崔 娜,井晓慧,程振华,卜婷婷,朱丽君,夏道宏
(中国石油大学(华东)重质油国家重点实验室,山东 青岛 266580)
酞菁金属是由18个电子组成的二维大环π共轭体系[1-2],酞菁环同时具有电子对给予体和电子对接受体的特性。酞菁金属配合物有聚集形成二聚体甚至多聚体的倾向[3],这种聚集会增强共面酞菁环之间的范德华引力,酞菁环电子结构的扰动会造成基态和激发态的改变,对材料光学特性有显著影响,对作为催化剂的酞菁金属的活性及稳定性也有影响[4]。而在酞菁环中心金属上引入轴向配体后,可以降低 甚至消除酞菁分子聚集的发生,能极大地调变这类材料的功能,使其在诸多方面表现出优异的性能[5]。轴向配位酞菁金属材料在催化氧化催化剂、太阳能电池、生物抗癌等领域得到了广泛应用并展现出诱人的前景[6-8]。
本文对轴向配位酞菁金属配合物的合成和应用进展进行了综述,并对其发展前景进行了展望。
1 含有轴向配体的酞菁金属配合物的结构及合成进展
1.1 含有轴向配体的酞菁金属配合物的结构
1907年Braun和Tehemiac在一次实验过程中偶然发现了酞菁[9]。酞菁是一类由4个异吲哚单元构成的大环有机化合物,环内空穴直径为2.7×10-10m,可容纳钴、镍、铜、铁、铝等金属原子[10]。轴向配位酞菁金属配合物的分子结构见图1。

图1 轴向配位酞菁金属配合物的分子结构Fig.1 Molecular structure of metal phthalocyanine with axial ligands.
当酞菁金属配合物轴向配位时,可以形成带有一个配体的三角锥构型或两个配体的八面体配位构型。由于酞菁的刚性结构,酞菁环的4个吲哚单元中配位氮原子严格共平面,所有赤道方向上的金属—氮原子键都是等长的。双轴向酞菁金属配合物的两个配体一般是相同的,两配体对中心金属的作用力相等,因而中心金属恰好位于酞菁环平面内的空穴中心。但单轴向酞菁金属配合物中,由于不对称配位或中心金属本身尺寸大于酞菁环空穴,中心金属常常位于平面外。从键角及二面角来看,轴向配体平面与赤道平面恰好垂直。
对于轴向配位酞菁金属配合物,中心金属原子的氧化态一般是+2,+3,+4价,且随氧化态的增加,轴向金属—氮原子键长增长,稳定性减弱。酞菁金属常常会形成一维链状、一维梯状,甚至是二维片状的超分子结构[11]。
从最初的无中心金属,到引入多种金属原子、引入各种复杂取代基、引 入单轴和双轴向配体,酞菁经历了一个漫长的衍化过程,朝着结构复杂化、合成简单化、用途广泛化的方向发展。酞菁金属的用途,也从最初的染料领域,拓展到油品催化氧化脱硫醇催化剂、高限幅非线性光学材料、光敏化太阳能电池等领域。
1.2 含有轴向配体的酞菁金属配合物的合成进展
轴向配位酞菁金属配合物的合成方法有两种:一种是以酞菁金属和配体为原料,直接发生反应进行合成;另一种则是利用新的轴向配体取代带有轴向配体的酞菁金属配合物得到。
1.2.1 直接合成法
2002年,许秀枝等[12]利用1,8-二氮杂二环十一碳-7-烯液相催化法合成了1,4,8,11,15,18,22,25-八丁氧基酞菁钴。在培养八-α-丁氧基酞菁钴单晶的过程中,他们意外发现了由吡啶和甲醇双轴向不对称配位的八-α-丁氧基酞菁钴配合物的存在,其中,吡啶氮原子及甲醇氧原子与中心钴原子的距离分别为0.210 8 nm和 0.191 9 nm。两种轴向配体的引入,使得酞菁环骨 架发生了由马鞍状构型到平面构型的显著变化。
2004年,文献[13]公开了一种制备卤素轴向配位酞菁金属配合物的方法,该类配合物是一种新型高效的含酸原油脱硫催化剂。合成方法是将酞菁金属(FePc,NiPc,CoPc,MnPc(Pc表示酞菁))和卤素(Cl2,Br2,I2)配体在惰性溶剂中混合,得到可以用于多种石油馏分脱臭的优质催化剂。该轴向配位酞菁钴催化剂不易从床层流失,且活性高,不易失活。
2005年,牛效迪等[14]以1 ,8,15,22-四-(2,4,6-三甲基苯氧基)酞菁钴和吡啶为原料,在160 ℃下于高压反应釜中反应,酞菁环上的取代基随反应时间的延长而全部脱落,经过4 h后得到无取代基的双轴向吡啶配位酞菁钴配合物。
2008年,丁小霞等[15]以邻苯二酚和对四-α-(戊氧基)钛氧酞菁为原料,以氮气作保护气,氯仿作溶剂,在搅拌回流条件下反应2 h,得到绿色粉末状单轴向配位邻苯二氧-四-α-(戊氧基)酞菁钛配合物。
2009年,Antonina研究小组[16-17]利用甲醇和CO作为轴向配体对四-15-冠-5-酞菁钌进行不对称组装,得到了轴向配位酞菁金属配合物,并通过原子力显微镜证实了该类配合物的结构。
2011年,Nishida等[18]经过一系列步骤得到了双树枝状配体轴向配位酞菁硅配合物。在冰水浴及氮气保护下,以无水碳酸钾、树枝石、二氯合酞菁硅、18-冠醚-6和甲苯作溶剂,在150 ℃下搅拌反应15 h,即得树枝状酞菁硅双轴向配位配合物。通过引入轴向配体获得了高水溶性的酞菁化合物,同时其在有机 溶剂中也具有较好的溶解性。
2011年,Bergkamp等[19]由相应的酚类合成了一系列带有苯氧基轴向配体的八丁氧基取代酞菁硅。Martín-Gomisa等[20]合成了SiPc1和SiPc2两种新型轴向配位酞菁硅配合物(结构式如图2所示),并作为感光剂被首次用在数码照相机设备上。相比而言,两者有相似的HOMO-LUMO值,但SiPc2比SiPc1表现出更高的总转化效率,性能更加优越。

图2 两种新型轴向配位酞菁硅配合物Fig.2 Two novel axially substituted silicon phthalocyanines.
2012年,Wong等[21]将钾石墨与酞菁镁在1,2-二甲氧基乙烷(DME)溶液中混合,立即发生反应,溶液变为深紫色。通过过滤、减压蒸馏等方法提纯得到产率为67%的紫色粉末配合物[K2(DME)4]PcMg(OH),其中,μ3-OH配体轴向桥接于[MgIIPc3-]阴离子上。
2013年,He等[22]合成了两种具有荧光传感用途的二-(2-甲基吡啶)氨基双轴向配位酞菁硅配合物。Masilela等[23]利用二-(1,6-己二硫醇)金、银纳米颗粒对酞菁锌进行轴向调变反应,得到了光物理化学性能和抗菌性能均显著提高的酞菁锌配合物。Janczak等[24]将β-FePc与三-丁基异腈直接混合,反应得到晶态的低自旋双-(三-丁基异腈)酞菁铁配合物。
1.2.2 取代合成法
2007年,李惠[25]利用磷酸盐缓冲溶液配制了不同pH的溶液,通过研究不同pH下四磺化酞菁钴(CoTSPc)的紫外吸收光谱变化,来推测中心金属的轴向配位情况。在pH>10.5时,碱性介质中的OH-可作为配体,轴向作用于中心金属钴,迫使聚四磺化酞菁钴部分解聚,生成带羟基的五配位四磺化酞菁钴Co(Ⅱ)TSPc(OH)单体;当pH=12时,新加入的甲巯咪唑取代羟基与中心金属钴配位,最终生成空间位阻更大的Co(Ⅱ)TSPc-RSH轴向配合物,解聚程度进一步加大。
2009年,Antunes等[26]合成了一系列双轴向配位酞菁磷配合物,轴向配体苯基和辛基的引入大幅改善了酞菁磷配合物的溶解性能,使其在吡啶、二甲基亚砜、二氯甲烷、四氢呋喃等溶剂中可溶,且不发生聚集。
2015年,Atmaca等[27]以双轴向氯取代酞菁硅、碳硼烷一元醇为原料,合成了双轴向碳硼烷笼取代酞菁硅配合物。合成过程为:将双轴向氯取代酞菁硅与碳硼烷一元醇溶解在甲 苯溶剂中,以干燥的NaH作催化剂,氩气作保护气,在110 ℃下搅拌回流反应24 h,得到双轴向碳硼烷笼取代酞菁硅配合物。
2 含轴向配体的酞菁金属配合物的应用研究进展
2.1 高活性催化氧化催化剂
轴向配体对酞菁金属的催化氧化活性具有很大影响。在酞菁钴/NaOH催化体系中加入一定量的吡啶,随吡啶浓度的增加,催化剂催化氧化硫醇的速率呈先升高后降低的规律[28]。当吡啶浓度较低时,吡啶与酞菁钴形成了单轴向配位,增强了钴原子的氧化还原能力,故硫醇氧化速率随之增大。但当吡啶浓度进一步增加时,吡啶与酞菁钴形成了双轴向配体化合物,空间位阻增大,体系相对稳定,吸氧不活泼,故硫醇氧化速率降低,其轴向配位过程见图3。
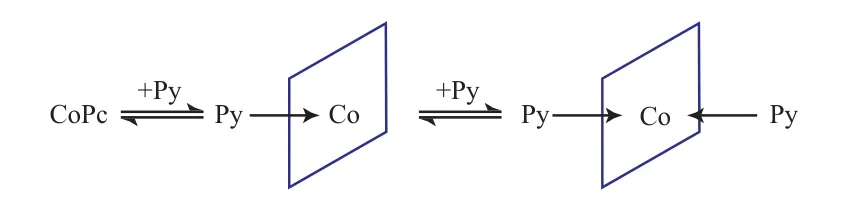
图3 吡啶与酞菁的轴向配位过程Fig.3 Axial coordination reaction process between pyridine and phthalocyanine.
袁诗海等[29]研究了CoTSPc与配体的配位反应,采用分光光度法测定了不同浓度的CoTSPc在NH3、CN-和乙二胺的水溶液中的最大吸收波长下的吸光度。研究结果表明,CoTSPc与NH3、CN-、乙二胺生成的轴向配合物CoTSPcLn均为双轴向配体结构。水溶液中CoTSPc的吸光度与浓度的关系远远偏离朗伯比尔定律;而在NH3、CN-、乙二胺等配体的存在下,在(0.01~1)×10-5mol/L的范围内,浓度与吸光度遵循朗伯比尔定律。由此表明,CoTSPc轴向配位抑制了二聚体的生成,在水溶液中以单体的形式存在,其稳定常数分别达到105.328,109.116,104.639。
刘巍等[30]对CoTSPc催化氧化硫化钠进行了研究,通过光谱分析推测出了CoTSPc催化氧化硫化钠反应的过程,见式(1)和式(2)[31]。溶液中的CoTSPc通过环与环的相互作用生成缔合体,但引入轴向配体后,CoTSPc周围的溶剂层受到破坏,缔合体解聚,体系混乱度增大,熵变大于零。因此可以得出结论,熵效应是推动轴向配位反应发生的重要因素。
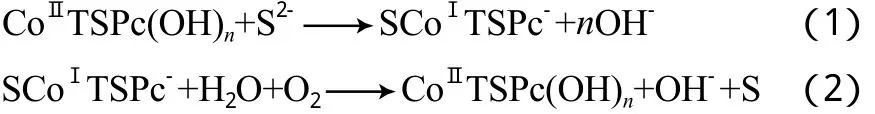
周毅等[32]用分光光度法研究了碱性水溶液中氢氧化2,9,16,23-四羧基酞菁铁(Ⅲ)与咪唑类配体的轴向配位反应热力学。研究结果表明,轴向配位是吸热反应,而配体的电子效应是影响该反应稳定常数及配位数的最重要因素。作为给电子基的甲基增强了咪唑环上配位氮原子的亲核性,促进了轴向配位反应的进行,反应平衡常数增大3~4倍,配位数升高为2。而作为吸电子基的醛基,反应平衡常数则降低了50%,配位数为1。
Das等[33]利用酞菁钴和亚硫酰氯反应,得到二氯合酞菁钴配合物(FBSC),并将该产物首次应用于较重馏分油的固定床脱硫工艺。在硫醇总浓度相同的条件下,单位FBSC的累计处理物料量为80 L,而商业催化剂的累计处理 物 料量只有75 L。在该性能测试中,FBSC的平均硫醇转化率保持在95%以上,而商业催化剂则维持在93%以上。显然,FBSC的催化活性优于商业催化剂。由于轴向配体的修饰,该二氯合酞菁钴催化剂表现出比商业酞菁钴催化剂更佳的稳定性及催化活性。
2.2 优质光盘记录材料
酞菁金属化合物在近红外-可见光区有较强的吸收,且光热稳定性强,故酞菁金属化合物还被用作光记录介质。作为优质的光记录材料,要求在激光记录波段780 nm处有较小的消光系数和较大的折射率,以获得较高的反射率。但酞菁金属具有易聚集的特性,使得吸收光谱拓宽,不能满足光记录性能的要求。
牛效迪等[34]通过研究发现,配体轴向配位于中心金属原子,会使得酞菁环与环之间的共轭作用受到抑制,引起紫外吸收光谱变化,最大吸收波长的红移及峰强度的增加均有利于酞菁金属光记录性能的改善。汪舰等[35]研究了烷氧基酞菁钴(Ⅱ)配合物与咪唑在溶液中的双轴向配位反应。研究结果表明,位于酞菁环平面两侧的咪唑增大了空间位阻,使得分子难以相互靠近发生聚集,其稳定性能得到改善。同时,轴向配体的存在扩大了共轭电子体系,使得最大吸收波长红移,吸收峰变窄,光学性质得到改善,为开发性能优良的光记录材料提供了方向。
2.3 高限幅非线性光学材料
在轴向配位酞菁金属配合物中,钛氧酞菁的三阶非线性光学系数最高。钛氧酞菁中金属原子Ti的半径大于酞菁环空穴尺寸,使得原子团处于酞菁环平面外,这种非平面结构会增大轴向偶极距。同时,金属原子Ti处于高氧化态,可以轴向配位其他基团,对其非线性光学极化率有很大贡献。Chen等[36]将含富勒烯的有机配体轴向引入到酞菁钛中,合成了一种轴向不对称配位的酞菁钛配合物。轴向配体使得环平面轴向偶极距增大,π电子分布改变,非线性光学实验证明了此配合物具有较强的反饱和吸收性能。
Torres研究小组[37]对实验室合成的富勒烯轴向配位的酞菁钛配合物进行了光振幅性质研究。轴向配体的引入使得酞菁钛在激光作用下表现出反饱和吸收性质及光限制性质。 大共轭体系的酞菁和富勒烯具有优良的非线性光学性质,将二者轴向配位结合,大幅拓宽了其在非线性光学材料领域的应用前景。
高丽丽等[38]制备了轴向配位全氟酞菁钛配合物F16PcTiO和F16PcTiO2PhCHO,并研究了两者在不同溶剂中的非线性光学性能。强吸电子基团醛基作为轴向配体引入后,分子极化能力降低,非线性吸收系数降低,因而F16PcTiO的非线性光学性能优于F16PcTiO2PhCHO。另外,随着溶剂极性的增强,溶解度增大,单位体积内的酞菁分子增多,其非线性光学性能增强,故F16PcTiO2PhCHO在氯仿溶剂中比在甲苯溶剂中具有更好的光限幅性能。
2.4 高效光敏化染料太阳能电池
1991年,Gratzel教授首次在《Nature》上公开了一种具有7%以上光电转换效率的太阳能染料电池[39]。染料敏化太阳能电池可 在一定程度上替代化石燃料,因而获得了越来越多的关注。高效的光敏染料可以提高电子注入效率,是优化太阳能染料电池性能的重要因素。光敏材料要求有较宽的可见光响应区间,吸收范围尽可能地处于可见光区,向红外光区延伸。
2007年,Morandeira 等[40]分析了轴向配位酞菁金属配合物的染料敏化性能。研究结果表明,它的载流子注入率及光电转换率并不理想。但轴向配体的引入可有效阻止了染料分子聚集,降低分子间的相互作用,为合成高光电转换率的轴向配位酞菁染料提供了参考。
2007年,Fukuzumi研究小组[41]和Osamu研究小组[42]分别合成了富勒烯轴向配位的酞菁金属配合物。这两种配合物均具有稳定的电荷分离态,光谱吸收峰延伸至700 nm波长处,寿命延长,可用于光捕捉系统。
聚-3-己基噻吩(P3HT)和富勒烯衍生物(PCBM)是太阳能电池活性层的给受体材料。Xu等[43]研究了酞菁钴轴向配体的位阻效应对P3HT:PCBM染料敏化作用的影响。实验结果表明,向酞菁钴轴向引入位阻大的基团,酞菁核单元的分子状态和P3HT:PCBM共混膜的界面分布情况几乎不发生改变,P3HT:PCBM的光捕获效率提高。在一定范围内,随轴向配体碳链的增长,空间位阻增大,能量转化效率增强。丁基或己基长链作为轴向配体时,能量转化效率提高至4.2%,比无配体的酞菁金属提高了10%。通过密度泛函理论计算,得出丁基和己基长链是提高P3HT:PCBM敏化效率的最佳轴向配体。
但2013年Rodríguez-Morgade等[44]提出了不同观点。他们研究了不同轴向配体对酞菁钛配合物的光敏化效率的影响,其轴向配体分别为:不带有、带有1个、带有2个磺酸基团的萘二酚类化合物。研究结果表明,配体的改变并未对其光敏化性能造成影响,三者的光敏化效率相同;以二氧化钛取代上述轴向配体,其光敏化效率与上述3种配合物的相同。从而可得出结论:当酞菁金属种类不变时,轴向配体类型的改变不会对光敏化效率产生影响。
张明晶等[45]对一系列吡啶轴向配位的酞菁钌配合物[PcRu(RPy)(Py-COOH)](Py为吡啶、R分别代表—COOH,—CN,—H,—Me,—OMe)进行了理论模拟和吸收光谱分析,其结构式如图4(a)所示。研究结果表明,光照条件下双轴向吡啶基羧酸不对称配位的酞菁钌配合物受到激发产生光电子,只有激发到轴向吡啶基团的电子才能从中心金属通过吡啶基羧酸配体形成的π*轨道,最终通过COO—Ti的键合,进入到半导体[46],但占绝大部分的酞菁环赤道平面内的π→π*跃迁则对电子注入未有贡献。在此基础上,他们设计了一种新型轴向酞菁金属配合物[((HOOC)4(Pc))Ru(NCS)2]2-,结构式如图4(b)所示。该化合物使得环内π→π*电子跃迁与电子注入方向一致,同时,将半导体的联接基团修饰在酞菁环上,强供电子基异硫氰基团作轴向配体,可大幅提高该类材料的光敏特性,为今后染料光敏电池的设计与开发提供了重要方向和参考意义。
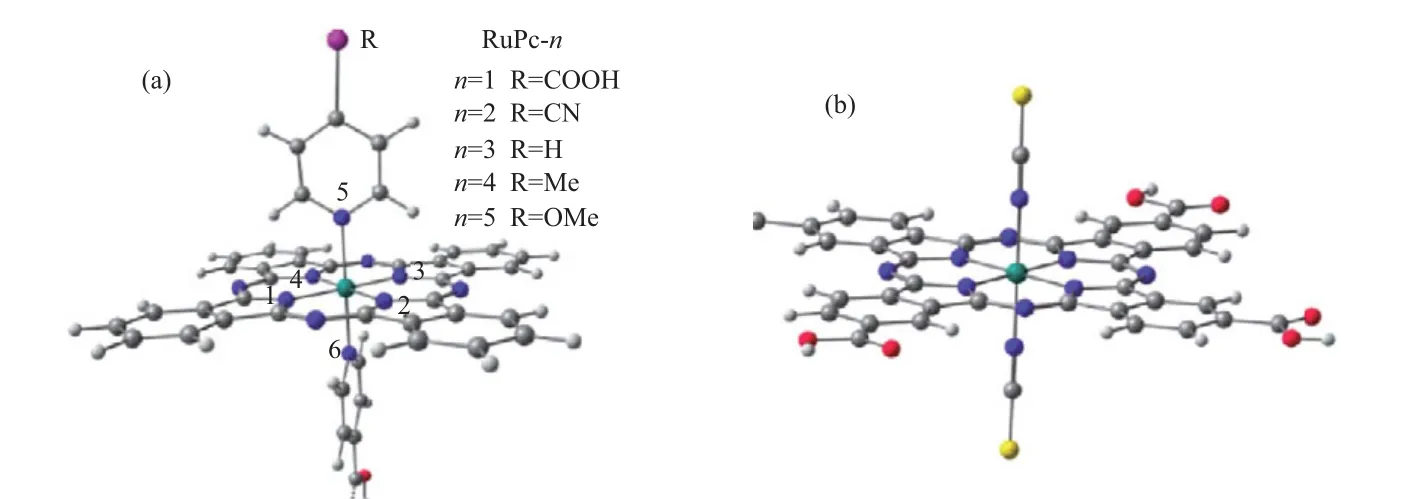
图4 酞菁钌配合物(a)和[((HOOC)4(Pc))Ru(NCS)2]2-(b)化合物的结构Fig.4 Structures of Ru-phthalocyanine complexes(a)and[((HOOC)4(Pc))Ru(NCS)2]2 complex(b).
2.5 高迁移率的半导体材料
酞菁金属配合物具有18π共轭体系及可与π轨道发生重叠的d轨道,这样的结构有利于酞菁金属配合物发生电荷转移。除此之外,酞菁金属配合物还表现出良好的热稳定性能。因而,酞菁金属配合物常被用作优质的半导体材料。
2009年,蔡雪[47]对一系列轴向酞菁锡配合物进行了半导体性质的考察。根据密度泛函理论,从HOMO和LUMO轨道能量、离子化能、重组能、电子耦合率、电子亲和能及迁移率6个方面进行系统分析。研究结果表明,在酞菁锡轴向位置引入吸电子基团后,分子的π电子共轭体系扩大,HOMO和LUMO轨道能量降低,足够的电子可以进入LUMO轨道并且分子间π轨道重叠增大,材料的半导体性质发生变化。引入轴向配体后的酞菁锡系列配合物具有较高的迁移率,可作为n型半导体材料。该研究首次从理论上成功解释了轴向酞菁金属配合物的半导体本质属性,为进一步设计合成新型、优良性质的半导体材料提供了借鉴。
2012年,马锋[48]制备了轴向配位全氟酞菁氧钒及二氯合全氟酞菁锡,并对其光物理性能及电化学性能进行了测试。研究结果表明,相较于无轴向配位的酞菁金属,二氯合全氟酞菁锡及全氟酞菁氧钒的Q带吸收峰红移至710 nm处,这是因为单轴向配位的全氟酞菁氧钒共面程度变差,酞菁环内的电子流动性增强,更易于发生电子跃迁。轴向配体的存在使得LUMO及HOMO能级值均降低,并显示出了n沟道特性。由此可见,强吸电子基团作为酞菁金属的轴向配体,有利于制备出具有高的电子迁移率的优良的半导体材料,对于有机半导体元件的实用化具有重要的意义。
目前有机半导体材料的研究多集中在p型半导体器件,而 对n型有机半导体材料涉及较少。但n型半导体材料是p-n结二极管、互补逻辑电路等的重要组成部分,因此开发可应用于有机薄膜晶体管器件中n型半导体元件的酞菁金属,是目前的研究重点。在p型分子材料上引入强吸电子基团将p型半导体材料转变成n型半导体材料,使得电子的有效注入增多、LUMO能级降低,获得更好的溶解性和稳定性,成为获得高性能半导体材料的主要发展方向之一。
2.6 光动力抗癌高活性轴向酞菁配合物
酞菁及酞菁金属配合物是一种新型光敏剂,在光激发作用下,产生单线态氧或超氧阴离子自由基,表现出光氧化还原特性,被用在荧光定位诊断和光动力治疗癌症及其他疾病。在中心金属上轴向引入配体可减弱酞菁金属配合物的聚集行为,且空间位阻大的配体作用更加显著。若将空间位阻较大的基团引入到酞菁配合物环上,会导致细胞摄取率及抗癌活性大幅降低;若将其轴向引入到中心金属上,则显示出令人惊喜的高抗癌活性。由此可见,轴向酞菁配合物作为抗癌光敏剂在生物体中具有广阔的应用前景[49]。
曹育红等[50]以四磺化钛氧酞菁为原料、苏木精为轴向配体,合成了单轴向苏木精配位四磺化钛氧酞菁。通过比较四磺化钛氧酞菁轴向配位前后的紫外光谱,可以看出轴向配体形成后,分子对称性下降,最大吸收波长向长波方向移动,单体吸收峰强度增强,二聚体的吸收峰强度显著减弱,产物稳定性及光敏性能大为改善,在治疗老年黄斑变性方面表现出了极大的潜力。
3 结语
近些年来,轴向配位酞菁金属配合物的光电特性得到了广泛关注,在光盘记录材料、非线性光学材料、太阳能电池、光动力抗癌等领域的应用尤为显著。带有轴向配体的酞菁金属类化合物由于其优越的溶解性及稳定性,表现出极大的优势,通过轴向配位基团的修饰,改善其光电性能,大大拓宽了酞菁金属类配合物的实用价值和商品价值,尤其是在太阳能染料电池领域具有良好的开发前景。相信在未来,对轴向配位酞菁配合物的研究热点会转移到其光电性能,越来越注重其在太阳能电池、光电材料等领域的功能性和实用性。
[1]Burat A K,Koca A,Lewtak J P,et al. Preparation,Electrochemistry and Optical Properties of Unsymmetrical Phthalocyanines Bearing Morpholine and tert-Butylphenoxy Substituents[J]. Synth Met,2011,161(15):1537 - 1545.
[2]Saka E T,Çakır D,Bıyıklıoğlu Z,et al. New Soluble Peripherally Tetra-Substituted Co(Ⅱ), Fe(Ⅱ)Phthalocyanines:Synthesis,Spectroscopic Characterization and Their Catalytic Activity in Cyclohexene Oxidation[J]. Dyes Pigments,2013,98(2):255 - 262.
[3]Leng Xuebing,Choi Chi-Fung,Luo Hai-Bin,et al. Host-Guest Interactions of 4-Carboxyphenoxy Phthalocyanines and β-Cyclodextrins in Aqueous Media[J]. Org Lett,2007,9(13):2497 - 2500.
[4]Wei Shaohua,Zhou Jiahong,Huang Deyin,et al. Synthesis and TypeⅠ/TypeⅡPhotosensitizing Properties of a Novel Amphiphilic Zinc Phthalocyanine[J]. Dyes Pigments,2006,71(1):61 - 67.
[5]Janczak J. Synthesis,Characterisation and DFT Calculations of the Magnesium Phthalocyanine Complexes with n-Butanol and n-Pentanol[J]. Polyhedron,2014,70:164 - 171.
[6]Makhseed S,Al-Kharafi F,Samuel J,et al. Catalytic Oxidation of Sulphide Ions Using a Novel Microporous Cobalt Phthalocyanine Network Polymer in Aqueous Solution[J]. Catal Commun,2009,10(9):1284 - 1287.
[7]Burczyk A,Loupy A,Bogdal D,et al. Improvement in the Synthesis of Metallophthalocyanines Using Microwave Irradiation[J]. Tetrahedron,2005,61(1):179 - 188.
[8]Bursa B,Biadasz A,Kędzierski K,et al. Quantum Dot with Zinc and Copper Substituted Phthalocyanines:Ⅰ. Energy Transfer in Solution and In-Situ Light Absorption in Langmuir Monolayers[J]. J Lumin,2014,145:779 - 786.
[9]郑少琴,黄梅海. 印度兰的合成与应用[J]. 染料与染色,2014,51(1): 5 - 7.
[10]胡雅琴,朱永军,李祥高. 二氯酞菁锡(Ⅳ)的合成研究[J].化工新型材料,2014,42(6):129 - 131.
[11]Ni Zhonghai,Li Renjie,Jiang Jianzhuang. New Progress in Monomeric Phthalocyanine Chemistry:Synthesis,Crystal Structures and Properties[M]//Controlled Assembly and Modification of Inorganic Systems. Berlin:Springer,2009,133:121 - 160.
[12]许秀枝,王俊东. 吡啶和甲醇配位的八-α-丁氧基酞菁钴的合成与晶体结构[J]. 中国科学:B辑,2002,32(5):391 - 396.
[13]Council of Scientific & Industrial Research. Process for the Preparation of a Novel Catalyst Useful for Sweetening of Sour Petroleum Distillates:US,6696381[P]. 2004-02-24.
[14]牛效迪,傅强,潘亚茹,等. 酞菁钴吡啶轴向配合物的合成与表征[J]. 分子科学学 报,2005,21(3):25 - 28.
[15]丁小霞,郑思宁,彭亦如,等. 轴向取代邻苯二氧-四-α-(戊氧基)钛酞菁配合物的合成[J]. 合成化学,2008,16(1):12 - 14.
[16]Grishina A D,Gorbunova Y G,Zolotarevs ky V I,et al. Solvent-Induced Supramolecular Assemblies of Crown-Substituted Ruthenium Phthalocyaninate:Morphology of Assemblies and Non-Linear Optical Properties[J]. J Porphyr Phthalocya,2009,13(1):92 - 98.
[17]Vannikov A V,Gorbunova Y G,Grishina A D,et al.Photoelectric,Nonlinear Optical,and Photorefractive Properties of Polymer Composites Based on Supramolecular Ensembles of Ru(Ⅱ)and Ga(Ⅲ)Complexes with Tetra-15-Crown-5-Phthalocyanine[J]. Prot Met Phys Chem Surf,2013,49(1):57 - 65.
[18]Nishida M,Horiuchi H,Momotake A,et al. Singlet Molecular Oxygen Generation by Water-Soluble Phthalocyanine Dendrimers with Different Aggregation Behavior[J]. J Porphyr Phthalocya,2011,15(1):47 - 53.
[19]Bergkamp J J,Sherman B D,Mariño-Ochoa E,et al. Synthesis and Characterization of Silicon Phthalocyanines Bearing Axial Phenoxyl Groups for Attachment to Semiconducting Metal Oxides[J]. J Porphyr Phthalocya,2011,15(9/10):943 - 950.
[20]Martín-Gomisa L,Barea E M,Fernández-Lázaroa F,et al. Dye Sensitized Solar Cells Using Non-Aggregated Silicon Phthalocyanines[J]. J Porphyr Phthalocya,2011,15(9/10):1004 - 1010.
[21]Wong E W Y,Leznoff D B. Synthesis and Structural Characterization of a Magnesium Phthalocyanine(3-)Anion[J]. J Porphyr Phthalocya,2012,16(1):154 - 162.
[22]He Hui,Liu Jianyong,Ng D K P. A Phthalocyanine-Based Fluorescent Sensor for Zn2+Ion[J]. J Porphyr Phthalocya,2013,17(1/2):99 - 103.
[23]Masilela N,Antunes E,Nyokong T. Axial Coordination of Zinc and Silicon Phthalocyanines to Silver and Gold Nanoparticles:An Investigation of Their Photophysicochemical and Antimicrobial Behavior[J]. J Porphyr Phthalocya,2013,17(6/7):417 - 430.
[24]Janczak J,Kubiak R,Lisowski J. Structural Characterization and DFT Calculation of the Fe—C Coordinating Bond in Bis(tert-Butyl Isocyanide)Iron(Ⅱ)Phthalocyanine[J]. J Porphyr Phthalocya,2013,17(8/9):742 - 749.
[25]李惠. 钴酞菁配合物的性质及其与甲巯咪唑的作用研究[D].扬州:扬州大学,2007.
[26]Antunes E M,Nyokong T. Synthesis and Photophysical Behavior of Axially Substituted Phthalocyanine,Tetrabenzotriazaporphyrin,and Triazatetrabenzcorrole Phosphorous Complexes[J]. J Porphyr Phthalocya,2009,13(1):153 - 160.
[27]Atmaca G Y,Dizman C,Eren T,et al. Novel Axially Carborane-Cage Substituted Silicon Phthalocyanine Photosensitizer;Synthesis,Characterization and Photophysicochemical Properties[J]. Spectrochim Acta,Part A,2015,137:244 - 249.
[28]夏道宏,苏贻勋,钱家麟. 国内外轻质油品脱臭催化剂研究进展[J]. 石油大学学报:自然科学版,1995,19(3):102 - 107.
[29]袁诗海,吴星,姚荣,等. 四磺化酞菁钴轴向配位反应研究[J]. 影像科学与光化学,1996,14(4):341 - 346.
[30]刘巍,叶涛,郭荣. 四磺酸基酞菁钴与硫化物的轴向配位反应研究[J]. 光谱学与光谱分析,2004,24(6):762 - 767.
[31]冯海霞,朱志昂. 2,9,16,23-四羧基酞菁钴(Ⅱ)与硫醇,硫酚配位反应的热力学研究[J]. 无机化学学报,1999,15(6):732 - 738.
[32]周毅,朱志昂. 氢氧化2,9,16,23-四羧基酞菁铁(Ⅲ)与咪唑类配体在水溶液中轴向配位反应热力学研究[J]. 内蒙古大学学报:自然科学版,2005,36(2):152 - 154.
[33]Das G,Sain B,Kumar S. Synthesis,Characterization and Catalytic Activity of Cobalt Phthalocyanine Dichloride in Sweetening of Heavier Petroleum Fractions[J]. Catal Today,2012,198(1):228 - 232.
[34]牛效迪,马继承,赵宝中,等. 金属酞菁轴向配合物的合成及性质[J]. 化工新型材料,2004,32(2):25 - 28.
[35]汪舰,沈淑引,许慧君. 酞菁钴(Ⅱ)轴向配合物的合成及其光谱特性研究[J]. 感光科学与光化学,2000,18(2):179 - 183.
[36]Chen Y,El-Khouly M E,Sasaki M ,et al. Synthesis of the Axially Substituted Titanium Pc-C60Dyad with a Convenient Method[J]. Org Lett,2005 ,7(8):1613 - 1616.
[37]Doyle J J,Ballesteros B,de la Torre G,et al. Combination of Phthalocyanine and Fullerene Moieties for Optical Limiting[J]. Chem Phys Lett,2006,428(4):307 - 311.
[38]高丽丽,陈彧,何楠,等. 全氟取代的钛酞菁衍生物的非线性光学和光限幅性能研究[J]. 光学学报,2010,30(4):1122 - 1129.
[39]Regan B,Gratzel M. A Low-Cost,High-Efficiency Solar Cell Based on Dye-Sensitized Colloidal TiO2Films[J]. Nature,1991,353:737 - 740.
[40]Morandeira A,López-Duarte I,Martínez-Díaz M V,et al.Slow Electron Injection on Ru-Phthalocyanine Sensitized TiO2[J]. J Am Chem Soc,2007,129(30):9250 - 9251.
[41]Martin-Gomis L,Ohkubo K,Fernandez-Lazaro F,et al.Synthesis and Photophysical Studies of a New Nonaggregataed C60-Silicon Phthalocyanine-C60Triad[J]. Org Lett,2007,9(17):3441 - 3444.
[42]EI-Khouly M E,Kang E S,Kay K Y,et al. Silicon-Phtha-locyanine-Cored Fullerene Dendrimers: Synthesis and Prolonged Charge-Separated Stateswith Dendrimer Generation[J].Chem Eur J,2007,13(10):2854 - 2863.
[43]Xu Huajun,Wada Takaaki,Ohkita Hideo,et al. Dye Sensitization of Polymer/Fullerene Solar Cells Incorporating Bulky Phthalocyanines[J]. Electrochim Acta,2013,100:214 - 219.
[44]Rodríguez-Morgade M S,Pellejà L,Torres T, et al. Ti(Ⅳ)Phthalocyanines for Dye Sensitized Solar Cells[J]. J Porphyr Phthalocya,2013,17(8/9):814 - 820.
[45]张明晶,潘清江,郭元茹,等. 吡啶基酞菁Ru配合物电子结构和光谱性质计算[J]. 化学学报,2014,72(6):697 -703.
[46]金玲. 八羧基酞菁染料用于染料敏化太阳能电池的研究[D].上海:东华大学,2013.
[47]蔡雪. 在密度泛函理论基础上研究酞菁类化合物的结构,光谱及OFET性质[D]. 济南:山东大学,2009.
[48]马锋. 全氟金属酞菁的合成与性能研究[D]. 天津:天津大学,2012.
[49]黄金陵,黄剑东. 酞菁配合物的结构与其光动力抗癌活性[J]. 物理化学学报,2001,17(7):662 - 671.
[50]曹育红,彭亦如,郑思宁,等. 轴向苏木精取代-四磺酸钛氧酞菁配合物的合成与表征[J]. 福建医科大学学报,2006,40(4):394 - 397.

