啮齿动物上皮祖细胞与生物材料水凝胶生物相容性的体外研究
薛杉吴钢罗诗雨张鹏张洪钿法志强郭燕舞柯以铨徐如祥
·基础研究·
啮齿动物上皮祖细胞与生物材料水凝胶生物相容性的体外研究
薛杉1吴钢2罗诗雨3张鹏4张洪钿4法志强1郭燕舞1柯以铨1徐如祥4
目的体外检测培养细胞与生物工程水凝胶材料的相互影响,为体外培养细胞与生物工程水凝胶共移植治疗提供理论依据。方法选择两款不同组分的水凝胶Matrigel和PuraMatrix作为实验材料,以EPCs作为检测细胞,将EPCs培养于不同浓度的Matrigel(10%、20%、30%)或PuraMatrix(0.25%、0.5%、1%)表面,或与不同浓度的Matrigel或PuraMatrix混悬培养,于培养的不同时间观察培养细胞的形态,并用Alamar Blue法检测细胞的增殖情况,以确定材料的细胞毒性。观察EPCs在水凝胶中的成管化状态,以检测细胞是否仍具有生理功能。结果三种浓度Matrigel中30%的Matrigel细胞毒性较大,而三种浓度的PuraMatrix中1%的PuraMatrix细胞毒性较大。EPCs培养于Matrigel表面较混悬其中的细胞增殖率高,而且此差异随Matrigel的浓度增高而增强。EPCs在20%和30%的Matrigel表面培养均能成管化,在10%的Matrigel表面和混悬其中培养7 d,多数细胞沉底。20%的Matrigel中培养7 d能够立体成管化。而30%的Matrigel中,EPCs仅能伸出少数突起,不能成管化。PuraMatrix在0.25%和0.5%的浓度时,EPCs培养于PuraMatrix表面与细胞混悬其中的细胞增殖率相比无明显差异;而在1%时EPCs培养于PuraMatrix表面和混悬其中存活率均很低。EPCs在0.25%和0.5%的PuraMatrix表面培养,细胞能够穿入PuraMatrix中。而在0.25%的PuraMatrix中培养细胞可附着于材料上,但较难成管化,0.5%的PuraMatrix中培养7 d能够成管化。三种细胞密度相比,107个/ml的细胞密度EPCs更容易体外成管化。结论Matrigel和PuraMatrix在适当的浓度(20%Matrigel和0.5%PuraMatrix)均能与培养细胞良好的相容,并且起到支撑作用,模拟正常生理状态,给细胞提供一个三维生长环境。由于PuraMatrix为人工合成肽产物,降解产物无毒性,可能是更适合移植的生物材料。
内皮祖细胞; 水凝胶; 生物相容性
中枢神经损伤后往往形成一个空腔,而神经再生时需要细胞替代和分化,但空腔中没有任何结构可供细胞附着。因此,使用适当的生物材料结合干细胞移植是潜在的治疗中枢神经损伤后神经再生的方式。理想的生物材料应具有无生物毒性,可生物降解,为组织重建提供一个三维立体支架,孔径可供组织重建时血管化,诱发最小的免疫反应的特性[1]。已有应用啮齿动物干细胞结合生物材料支架应用于细胞治疗神经创伤的动物实验[2-4]。但尚没有水凝胶材料的应用实验,水凝胶具有可被注入脊髓或脑损伤空腔,然后原地聚合,适应损伤空腔形状的优点。本实验检测体外诱导的内皮祖细胞(endothelial progenitor cells,EPCs)与基质胶(Matrigel)和自组装蛋白肽水凝胶 (PuraMatrix)(均为美国BD公司产品)两种水凝胶材料之间的相容性。基质胶Matrigel是Engelbreth-Holm-Swarm小鼠肉瘤细胞基底膜提取物。它的成分包括层粘连蛋白、Ⅳ型胶原、内功素、巢蛋白、肝素化硫酸盐蛋白多糖以及一些生长因子[5]。低温时为液态,但温度升高至室温即可形成凝胶[6]。GFR-Matrigel是无生长因子除TGF-beta 的Matrigel。自组装蛋白肽水凝胶PuraMatrix是一种肽合成的水凝胶,是在酵母菌蛋白中发现的与EAK16重复串联相似的离子自组装寡肽。这是一个16-mer肽按照精氨酸、丙氨酸、天冬氨酸、丙氨酸(RADARADARADARADA或RAD16)的序列重复构成的,可容纳超过99%含量的水。当暴露于单价阳离子时β-sheet结构自发的聚合起来而使水凝胶自溶解状态凝胶化[7]。已经有实验证明这种凝胶可以支持细胞增殖和附着[7]。尚没有实验检测这些水凝胶和脂肪来源EPCs的生物相容性,EPCs是一种具有自我增殖分化能力,并主要参与血管新生的细胞,适合用于细胞移植术的细胞来源。理想的生物材料应具备的性质之一就是孔径可供组织重建时血管化,为此本实验体外观察EPCs在水凝胶中是否能够成管化,为进一步动物实验做准备。
材料和方法
一、实验动物
大鼠的脂肪干细胞 (adipase derived stem cells,ADSCs)分离自近交系雄性Wistar大鼠(2月龄,体质量220~280 g)腹股沟脂肪垫。具体分离培养ADSCs并进一步诱导为骨髓源性EPCs和脊髓源性神经干细胞(neural stem cells,NSCs)的方法详见本实验室前期工作[8]。
二、实验试剂材料
本实验选择的基质胶为去生长因子的Matrigel(Becton,Dickinson and Company.Bedford,MA,USA),以期将非基质胶对EPCs的影响降到最低。另一种水凝胶为PuraMatrix(Cambridge,MA,USA)。
三、实验分组
本实验分别设Matrigel表面组 (EPCs培养于Matrigel表面)、Matrigel内部组 (EPCs于Matrigel内部立体培养)、PuraMatrix表面组 (EPCs培养于PuraMatrix表 面)、PuraMatrix内 部 组 (EPCs于PuraMatrix内部立体培养)和普通平面培养组,并根据不同检测目的又按照使用水凝胶材料的浓度或培养细胞密度进一步设立亚组。
四、实验方法
1.不同浓度水凝胶材料对EPCs的alamarBlue分析:该检测采用Matrigel表面组、Matrigel内部组、PuraMatrix表面组和PuraMatrix内部组作为实验组,以普通平面培养组为正常对照组,Matrigel的浓度分别选择10%、20%和30%,PuraMatrix的浓度分别选择0.25%、0.5%和1%。培养物中EPCs的最终细胞密度为1×106个/ml,以alamarBlue(Invitrogen,Paisley,UK)方法检测各浓度水凝胶对EPCs的细胞毒性,并于倒置显微镜下观察细胞的形态。细胞培养7 d时进行细胞毒性(细胞增殖率)检测。实验于96孔板上进行,每行为一组,每4列为同一个水凝胶浓度,即每个浓度、每组设4个孔。按照alamarBlue法的需要分别设单纯培养基组、单纯培养基+alamarBlue组、EPCs平面培养+alamarBlue组、EPCs加于 Matrigel表面+alamarBlue组、EPCs加于PuraMatrix表 面 +alamarBlue组 、EPCs混 悬 于Matrigel中+alamarBlue组和EPCs混悬于PuraMatrix中+alamarBlue组,有水凝胶材料组的每孔50 μL水凝胶之上加50 μL培养基,无水凝胶组则直接加100 μL培养基。换液时一次换2/3或3/4量液体,避免损伤水凝胶的表面结构。需培养7 d的4列先加样,2 d后需培养5 d的4列加样,依次类推,最后全部达到培养时间时,需加alamarBlue的组分别于每孔加入10 μL alamarBlue,继续培养4 h后用酶标仪在570 nm和630 nm两个波长分别测量每孔的吸光率,并使用公式计算细胞毒性/细胞增殖率。具体公式如下:

其中A为吸光率,LW为短波长即570 nm,HW为长波长即630 nm,RO为矫正参数,计算公式如下:
RO=AOLW/AOHW
其中AO是单纯培养基+alamarBlue组的吸光率减去单纯培养基组的吸光率的差值。整个实验重复3次,以得出统计分析数据。
2.EPCs和不同浓度水凝胶材料不同培养方式细胞生长情况的形态学观察:分别于培养1、3、5、7 d时用倒置显微镜观察上述各组中培养细胞的形态变化。其中由于PuraMatrix形成的水凝胶材料中可见透明条索状物质,与培养后期EPCs所形成的条索状形态难于区分,故使用Hochest33342染色法对细胞进行染色后观察,或在细胞标记了DII荧光染色剂后再行共培养,于荧光显微镜下观察,配套Leica成像系统采集图像,立体结构采用连续多层同位拍照,使用Imagepro-Plus6.0(IPP6.0)软件(USA)进行多层合并,得到立体结构的平面图。
3.不同密度EPCs于最适浓度水凝胶材料中培养情况观察:使用1×105个/ml、1×106个/ml和1× 107个/ml三个细胞密度于前述第4点中检测出的最适浓度Matrigel和PuraMatrix中混悬培养,分别进行形态学观察和alamarBlue细胞增殖的分析。具体方法同上。
4.NSCs于最适浓度水凝胶材料中培养的情况观察。将大鼠ADSCs诱导分化的NSCs的神经球接种于最适浓度Matrigel和PuraMatrix中培养,观察其生长及分化情况,并做免疫细胞化学鉴定,具体方法及抗体见本实验室前期工作[9]。
五、统计学处理
所有计量资料以均数±标准差(x±s)表示,alamarBlue的结果用两因素析因设计方差分析方法进行分析,进一步的组间的多重比较采用最小显著性差异法(least-significant difference,LSD)的方法,不同接种密度细胞的增殖能力的检测数据用单因素方差分析方法,进一步的组间的多重比较采用LSD的方法,所有数据均经SPSS13.0软件数据包处理,以P≤0.05为差异具有统计学意义。
结果
一、不同浓度水凝胶材料及不同培养方式对EPCs的alamarBlue分析
EPCs与三种浓度Matrigel共培养,Matrigel的细胞毒性随浓度增高而增大,其中30%的Matrigel内部培养细胞毒性最大,EPCs培养于Matrigel表面较混悬其中的细胞增殖率高,而且此差异随Matrigel的浓度增高而增强(表1)。本组数据中培养方式因素和Matrigel浓度因素的交互作用有显著差异(F=7.933,P=0.006),提示随Matrigel浓度的增高,EPCs在其表面培养与在其内部培养,对细胞的增殖的影响有显著差异。EPCs与3种浓度PuraMatrix共培养,细胞毒性也有随浓度增高而增大的趋势,并且也出现了表面较内部培养增殖率更高的现象 (表2)。而不同培养方式之间比较没有显著差异 (F= 0.448,P=0.516),说明EPCs培养于PuraMatrix表面或内部,对细胞的增殖没有显著影响。
二、不同浓度水凝胶材料及不同培养方式对EPCs的生长形态的影响
EPCs在10%的Matrigel的表面或内部培养均会沉降至培养板底部,生长方式类似普通平面培养(图1)。在20%和30%的Matrigel表面培养均能成管化,与常做的体外血管生成实验的方法和结果类似。在20%和30%的Matrigel内部培养,2 d以内EPCs的形态类似圆形,分散悬于Matrigel中,20% 的Matrigel中培养7 d能够立体成管化,而30%的Matrigel中,EPCs仅能伸出少数突起,不能成管化(图2)。EPCs在0.25%和0.5%的PuraMatrix表面培养,细胞能够穿入PuraMatrix中,形成在0.25%和0.5%的PuraMatrix内部培养类似的效果,而在1% PuraMatrix表面培养的EPCs则很少穿入PuraMatrix中,仅在PuraMatrix表面铺展生长。在0.25%的PuraMatrix内部培养的细胞可附着于材料上,但较难成管化,0.5%的PuraMatrix内部培养7 d能够观察到成管化现象(图3)。
三、不同密度EPCs于最适浓度水凝胶材料中培养的情况观察
根据AlamarBlue实验的结果可知20%Matrigel 和0.5%PuraMatrix是最适合EPCs生长的浓度。因此在20%Matrigel和0.5%PuraMatrix内部以1×105个/ml、1×106个/ml和1×107个/ml 3种细胞密度分别接种EPCs,观察EPCs增殖情况发现1×105个/ml的增殖情况较差,而1×106个/ml和 1×107个/ml 2种密度比较无明显差异(表3)。在20%Matrigel中EPCs以1×105个/ml、1×106个/ml和1×107个/ml 3种细胞密度接种均能够形成条索状结构,其密度随细胞接种密度增加而增加(图4)。而在0.5%PuraMatrix 中EPCs以1×105个/ml细胞密度接种时,很难形成微管状结构,1×106个/ml中可以形成条索状结构,而1×107个/ml则很容易形成,管径大小不同,并且互相交联呈网状结构(图5)。
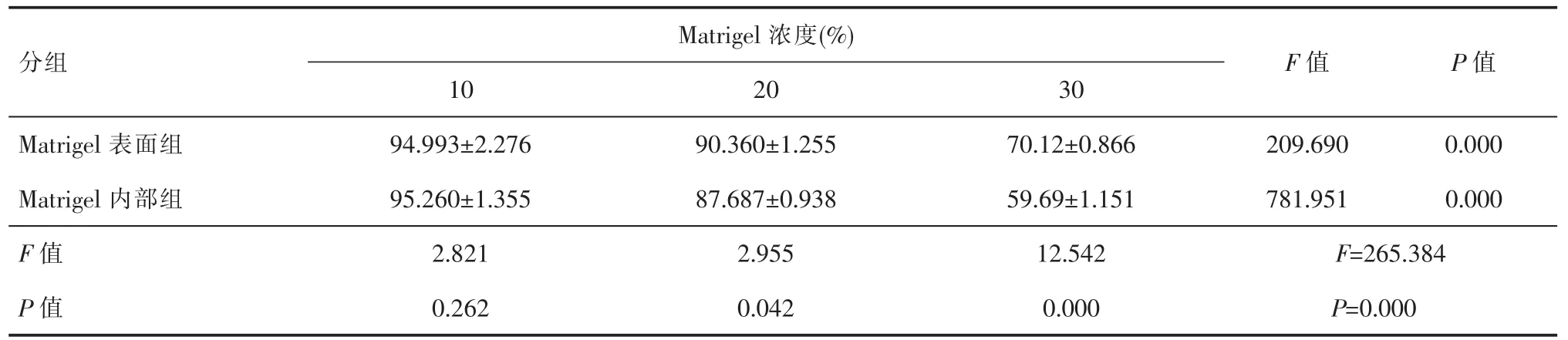
表1 Matrigel的细胞毒性(x±s,n=3)

表2 PuraMatrix的细胞毒性(x±s,n=3)

表3 20%Matrigel和0.5%PuraMatrix中的不同密度细胞的增殖情况(x±s,n=3)

图1 10%Matrigel中EPCs沉于底部,平面生长(×200)
四、NSCs于最适浓度水凝胶材料中培养的情况观察
NSCs的神经球直接接种于 20%Matrigel和0.5%PuraMatrix中,观察发现神经球中的细胞会逐渐向球外迁移,并开始长出具有分支的细胞。对培养10 d的NSCs进行免疫细胞化学染色,发现神经球局部仍有较多Nestin阳性细胞,但迁移出来的细胞具有多个较长突起的往往表达GFAP阳性,且其细胞核往往肥大,具有细长突起的细胞胞体被Neun染色,0.5%PuraMatrix中NSCs分化得更快,并且分化获得神经元样细胞更多(图6)。
讨论
生物工程是20世纪70年代初开始兴起的一门新兴的综合性应用学科,在医学领域的应用主要是以生物学的理论和技术为基础,结合现代工程技术,以生产有用代谢产物或发挥它们独特生理功能的一门新兴技术。在创伤修复方面则主要以合适的干细胞结合生物组织工程材料共移植的方式。在神经系统的修复中早期有关于啮齿类动物的干/祖细胞与聚乙交酯PGA和聚丙交酯PLA以及它们的聚合物聚乳酸-羟基乙酸共聚物 [poly(lactic-co-glycolic acid),PLGA]相容性的文章[4,10-12],但是由于PLGA是一种硬材料,使用其作为中枢神经损伤的移植材料,需将其填塞入损伤空腔,会造成2次损伤,不是理想的材料。一种理想的中枢神经组织修复的生物材料应该具有能够与干细胞混合并可注射入损伤空腔中的液体形态,一旦移植入体内则很快凝固,并构成三维支架供细胞攀附的特性。Matrigel和PuraMatrix是两款细胞相容性较好的水凝胶,近期已经有将它们的生物相容性与其他常用生物细胞支架相比较的文献[13,14],研究结果表明尽管细胞的存活率和分化能力有些许不同,但水凝胶材料和其他支架性材料具有可比性。

图2 Matrigel中细胞生长情况

图3 EPCs与PuraMatrix共培养情况

图4 EPCs以1×107个/ml密度接种于20%Matrigel中形成的网格状微管系统
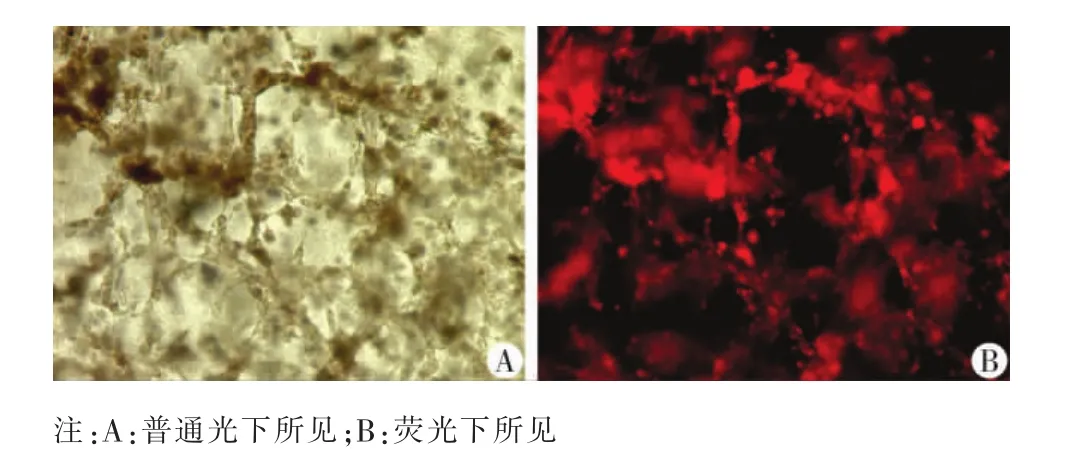
图5 EPCs以1×107个/ml密度接种于0.5%PuraMatrix中形成的网格状微管系统

图6 光镜下观察NSCs在水凝胶中培养有细胞迁移出神经球,并且细胞形态有改变,细胞伸出突起
在本次实验中EPCs与三种浓度Matrigel共培养,Matrigel的细胞毒性随浓度增高而增大,其中30%的Matrigel内部培养细胞毒性最大,EPCs培养于Matrigel表面较混悬其中的细胞增殖率高,而且此差异随Matrigel的浓度增高而增强。这个结果与Thonhoff等[9]的实验结果不完全相符,其原因可能是Thonhoff等[9]使用的Matrigel是含生长因子的,所以在其浓度增加时,虽然材料本身的细胞毒性增加,但生长因子的浓度也增加,所以在1%~10%浓度时细胞增殖率/存活率下降,但当浓度增加至50%时,细胞的增殖率/存活率反而上升。而本实验所采用的Matrigel为去除生长因子的,所以可以客观的反应出细胞毒性随材料浓度增加而增加的趋势。EPCs与三种浓度PuraMatrix共培养,细胞毒性也有随浓度增高而增大的趋势,并且也出现了表面较内部培养增殖率更高的现象。而三种浓度的PuraMatrix中1%的PuraMatrix细胞毒性较大。这与目前多数实验结果相符[13,14]。这种细胞毒性反应可能是因为材料降解所释放的毒性或酸性产物造成的。
理想的水凝胶材料除了应具有低生物毒性外,还应具有不干扰移植细胞的正常生理功能的性质。实验中EPCs在水凝胶中能够成管化,这与早期的一些实验结果一致[15-19]。在本实验中EPCs在10%的Matrigel的表面或内部培养均会沉降至培养板底部,生长方式类似普通平面培养,说明10%的Matrigel孔径过大,或粘稠度不足以使EPCs抵抗重力影响,所以虽然其细胞毒性最小,但不适于用于生物工程组织修复。而EPCs在20%和30%的Matrigel表面培养均能成管化,与常做的体外血管生成实验的方法和结果类似,说明20%和30%的Matrigel的结构较难使EPCs迁入。EPCs在20%和30%的Matrigel内部培养,2 d以内EPCs的形态类似圆形,分散悬于Matrigel中,20%的Matrigel中培养7 d能够立体成管化,而30%的Matrigel中,EPCs仅能伸出少数突起,不能成管化,说明20%的Matrigel的密度较适合EPCs在其内部成管化,而30%的Matrigel则密度过大。EPCs在0.25%和0.5% 的PuraMatrix表面培养,细胞能够穿入PuraMatrix中,形成在0.25%和0.5%的PuraMatrix内部培养类似的效果,而在1%PuraMatrix表面培养的EPCs则很少穿入PuraMatrix中,仅在PuraMatrix表面铺展生长。在0.25%的PuraMatrix内部培养的细胞可附着于材料上,但较难成管化,0.5%的PuraMatrix内部培养7 d能够观察到成管化现象,分析其原因可能是0.25%的PuraMatrix形成的支架网格孔径过大,细胞之间较难形成联系,而0.5%的PuraMatrix的孔径较合适。这与Narmoneva等[13]的研究结果不完全符合,在他们的研究中使用了自组装短肽水凝胶与大鼠脂肪组织来源的微血管ECs进行体外血管新生的生物工程研究,他们认为1%的自组装短肽水凝胶为合适的浓度,而本次实验中为0.5%的PuraMatrix,这可能是因为笔者采用PuraMatrix中氨基酸组成成分与他们所使用的短肽不同。另外成管化的时间也不同,他们的实验中16 h即可成管化,而本次的实验中2 d以内都没有明显的成管化现象,分析其原因可能是EPCs需要先分化为成熟的ECs再成管化。
理想的水凝胶材料应具备的另一个属性即不妨碍移植细胞的正常分化能力。本实验中NSCs在Matrigel中分化时,星形胶质细胞较多,而神经元较少,这与Thonhoff等[9]的实验结果类似,对于这一点他们的分析是认为Matrigel对神经元毒性较大所致,而笔者认为除此之外还有可能是因为Matrigel的微环境更利于NSCs向星形胶质细胞的方向分化,因为在用同源性的EPCs做细胞毒性实验时,20%Matrigel与0.5%PuraMatrix的细胞增殖率的数据类似,说明并不一定是因为细胞毒性的问题。另外本实验中观察到在Matrigel中分化的星形胶质细胞细胞核都较肥大,Albrecht等[20]的研究认为活化的星形胶质细胞具有肥大的细胞核,所以推测在Matrigel中分化的星形胶质细胞细胞均处于被活化的状态。由于Matrigel的成分复杂,所以尚不知是其中的一个还是数个成分导致这样的细胞形态改变。本次实验的结果与Flanagan等[21]和Katakowski等[22]的结果不同,可能是因为笔者采用的Matrigel浓度与他们不同,且采用的Matrigel不含生长因子成分。尽管检测神经系的三种重要细胞标记物是必要的,但在体外很少能够在NSCs分化后2~3周以内检测到少突胶质细胞的标记物O4,但由于水凝胶材料的降解及体外培养时每次换液都有可能造成的材料损失或稀释,导致在体外观察时间不够长,本实验在体外分化10 d,已经是目前已有研究中较长的,尚不足以观察和检测少突胶质细胞的标记物。体外诱导分化用于移植的神经元通常将NSCs培养于多聚赖氨酸和层粘连蛋白包被的培养板上,将获取的神经元嫁接入神经元缺损区域的策略[19]。而将NSCs植入水凝胶中则模拟了体内模型,但在这个实验中进行免疫细胞化学染色时,细胞损失非常大,无法进行严格的细胞数量统计。而且本实验将神经球置于水凝胶材料内部培养,模拟了正常生物组织中细胞处于细胞基质和各种支架之间的生理状态,较早期的将神经干/祖细胞置于Matrigel表面培养观察其迁移和分化的研究更有意义[20,21,23]。
因为PuraMatrix能够在相当较低的浓度凝胶化,并且对细胞毒性相对较小,所以本实验中神经球在PuraMatrix中表现出细胞迁移和接近正常比例的胶质细胞及神经元分化能力似乎是理所应当。尽管在体外培养过程中细胞迁移的距离较正常培养方式的神经球近,可能是因为PuraMatrix凝胶化后形成的纤维有一定的阻隔作用,但有理由相信在移植入体内后,由于PuraMatrix的纤维网络提供了供细胞攀附和迁移的三维支架,能够促进神经组织缺失的修补。
[1] Holmes TC,de Lacalle S,Su X,et al.Extensive neurite outgrowth and active synapse formation on self-assembling pep-tide scaffolds[J].Proc Natl Acad Sci USA,2000,97(12):6728-6733.
[2] Chen J,Zhang Z,Liu J,et al.Acellular spinal cord scaffold seeded with bone marrow stromal cells protects tissue and promotes functional recovery in spinal cord-injured rats[J].J Neurosci Res,2014,92(3):307-317.
[3] Ritfeld GJ,Nandoe Tewarie RD,Vajn K,et al.Bone marrow stromal cell-mediated tissue sparing enhances functional repair after spinal cord contusion in adult rats[J].Cell Transplant, 2012,21(7):1561-1575.
[4] Binan L,Tendey C,De Crescenzo G,et al.Differentiation of neuronal stem cells into motor neurons using electrospun poly-llactic acid/gelatin scaffold[J].Biomaterials,2014,35(2):664-674.
[5] NovikovaLN,NovikovLN,Kellerth JO.Biopolymersand biodegradable smart implants for tissue regeneration after spinal cord injury,Current opinion in neurology[J].2003,16(6):711-715.
[6] Uemura M,Refaat MM,Shinoyama M,et al.Matrigel supports survival and neuronal differentiation of grafted embryonic stem cell-derived neural precursor cells[J].J Neurosci Res,2010,88 (3):542-551.
[7] Zhang S,Holmes TC,DiPersio CM,et al.Self-complementary oligopeptide matrices support mammalian cell attachment[J]. Biomaterials,1995,16(18):1385-1393.
[8] Yan Y,Liu Y,Liu D,et al.Dif-ferentiation of adipose-derived adult stem cells into epithelial-like stem cells[J].Ann Anat, 2013,195(3):212-218.
[9] Thonhoff JR,Lou DI,Jordan PM,et al.Compatibility of human fetal neural stem cells with hydrogel biomaterials in vitro[J]. Brain Res,2008,1187(6):42-51.
[10] Nectow AR,MarraKG,Kaplan DL.Biomaterialsforthe development of peripheral nerve guidance conduits[J].Tissue Eng Part B Rev,2011,18(1):40-50.
[11] Quigley AF,Bulluss KJ,Kyratzis IL,et al.Engineering a multimodal nerve conduit for repair of injured peripheral nerve [J].J Neural Eng,2013,10(1):016008.
[12] Ouyang Y,Huang C,Zhu Y,et al.Fabrication of seamless electrospun collagen/plga conduits whose walls comprise highly longitu-dinal aligned nanofibers for nerve regeneration[J].J Biomed Nanotechnol,2013,9(6):931-943.
[13] Narmoneva DA,Oni O,Sieminski AL,et al.Self-assembling shortoligopeptidesand the promotion ofangiogenesis[J]. Biomaterials,2005,26(23):4837-4846.
[14] Cavalcanti BN,Zeitlin BD,Nör JE.A hydrogel scaffold that maintains viability and supports differentiation of dental pulp stem cells[J].Dental Mater,2013,29(1):97-102.
[15] Aizawa Y,Shoichet MS.The role of endothelial cells in the retinal stem and progenitor cell niche within a 3d engineered hydrogel matrix[J].Biomaterials,2012,33(21):5198-5205.
[16] Sakai S,Inagaki H,Liu Y,et al.Rapidly serum-degradable hydrogel templating fabrication of spherical tissues and curved tubular structures[J].Biotechnol Bioeng,2012,109(11):2911-2919.
[17] Sun G,Shen YI,Kusuma S,et al.Functional neovascularization of biodegradable dextran hy-drogels with multiple angiogenic growth factors[J].Biomaterials,2011,32(1):95-106.
[18] Du Y,Ghodousi M,Qi H,et al.Sequential assembly of cellladen hydrogel constructs to engineer vascular-like microchannels[J].Biotechnol Bioeng,2011,108(7):1693-1703.
[19] Panorchan P,Lee JS,Kole TP,et al.Microrheology and rock signaling of human endothelial cells embedded in a 3d matrix[J]. Biophys J,2006,91(9):3499-3507.
[20] Albrecht PJ,Dahl JP,Stoltzfus OK,et al.Ciliary neurotrophic factor activates spinal cord astrocytes, stimulating their production and release of fibroblast growth factor-2,to increase motor neuron survival[J].Exp Neurol,2002,173(1):46-62.
[21] Flanagan LA,Rebaza LM,Derzic S,et al.Regulation of human neural precursor cells by laminin and integrins[J].J Neurosci Res,2006,83(5):845-856.
[22] Katakowski M,Zhang Z,deCarvalho AC,et al.EphB2 induces proliferation and promotes a neuronal fate in adult subventricular neural precursor cells[J].Neurosci Lett,2005,385(3):204-209.
[23] Wu P,Tarasenko YI,Gu Y,et al.Region-specific generation of cholinergic neurons from fetal human neural stem cells grafted in adult rat[J].Nat Neurosci,2002,5(12):1271-1278.
Compatibility of rodent epithelial progenitor cells with biomaterial hydrogels in vitro
Xue Shan1, Wu Gang2,Luo Shiyu3,Zhang Peng4,Zhang Hongtian4,Fa Zhiqiang1,Guo Yanwu1,Ke Yiquan1,Xu Ruxiang4.1Department of Neurosurgery,Neurosurgery Institute,Key Laboratory on Brain Function Repair and Regeneration of Guangdong Province,Zhujiang Hospital of Southern Medical University, Guangzhou 510282,China;2Department of Oncology,Zhujiang Hospital of Southern Medical University, Guangzhou 510282,China;3Second Clinical College of Southern Medical University,Guangzhou 510282, China;4The Affiliated Bayi Brain Hospital,The Military General Hospital of Beijing PLA,Beijing 100700,China
Xu Ruxiang,Email:zjxuruxiang@163.com
ObjectiveTo test the interaction of in vitro cultured cells and biological engineering hydrogel materials,providing theoretical basis for the treatment strategy of in vitro culturedcells and biological engin eering hydrogel transplantation.MethodsTwo different components hydrogel Matrigel and PuraMatrix were used as experimental material,and EPCs derived as previous method used as detecting cells.At different concentrations of Matrigel(10%,20%,30%)or PuraMatrix (1%,0.5%,0.25%),EPCs were cultivated on surface or within the hydrogels.Observe the morphology and detect cell proliferation by Alamar Blue method in different time to determine the cytotoxicity of hydrogel materials.Observe the in vitro angiogenesis ability of EPCs to detect whether cells still have physiological function.Resultsthree concentrations of Matrigel,30%Matrigel is highest cytotoxicity. Among three PuraMatrix concentration,1%PuraMatrix is highest cytotoxicity.The cell proliferation rate of EPCs training on surface of Matrigel is high than suspension in Matrigel,and the difference between these two training mode enhanced while the concentration of Matrigel increased.The in vitro angiogenesis ability of EPCs was observed on 20%and 30%Matrigel surface.EPCs descended to the bottom when cultured in or on surface of 10%Matrigel 7 days.The in vitro angiogenesis ability of EPCs was observed in 20%Matrigel,but in 30%Matrigel,EPCs only stretch minority pustute.The cell proliferation rates were no significant differences when EPCs training on surface of or in 0.25%and 0.5%PuraMatrix.But when EPCs training on surface of or in 1%PuraMatrix,the survival rate of cell is very low.EPCs can migrat in 0.25%and 0.5%PuraMatrix when cultured on surface.But in 0.25% PuraMatrix,EPCs attached to the material,but had difficult to perform in vitro angiogenesis.The in vitro angiogenesis ability of EPCs was observed in 0.5%PuraMatrix.Among three densitys of EPCs,density of 107cell/ml in vitro angiogenesis are more easily.In the hydrogel.ConclusionMatrigel and PuraMatrix in the appropriate concentration (20%)and 0.5%have good compatibility with EPCs and NSCs,and can serve as support,imitate physiological condition,to provide a three-dimensional cell growth environment,non-toxic degradation products,may be more suitable for transplantation treatment.
Endothelial progenitor cells; Hydrogel;Biocompatibility
2015-07-10)
(本文编辑:张丽)
10.3877/cma.j.issn.2095-9141.2015.06.008
国家自然科学基金(u0632008、30801184、30772232、30500526、81501046)广东省自然科学基金(S2011040003565)
510282广州,南方医科大学珠江医院神经外科,神经外科研究所1;广东省脑功能修复和再生重点实验室南方医科大学珠江医院肿瘤中心2;南方医科大学第二临床学院3;100700北京,北京军区总医院附属八一脑科医院4
徐如祥,Email:zjxuruxiang@163.com
薛杉,吴钢,罗诗雨,等.啮齿动物上皮祖细胞与生物材料水凝胶生物相容性的体外研究[J/CD].中华神经创伤外科电子杂志,2015,1(6):346-353.

