脑干海绵状血管瘤的特征性分析
陈立华 李文德 徐如祥
·专题笔谈·
脑干海绵状血管瘤的特征性分析
陈立华 李文德 徐如祥
脑干海绵状血管瘤(BSCM)为先天性脑血管畸形之一,多数发生于桥脑,其次在中脑,延髓少见。BSCM发病率较低,但由于其位置深在,周围均为重要的神经核团和神经束,易反复出血,可引起严重后果,甚至死亡,危险性极大。显微神经外科手术是BSCM唯一的根治方法。本文就BSCM的流行病学、组织病理、临床表现、影像学、治疗等方面进行综述分析。
脑干海绵状血管瘤; 显微神经外科手术; 肿瘤
一、流行病学特点
脑干海绵状血管瘤 (brain stem cavernous malformations,BSCM)的病因和自然转归迄今了解不多,同时病变部位深,周围均为重要结构,手术困难,可能引起严重并发症,甚至死亡。BSCM比位于幕上病灶更容易发生瘤内出血,更具有危险性[1]。出血概率是幕上病灶的20~30倍,瘤内急性出血或缓慢渗血,瘤体增大可压迫脑干内核团和传导束,引起后组颅神经障碍、肢体瘫痪等神经功能缺失。
发生率:颅内海绵状血管瘤发病率为0.4%~0.6%,BSCM是颅内海绵状血管瘤的特殊类型,约占颅内海绵状血管瘤的9%~35%[2]。Kupersmith等[3]报道大约18%~35%的颅内海绵状血管瘤位于脑干。
绝大多数BSCM是偶发和孤立的[4]。然而,多发性海绵状血管瘤高达24%;约14%的患者有家族史[5],具有不完全性显性遗传特性。
发生部位:中脑、桥脑及延髓均可被累及,但最常发生于桥脑,其次是中脑,单纯发生于延髓者最少[2]。文献报道发生于桥脑的BCM约占57%~65%,其次为中脑,约占14%,延髓约占12%。Samii等[6]报道57%的BSCM位于桥脑,其次是中脑(占14%),桥-延交界处(占12%),发生于延髓的BSCM最少,只占5%。Chen等[7]报道38例BSCM,其中发生于桥脑23例(占60.%),发生于中脑(包括中脑-间脑)9例(占23.7%),延髓6例(15.8%)。Garcia等[8]报道104例BSCM,肿瘤位于桥脑占61.0%,中脑20%,延髓占19%。
大多数BSCM为散发和单发,但仍有高达24%的病例为多发病灶,且均表现为较差的功能预后;另有报道约14%的病例有家族史。
二、组织病理特点
BSCM是一种先天性低流量的隐匿性血管病变,与毛细血管扩张和静脉发育不良有关。这一类型血管瘤并非为“静止性”病变,而是动态变化的病理过程,肿瘤反复出血、机化、胶质增生或毛细血管的“茅生”作用而进行性增大,其血管内皮细胞活跃分裂、不断增殖,提示需要手术直接切除病变来有效避免再出血。肿瘤的生长可能与反复的薄壁血管破裂出血,出血腔反复的上皮化及作为血肿机化一部分的新血管生长、纤维疤痕组织的生成有关。海绵状血管瘤无完整的供血动脉及引流静脉是其与动静脉畸形的区别之处。
光镜下瘤体由许多窦状扩张的血管腔组成,管壁只有内皮细胞,缺乏弹力纤维和平滑肌,因而血管脆性很大;肿瘤反复出血时,可具有一些复合性的病理改变,如纤维疤痕形成及不同时期出血,相邻脑组织可见胶质增生,含铁血黄素沉积及微小血管机化,甚至钙化[9]。较新鲜出血的区域周围可见到含有薄壁血管的增生组织,而很陈旧的病灶可由含脑脊液或干涸的窦腔构成。扩张的血管之间不夹杂正常脑实质,这点是与毛细血管扩张症区别的基本特征,也是诊断海绵状血管瘤所必需的。电镜及免疫组化研究发现:海绵状血管瘤血管腔周围缺乏血管外膜细胞和星形细胞突起的包绕,基膜嵌在致密的胶原纤维基质中。除此之外,内皮细胞之间的紧密连接不完整,细胞间空隙较大。推测正是由于缺乏了这些正常血管的重要结构,造成了海绵状血管瘤血-脑屏障的不完善,导致血细胞慢性渗出,病变周围含铁血黄色沉积,以及血管腔内血栓形成。
三、年出血率和再出血
BSCM由于其血管壁的不稳定性常常反复破裂出血。BSCM扩张的毛细血管内压力低及管壁薄弱的病理学基础,导致BSCM反复发生小量的出血。出血事件定义为突发或进行性加重的神经功能障碍,影像学检查显示瘤体内或外的急性或亚急性出血。文献报道的BSCM的年出血率和再出血率差异很大 (表1),综合文献统计显示:分别为0.6%~6%和5.1%~60%。相关文献结果偏差的原因在于许多观察病例均局限于大型医疗中心,即病例来源具有选择性,因此统计结果无法真实反映BSCM的病程与转归。由于无法判断新发病变的出现时间,大部分回顾性研究所报道的出血率均建立在病变产生于出生时的前提下。未将新发的病变考虑在内,这些研究得出的出血率可能比实际低。其次,各种关于BSCM自然病史的研究均有内在的选择偏倚,进行手术的病例报道均是建立在已经因出血产生临床症状和被送至医院准备手术的患者基础之上,有出血事件但是未产生临床症状的患者并未考虑在内。因此,出血率很难精确计算。年出血率从0.6%~10.6%不等,首次出血后年再出血率可高达5%~30%[4,6,10,11,12]。
Porter等[4]总结100例BSCM的临床资料,认为BSCM出血后,更易发生再次出血,年出血率和再出血率分别为5%和30%。研究还显示第2次出血后,再出血的平均间隔时间为5个月,月出血率可达8%。Kondziolka等[1]等报道了脑干海绵状血管瘤在未破裂出血人群中的年出血率是0.6%,有出血史人群中的年出血率是4.5%,且易导致严重神经功能缺失,因此主张任何部位的海绵状血管瘤一旦发生再出血,均应考虑手术治疗。Gross等[10]回顾性总结分析文献报道的BSCM,其中12组BSCM自然病程组中,其再出血率高达21.5%/年。Fritschi[2]报道年平均出血率为2.7%,再出血率为21%,然而出血的间期不可预测,也是多变的。每一次出血造成永久性神经功能障碍的风险也随之增加[13],出血后术前发生的神经功能障碍完全恢复的机率减少。年龄超过35岁、>10 mm有更高的年出血率[3]。文献报道女性有较高的再出血率,这可能与激素水平有关[5,14]。(见表1。)
四、临床表现
1.临床症状产生的病理机制。BSCM属于良性病变,其生长或出血会对周围的神经核团或通路产生推挤、压迫,血细胞崩解成分如含铁血黄素等也会对周围脑组织产生化学损伤,这是BSCM出现临床症状的主要原因。BSCM不同于其它部位的海绵状血管瘤,出血后可能引起灾难性神经功能损害[17],瘤体增大可压迫脑干内核团和传导束,导致临床症状进行性加重。这是由于脑干内存在上下行神经传导束和脑神经核等重要的结构,既使是少量出也有可能是可怕的事件[18]。
2.临床表现特点。病程:自然病程不清楚。从出现临床症状到诊断明确,病程数天到数月不等。好发年龄:可发生于任何年龄,好发于中青年,多见于20~50岁患者。Chen等[7]报道38例BSCM,平均发病年龄为36.2岁(15~61岁)。发作形式和病程:常因瘤内出血而急性发病,缓慢发病少见。根据出血快慢和出血量可有几种不同的病程:大多数患者表现急性出血,常导致突然发病,经过治疗出血吸收后症状有不同程度缓解,临床症状的改善可能是由于腔内积血的吸收,再出血时症状再次加重;反复多次少量出血而呈亚急性起病;另一种是病灶内缓慢渗血可使病灶逐渐增大,仅极少数患者呈缓慢起病、逐渐加重。
BSCM出血事件很少是无症状的,然而在绝大多数病例,BSCM出血不会造成严重的运动功能和意识障碍,多数表现为眼部症状[6]。Menon等[19]报道52例BSCM,94.2%表现为颅神经功能障碍者,48.1%的患者有轻偏瘫,无一例有意识障碍。Chen等[7]报道65.8%的病例表现为颅神经功能障碍。
与高血压、动静脉畸形和肿瘤引起的脑干出血不同,脑干海绵状血管瘤的出血量较少且较缓慢,很少形成大的血肿,造成致命的损害,临床上多因反复出血,或出现脑干受压症状而就诊。
3.典型临床表现。BSCM出血是患者就诊的主要原因,出血量的多少及出血速度可能是影响病程和临床症状的主要因素。最常见的神经功能障碍是Ⅵ和Ⅶ颅神经功能障碍。
症状与年龄的关系:成年患者最常见的症状和体征是一侧肢体突然麻木、行走不稳、头晕、头痛、颅神经功能障碍、长束征和小脑征。儿童患者多以病理性哭闹为主要临床表现,也有部分患者没有任何症状偶然发现。偏瘫及偏身感觉障碍、脑神经损伤及共济失调是最常见的三大体征。
症状与部位的关系:脑干海绵状血管瘤的临床表现因病灶位置不同而不同。位于中脑的病灶更容易影响到第3和第4对脑神经,颅内压增高明显,还会出现红核震颤、不自主发笑、发作性意识障碍等中脑所特有的表现;头痛、恶心、意识障碍是中脑BSCM出血最常的症状,通常与导水管受压引起梗阻性脑积水有关[6]。病变位于脑桥,部分患者会出现同向凝视障碍;而延髓病变者,顽固性呃逆、吞咽困难具有相对特异性。桥脑BSCM出血典型的症状是Ⅴ,Ⅶ和Ⅷ颅神经损害症状。位于延髓的病变表现为呃逆、吞咽困难和声带麻痹。心血管和呼吸系统的不稳定、顽固性呃逆、消化道出血是延髓BSCM出血常见的症状[5]。
五、影像学特点
1.CT表现。BSCM具有反复少量出血的特点,病灶内血肿机化、囊性变等改变。不同时期的BSCM其CT表现不一。急性期表现为出血灶;亚急性和慢性期CT表现为等或稍高密度出血占位征象。增强CT扫描,病灶表现为轻至中度强化。水肿及占位效应均不明显。桥脑-中脑交界区的BSCM,有报道约75%的病例在影像学诊断前有多次出血史[3]。而且,再出血神经功能障碍比第1次出血会更严重[20]。
2.MRI特征性表现。典型的MRI表现为分叶状或“桑葚状”,呈低信号环围绕的“爆米花”或“桑椹”样混杂信号的结节影,周围有明显的低信号含铁血黄素沉积环。由于几乎所有的病灶周围均有含铁血黄素胶质增生带形成,在T2加权像上可清晰显示病灶周围包绕低信号环,由血栓和反复出血引起的细胞外正铁血红蛋白造成。此为BSCM具有诊断价值的特征性影像学表现,反复的血栓形成和出血后含铁血黄素的沉积和钙化是其病理基础。脑干海绵状血管瘤影像学表现与病程长短及组织病理学改变有关,MRI表现主要与病灶内血液成份变化有关,出血的不同时期,MRI表现也不同。出血急性期可表现为T1加权像呈等信号或稍低信号,T2加权像高信号;亚急性期MRI表现主要与病灶内血液成份变化有关,由于脱氧血红蛋白转变为正铁血红蛋白,转变成T1和T2均为高信号,周围通常环绕有不规则的低信号带为含铁血黄素沉积而形成,病灶周围水肿多不明显;慢性期MRI表现主要与反复出血、不同时期的血液成份混杂及胶质增生有关,T1及T2像表现为混杂信号,增强扫描轻度强化或无增强。壳样或网状低信号是含铁血黄素环的特征,有别于血管流空影造成的低信号多显示为分枝样结构。
弥散张量成像(diffusion tensor imaging,DTI)和神经纤维束示踪技术可明确肿瘤与锥体束之间的位置关系。术前DTI可定位皮质脊髓束,明确皮质脊髓束与BSCM之间的位置在关系,有助于术前选择手术入路和预测运动功能术后水平[7,21]。既使脑干内有占位性病灶,DTI也能精确、清晰地、可视化地定位脑干内的白质纤维束[22]。Kashimura等[23]报道了1例BSCM应用三维各向异性对比成像技术 (3-DAC),在3-DAC图像上可清晰地显示病变将左侧皮质脊髓束和皮质脑干束向后内侧挤压。因而选择经脑桥前外侧切除病变,术后3-DAC图像显示皮质脊髓束和皮质脑干束保留完好。
病灶边缘可凸出脑干表面,但很少见出血破入第4脑室或脑干周围脑池。主要原因是海绵状血管瘤出血大多与静脉栓塞有关,由于BSCM病灶内出血压力低,出血造成的压力较小。因此,罕见出血破入第4脑室或破入蛛网膜下腔[24]。其次是脑干内有较致密的上、下行及横行纤维束,限制血肿的张力性扩散。
3.肿瘤大小。BSCM具有反复出血的特点,肿瘤内部或周边多夹杂机化或新鲜血肿及增生的胶质组织。因此,MRI无法确切反映肿瘤实际大小。一般采用T1加权像上包含血肿在内的总体病变大小进行测量,病灶直径一般在1~2 cm之间,也有报道达3~4 cm。Garcia等[8]报道104例BSCM,肿瘤平均最大直径为19.5 mm。Chen等[7]报道的38例BSCM大小在4~21 mm之间,中脑平均 13 mm,桥脑平均 15 mm,桥脑肿瘤平均11 mm大小。
4.伴发异常发育的畸形静脉。BSCM周围常常伴有异常发育的静脉畸形[2],畸形静脉担负着脑干重要结构的引流,术前MR可见“水母头样”改变。Garcia等[8]报道104例BSCM,54.8%存在发育性静脉异常。Fritschi等[2]报道BSCM伴异常静脉畸形的发生率为8%。Menon等[19]报道伴发发静脉畸形的比例为3.8%。术中如发现病灶周围有异常发育性引流静脉,应尽可能保护伴行的异常静脉,否则极易引起静脉性梗死,加重术后脑干水肿,甚至导致严重的神经功能废损[25]。异常发肓静脉影响手术入路的选择,也影响肿瘤的全切除[16]。
5.乏血管肿瘤的特点:(1)CT和MRI表现为轻度增强;(2)海绵状血管瘤在数字减影血管造影上无明显特异性发现,多表现为无特征的乏血管病变,很少能见到供血动脉及引流静脉。
六、疗效分析
BSCM反复急性出血或缓慢渗血致血管瘤体积增大,从而压迫脑干内的神经核团及传导束,引起脑神经障碍、肢体瘫痪等神经功能缺失,如不及时采取显微手术切除,患者可因血管瘤再次出血或多次出血以及神经功能障碍加重。手术切除病灶可起到减压作用,缓解症状和改善神经功能;同时也是根治的唯一方法。虽然脑干海绵状血管瘤的手术风险很大,但是成功全切病灶能够使出血事件不再发生,从而使患者得到治愈。
1.肿瘤全切除率。肿瘤全切除率可达92%~98%。Ohue 等[16]报告 36例BSCM,33例肿瘤全切除,肿瘤全切除率为91.7%。Ramina等[26]报道肿瘤全切除率为97%。Chen等[7]报道肿瘤全切除率为94.7%,只有中脑腹侧一例未能做到全切除。通常中脑腹侧被双侧大脑脚包围,操作空间狭小,手术操作难度较大。因此,中脑腹侧或腹外侧的BSCM的全切率最低。Gross等[27]综合文献报道的1 390例BSCM,肿瘤全切除达到91%。Gross等[10]回顾性分析文献报道的821例BSCM (1970~2008),手术组745例,全切除684列,占92%。桥脑腹外侧的BSCM通常有更好的愈后,而经四脑室底入路的病例远期疗效相对较差。
2.术后神经功能状态。文献报道显示BSCM术后症状加重或出现新的神经功能障碍者通常在15%~30%之间,且多数在随访中能得到恢复或改善,永久性功能障碍者较少(表2)。Samii等[6]认为术前卡氏行为表现状态评分高(Karnofsky performance status,KPS),预后较好,手术致残率明显低于因反复出血导致的神经功能障碍。Ferroli等[15]报道52例BSCM,42(80.8%)例术后功能改善或稳定。Ohue等[16]报道的一组BSCM,术后92%的病例功能改善或未变化,只有8%(3例)术后功能恶化。Dukatz等[28]分析71例BSCM术后的生活质量,62%患者术后KPS评分升高,27%保持不变,11%患者降低,患者术后精神健康改善明显,82%的患者自诉术后症状得到很大改善。早期手术患者的神经功能恢复优于中、晚期手术患者,同时,出血次数也与本病预后关系密切。术后常出现原有神经功能障碍的加重或出现新的症状,如新的脑神经功能障碍、周围性面瘫、眼球协调运动障碍、肢体瘫痪等,这与手术损伤、牵拉、局部水肿等有关,多数患者的症状在随访中逐渐恢复至正常或遗留轻微障碍。Tarnaris等[29]复习15年文献报道的BSCM,得出手术治疗后,87%的病例术后长期随防的神经功能恢复良好,只有12.9%的病例术后神经功能恶化或下降。Gross等[27]综合文献报道的1 390例BSCM,发现早期致残率高达45%,长期永久性致残率为14%,术后功能稳定或好转率为84%。Gross等[10]回顾性分析文献报道的821例BSCM(1970~2008),手术组745例,术后功能好转或稳定者占85%,手术相关死亡12例,占1.9%。桥脑腹外侧的BSCM通常有更好预愈后,而经四脑室底入路的病例远期疗效相对较差。Porter等[4]报道非手术治疗组远期预后明显要比手术组要差,预后不良率分别为42%、9%(表2)。
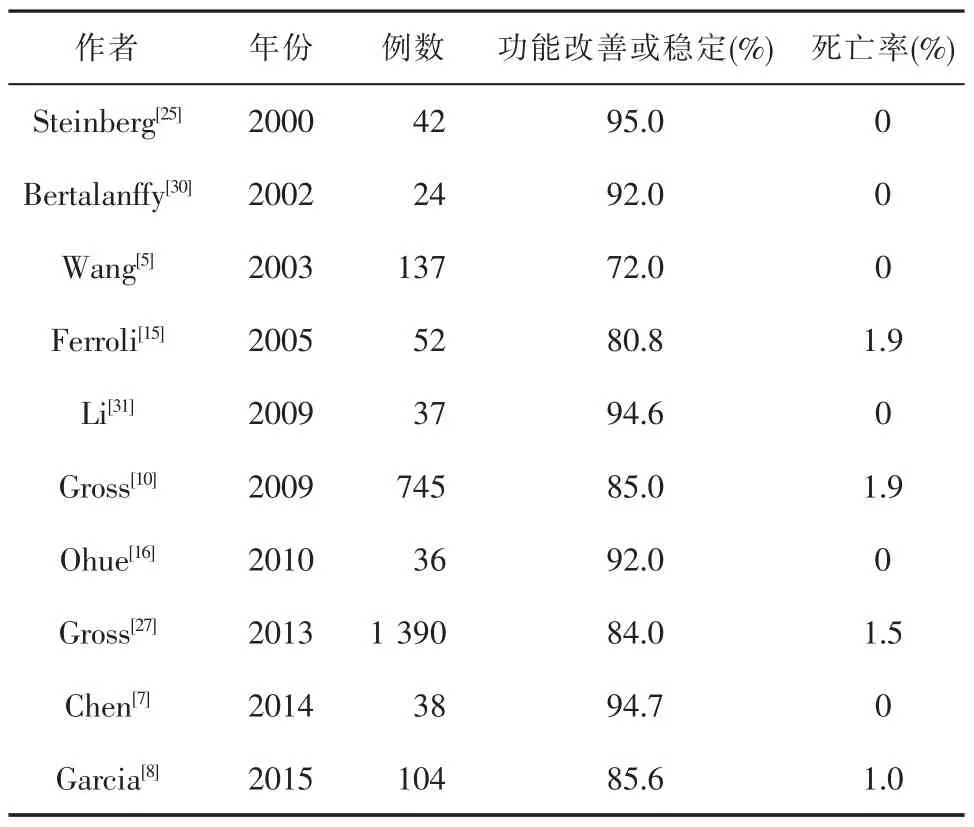
表2 BSCM手术疗效总结
3.并发症
文献报道手术后严重并发症发生率约12.0%~14.5%,其余约23%的并发症为一过性,可治愈[4,33]。术中准确定位病灶及病灶周围的重要结构,严格循安全三角进入,有助于减少术后并发症。Li等[31]报道术后出现并发症的发生率为46.3%,26.9%为永久性并发症。另外,术后6例发生8次再出血,术后年再出血率为0.5%。Sola等[33]报道术后新增颅神经功能障碍的发生率为25%。术后新增颅神经功能障碍或神经功能障碍恶化通常是暂时性的,是由术后微循环障碍或周围结构的水肿造成的[34-35]。
总之,充分认识脑干海绵状血管瘤的流行病学特点和临床特征,有助于个体化掌握手术适应证和个体化地选择显微手术入路,这是手术成功的重要保证。
[1] Kondziolka D,Lunsford LD,Kestle JR.The natural history of cerebral cavernous malformation[J].J Neurosurg,1995,83(5):820-824.
[2] FritschiJA,Reulen HJ,SpetzlerRF,etal.Cavernous malformations of the brain stem.A review of 139 cases[J].Acta Neurochir(Wien),1994,130(1-4):35-46.
[3] Kupersmith MJ,Kalish H,Epstein F,et al.Natural history of brainstem cavernous malformations[J].Neurosurgery,2001,48(1):47-54.
[4] PorterRW,DetwilerPW,SpetzlerRF,etal.Cavernous malformations of the brainstem:experience with 100 patients[J]. J Neurosurg,1999,90(1):50-58.
[5] Wang CC,Liu A,Zhang JT,et al.Surgical management of brainstem cavernous malformations:report of 137 cases[J].Surg Neurol, 2003,59(6):444-454.
[6] Samii M,Eghbal R,Carvalho GA,et al.Surgical management of brainstem cavernomas[J].J Neurosurg,2001,95(5):825-832.
[7] Chen LH,Zhang HT,Chen L,et al.Minimally invasive resection of brainstem cavernous malformations:Surgical approaches and clinical experiences with 38 patients[J].Clin Neurol Neurosurg, 2014,116:72-79.
[8] Garcia RM,Ivan ME,Lawton MT.Brainstem cavernous malformations:surgical results in 104 patients and a proposed grading system to predict neurological outcomes[J].Neurosurgery, 2015,76(3):265-277.
[9] Albanese A,Sturiale CL,D'Alessandris QG,et al.Calcified extra-axial cavernoma involving lower cranial nerves:technical case report[J].Neurosurgery,2009,64(3 Suppl):onsE135-136.
[10] Gross BA,Batjer HH,Awad IA,et al.Brainstem cavernous malformations[J].Neurosurgery,2009,64(5):E805-E818.
[11] Simard JM,Garcia-BengocheaF,BallingerWE Jr,etal. Cavernous angioma:a review of 126 collected and 12 new clinical cases[J].Neurosurgery,1986,18(2):162-172.
[12] Porter PJ,Willinsky RA,Harper W,et al.Cerebral cavernous malformations:natural history and prognosis after clinical deterioration with or without hemorrhage[J].J Neurosurg,1997, 87(2):190-197.
[13] Ciurea AV,NastaseC,Tascu A,etal.Lethalrecurrent hemorrhages of a brainstem cavernoma[J].Neurosurg Rev,2007, 30(3):259-262.
[14] Cantore G,Missori P,Santoro A.Cavernous angiomas of the brain stem.Intra-axial anatomical pitfalls and surgical strategies [J].Surg Neurol,1999,52(1):84-94.
[15] Ferroli P,Sinisi M,Franzini A,et al.Brainstem cavernomas:longterm resultsofmicrosurgicalresection in 52 patients[J]. Neurosurgery,2005,56(6):1203-1212.
[16] Ohue S,Fukushima T,Kumon Y,et al.Surgical management of brainstem cavernomas:selection of approaches and microsurgical techniques[J].Neurosurg Rev,2010,33(3):315-324.
[17] Viñas FC,Gordon V,Guthikonda M,et al.Surgical management of cavernous malformations of the brainstem[J].Neurol Res, 2002,24(1):61-72.
[18] Pozzati E,Giuliani G,Nuzzo G,et al.The growth of cerebral cavernous angiomas[J].Neurosurgery,1989,25(1):92-97.
[19] Menon G,Gopalakrishnan CV,RaoBR,etal.A single institution series of cavernomas of the brainstem [J].J Clin Neurosci,2011,18(9):1210-1214.
[20] Mathiesen T,Edner G,Kihlstrom L.Deep and brainstem cavernomas:a consecutive 8-year series[J].J Neurosurg,2003, 99(1):31-37.
[21] McLaughlin N,KellyDF.Corticospinaltractographyasa prognosticator for motor improvement after brainstem cavernoma resection[J].Br J Neurosurg,2013,27(1):108-110.
[22] Ulrich NH,Kockro RA,Bellut D,et al.Brainstem cavernoma surgery with the support of pre-and postoperative diffusion tensor imaging:initial experiences and clinical course of 23 patients[J]. Neurosurg Rev,2014,37(3):481-492.
[23] Kashimura H,Inoue T,Ogasawara K,et al.Pontine cavernous angioma resected using the subtemporal,anterior transpetrosal approach determined using three-dimensional anisotropy contrast iimaging:technical case report [J].Neurosurgery,2006,58(1 Suppl):ONS-E175.
[24] Zimmerman RS,SpetzlerRF,Lee KS,etal.Cavernous malformations of the brainstem[J].J Neurosurg,1991,75(1):32-39.
[25] Steinberg GK,Chang SD,Gewirtz RJ,et al.Microsurgical resection of brain stem, thalamic, and basal ganglia angiographically occult vascular malformations[J].Neurosurgery, 2000,46(2):260-271.
[26] Ramina R,Mattei TA,de Aguiar PH,et al.Surgical management of brainstem cavernous malformations[J].Neurol Sci,2011,32(6):1013-1028.
[27] Gross BA,Batjer HH,Awad IA,et al.Brainstem cavernous malformations:1390 surgical cases from the literature[J].World Neurosurg,2013,80(1-2):89-93.
[28] Dukatz T,Sarnthein J,Sitter H,et al.Quality of life after brainstem cavernoma surgery in 71 patients[J].Neurosurgery, 2011,69(3):689-695.
[29] Tarnaris A,Fernandes RP,Kitchen ND.Does conservative management for brain stem cavernomas have better long-term outcome?[J].Br J Neurosurg,2008,22(6):748-757.
[30] Bertalanffy H,Benes L,Miyazawa T,et al.Cerebral cavernomas in the adult.Review of the literature and analysis of 72 surgically treated patients[J].Neurosurg Rev,2002,25(1-2):1-53.
[31] Li H,Ju Y,Cai BW,et al.Experience of microsurgical treatment of brainstem cavernomas:report of 37 cases[J].Neurol India, 2009,57(3):269-273.
[32] Amin-Hanjani S,Ogilvy CS,Ojemann RG,et al.Risks of surgical management for cavernous malformations of the nervous system[J].Neurosurgery,1998,42(6):1220-1228.
[33] Sola RG,Pulido P,Pastor J,et al.Surgical treatment of symptomatic cavernous malformations of the brainstem[J].Acta Neurochir(Wien),2007,149(5):463-470.
[34] Li D,Hao SY,Jia GJ,et al.Hemorrhage risks and functional outcomes of untreated brainstem cavernous malformations[J].J Neurosurg,2014,121(1):32-41.
[35] Li D,Hao SY,Tang J,et al.Clinical course of untreated pediatric brainstem cavernous malformations:hemorrhage risk and functional recovery[J].J Neurosurg Pediatr,2014,13(5):471-483.
Characteristic analysis of brainstem carernous hemangioma
Chen Lihua,Li Wende,Xu Ruxiang. The Affiliated Bayi Brain Hospital the Military General Hospital of Beijing PLA,Beijing 100700,China Corresponding author:Xu Ruxiang,Email:zjxuruxiang@163.com
Brain stem cavernous malformation (BSCM)is a kind of congenital vascular malformation.It mostly occurs in the region of pons,then midbrain but rarely medulla.BSCM can lead to many severe clinical consequences,sometimes even including death,due to its features of deep location, repeated hemorrhage and adjacency to important central neural structures.Microneurosurgery is the only effective way for the radical resection of BSCM.The characteristics of its epidemiology,pathology, clinical outcome,radiography and treatment were reviewed in this literature.
Brain stem cavernous malformation; Microneurosurgery; Tumour
?
2015-08-05)
(本文编辑:张丽)
10.3877/cma.j.issn.2095-9141.2015.06.011
100700北京,北京军区总医院八一脑科医院
徐如祥,Email:zjxuruxiang@163.com
陈立华,李文德,徐如祥.脑干海绵状血管瘤的特征性分析[J/CD].中华神经创伤外科电子杂志,2015,1(6):361-365.

