不同消化时间对原代心肌细胞的影响
屈双丽,杨晓敏
0 引 言
原代心肌细胞培养是一项重要的体外实验技术,其为建造心血管疾病发生发展过程的模型及探讨基因、蛋白质及信号通路的变化提供重要的基础保障。此外,在体内心肌细胞的活动受到神经、体液等多方因素的影响,限制对其病理变化的过程的研究。而体外培养的原代心肌细胞不仅具有心肌细胞固有的活性,而且还有不受神经、体液等因素的影响的可控制性。因此,原代心肌细胞培养的好坏,是影响实验的结果的关键因素之一。本研究通过比较不同消化时间对原代心肌细胞的影响,探讨一套简便易行、成活率高的原代心肌细胞培养方法。
1 材料与方法
1.1 实验动物 选择出生1 ~2 d 的Wistar 大鼠,清洁级,雌雄不限,由内蒙古大学动物研究中心提供,合格证编号:csxk(蒙)2002-0001。杨木小刨花垫窝,湿度45%~50%,温度控制在21 ~27 ℃。
1.2 主要试剂及仪器 DMEM 高糖培养基(含100 U 青霉素+链霉素双抗)、胎牛血清、Ⅱ型胶原酶(Worthington 公司,美国)、磷酸盐缓冲液(PBS)、台盼蓝染色液;5-溴-2-脱氧尿苷(Brdu)、4%多聚甲醛、过氧化酶阻断溶液、羊血清、α-actin 抗体(兔抗大鼠)、二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色试剂盒、SABC(链霉亲和素-生物素-过氧化物酶复合物法)免疫组化试剂盒、Mayor's 苏木精、二甲苯、TritonX.100(生工生物工程有限公司,中国)、37 ℃恒温浴锅、医用超净工作台、二氧化碳培养箱、倒置显微镜、恒温离心机等。
1.3 实验步骤 ①将大鼠浸没在75%乙醇中消毒2 次,左手固定乳鼠暴露胸部,右手持眼科剪沿其胸骨左侧剪开,压住肺叶,心脏收缩时可见其膨出。眼科镊钝性分离下心脏,放入有10 mL 10%DMEM培养基(含双抗)的培养皿中。②在第1 个培养皿中挤出心脏的积血并钝性分离出1/2 ~2/3 心室下半部分,依次在第2、3 个平皿中洗涤后放入小烧杯中,用眼科剪快速将所有心脏剪成约1 mm3小块。③取5 mL 消化液放入小烧杯,并轻晃烧杯5 ~8 次,弃去消化液。再次放入3 mL 消化液,用直头吸管将烧杯中的混合物转移到有胶塞的玻璃管中,并将其置于37 ℃水浴锅中并不断晃动8 ~10 min,随后弃去消化液。④取新消化液5 mL 加入到玻璃管中,37℃水浴并晃动8 ~10 min。将组织消化液移入50 mL离心管,在此之前管中先放入20 mL 已温育的含20%FBS 的DMEM(H+),并混匀终止消化。重复此步骤6 ~7 次,直到组织快消化为白色絮状物为止。⑤将收集的消化液800 r/min 的转速离心5 min,弃上清。向离心沉淀中加入含10%FBS 的DMEM(H+)10 mL 混匀,用300 目滤网过滤。将滤液放入培养瓶中,于37 ℃孵箱中孵育90 min,差速贴壁90 min 后取出培养瓶,轻轻晃动,将上层悬浊液混匀移入孔板中(8 min 和10 min 接种浓度相同),以每1 mL 培养基中加入10 μLBrdu,继续温箱培养,24 h 后更换10%FBS DMEM(H+)。⑥取出细胞爬片用PBS 缓冲液洗涤2 次,吸去PBS 后加入适量4%多聚甲醛固定30 min,蒸馏水洗涤2 min×2 次,吸干,加入适量苏木精染色液室温下染色8 min,流动水冲洗约10 min 后吸干,蒸馏水洗涤1 次后浸入95%乙醇5 s,吸干后加入适量伊红染色液室温下染色30 min,70%乙醇洗涤2 次,吸干后置室温下晾干。
1.4 原代心肌细胞活力测定 ①台盼蓝染色法:取细胞悬浊液100 μL,加入100 μL 台盼蓝溶液(2×),混匀。其镜下表现为死细胞被染成淡蓝色,而活细胞拒染。取10 μL 用细胞计数板计数,计数4 个大格中的活细胞总数和染成蓝色的细胞数。使用血球计数板在倒置显微镜下分别计数分离纯化前和分离纯化后的细胞成活率,分别计数3 次,取其平均值。计算公式:
细胞存活率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%
②比较8 min 和10 min 消化时间下原代心肌细胞的活力:在倒置显微镜下观察胞搏动频率,每次观察10 个细胞取平均值,对2 种消化时间下原代心肌细胞搏动频率进行比较。
1.5 原代心肌细胞的鉴定 制作细胞爬片,培养48 h后取出,采用横纹肌肌动蛋白(α-actin)作免疫染色,进行心肌细胞的鉴定。α-actin 为一抗,同时用PBS作为一抗进行对照。取爬片,4%多聚甲醛室温固定、0.1%Triton100 室温孵育穿透及灭活内源性过氧化物酶各30 min 后,滴加1∶100 的α-actin 抗体(兔IgG),4 ℃过夜,孵育二抗20 min,最后DAB 显色,苏木精轻度复染。封固后,显微镜下拍照。
1.6 建立心肌肥大模型 原代心肌细胞孔板中加入血管紧张素II(Angiotensin II,Angll),使其终浓度为10-5mmoI/L,形成心肌肥大模型(即实验组);对照组加入相同体积的10%FBS DMEM(H+)培养液,作用48 h 后,采用RT-PCR 技术观察原代心肌细胞肥大标志性基因心房钠尿肽(atrial natriuretic peptide,ANP)mRNA 表达变化[1]。培养的原代心肌细胞经胰蛋白酶消化悬浮后,在相同相差显微镜下拍摄照片,用图像处理系统测量细胞的截面面积。
1.7 统计学分析 采用SPSS 17.0 软件进行统计分析。计量数据采用均数±标准差()表示,2组间比较采用独立样本t 检验。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 细胞形态
2.1.1 倒置相差显微镜下观察细胞形态 培养12 h后,细胞部分贴壁,多呈圆形、梭形及三角形。培养24 h 后,细胞基本上全部贴壁,并呈有自发搏动,8 min 及10 min 消化时间的细胞形态未见明显异常。培养48h后,8 min 消化时间的细胞少量伸出伪足,多呈三角形及多边形,而10 min 消化时间的细胞大部分伸出伪足相互接触交织成网,逐渐形成细胞簇,立体感明显,细胞搏动及收缩均较明显而有力。
2.1.2 HE 染色后光学显微镜下观察细胞形态 细胞核染成蓝色,细胞质染成淡红色,核膜较为清晰。原代心肌细胞数量较多呈簇状聚集,细胞呈多角形、伸出多量伪足,细胞核丰满、大小均匀,细胞质丰富且着色均匀,见图1a、b。心肌成纤维细胞细胞核染成蓝色,细胞质染成淡红色,细胞核膜较为清晰,平坦,细胞体较大,细胞质透明而薄,细胞核较大,呈椭圆形,颜色淡,见图1c。

图1 原代心肌细胞形态图Figure 1 Morphology of primary cardimyocytes after digested for different times
2.2 心肌细胞活力检测结果
2.2.1 台盼蓝染色结果 分离纯化前活细胞的平均存活率>90%,消化8 min 组和10 min 组比较未见明显区别(P >0.05)。分离纯化后活细胞的平均存活率也>90%,且10 min 组的平均存活率高于8 min 组,差异有统计学意义(P <0.05),见表1。
表1 不同消化时间心肌细胞分离纯化前后平均存活率的比较,%)Table 1 Mean survival rate of cardimyocytes after digested for different times,%)

表1 不同消化时间心肌细胞分离纯化前后平均存活率的比较,%)Table 1 Mean survival rate of cardimyocytes after digested for different times,%)
与8 min 组比较,#P <0.05
组别 分离纯化前 分离纯化后8 min 组93.5±0.9 93.0±0.8 10 min 组 93.0±1.7 95.4±0.8#
2.2.2 原代心肌细胞搏动 原代心肌细胞培养48 h后,2 种消化时间的细胞搏动均达40 ~50次/min;细胞培养5 d 后,发现8 min 消化时间的细胞搏动的数量及次数均明显减少,而10min的细胞搏动未见明显变化。
2.3 免疫组化结果 原代心肌细胞呈阳性反应,细胞质呈深棕色,8 min 和10 min 消化时间的细胞阳性率均>95%,而心肌成纤维细胞呈阴性反应,细胞质无棕色颗粒,见图2。
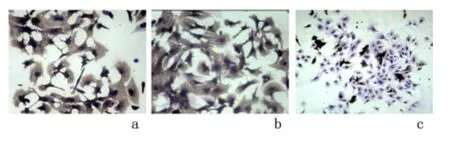
图2 不同消化时间心肌细胞免疫组化镜下结果(×10)Figure 2 Immunohistochemical results of primary cardimyocytes after digested for different times(×10)
2.4 细胞截面平均面积 10 min 消化时间的原代心肌细胞ANP 的CT 值比较,实验组较对照组表达显著升高(P <0.05),而内参GADPH 的CT 值比较,实验组和对照组差异无统计学意义(P >0.05)。Angll 作用原代心肌细胞48 h 后,实验组较对照组细胞截面平均面积比较明显增加(P <0.05),而8 min的原代心肌细胞截面面积和ANP 值未见显著变化(P >0.05)。
表2 肥大模型中各组相关指标的比较Table 2 Comparison of relevant indexes between the experimental and control groups of cardiac hypertrophy models

表2 肥大模型中各组相关指标的比较Table 2 Comparison of relevant indexes between the experimental and control groups of cardiac hypertrophy models
与对照组比较,*P <0.05
组别 ANP(CT 值)GADPH(CT 值)截面平均面积(μm2)对照组15.8±0.5 32.74±0.58 14.11±4.29实验组 20.8±0.7* 32.53±0.88 34.77±8.43*
3 讨 论
原代心肌细胞培养为建立心肌模型提供有效的技术手段,并逐渐趋于成熟。自1960 年Harary 等[2]首次成功的培养出Wister 乳鼠的原代心肌细胞起,国内外许多学者对心肌细胞原代培养方法不断地进行研究及改进,并取得一定成果。现有资料显示,影响原代心肌细胞成活率及活性的主要因素有消化温度、消化酶及消化时间。目前,消化酶的选择主要有2 种,即单独使用胰酶[3-4]和胰酶+胶原酶合用[5-6]。胰酶能分解组织间质的蛋白成分,胶原酶的作用是特异性地水解细胞间质中的胶原纤维,因胰酶作用较强易破坏细胞膜,而胶原酶作用缓和,近年来主要采用胰酶和胶原酶合用来进行消化。在选用胰酶+胶原酶的实验中多数采用其最适温度37℃进行消化,或单独应用胰酶4 ℃过夜[7],采用其较弱的活性充分分解心肌组织间质,之后在应用胶原酶进行消化,以减少对细胞膜的损伤,提高细胞的成活率和活性。
原代细胞培养计数的步骤已趋于成熟,本研究在结合自身实验室条件及环境下进行反复摸索,得到了一套简便易行并且能或得较高成活率、纯度及活性的原代心肌细胞的培养方法。同时,在其他操作条件不变的情况下,探讨不同消化时间如8 min及10 min 对原代心肌细胞的成活率、活性的影响。在本实验中,应用了目前有关原代心肌细胞培养实验中相对成熟的步骤,如选择出生3 d 内的乳鼠[8]及采用90 min 差速贴壁法和Brdu 抑制法分离纯化细胞[9-10]等。在消化酶方面,只采用作用较缓和的胶原酶在37 ℃进行消化,同时,采用短时间多次消化的方式,防止胶原酶消化不彻底,从而增加细胞的产量。在消化时间方面,本研究采用8 min 和10 min消化时间,通过对比发现,2 组纯度鉴定阳性率均达到95%以上,而8 min 组的细胞形态明显滞后于10 min 组,且10 min 组的存活时间和存活率显著高于8 min 组。本研究认为采用8 min 消化法获得的细胞生存时间短可能的原因是由于胶原酶消化不彻底,细胞在震荡中从组织中分离下来,也可能损伤细胞膜,所以导致成活率较10 min 低。另一方面,由于细胞数量少,接种到孔板中的细胞浓度低而影响到单个细胞的搏动及同步化搏动。最后,利用消化时间为10 min 心肌细胞成功的建立心肌肥大模型,AngII 作用48 h 后心肌细胞即实验组ANP 和表面积与对照组相比表达显著升高和增加,而消化时间为8 min 的心肌细胞表面积和ANP 值未见显著变化。与其他原代心肌细胞培养实验相比,本研究成功的从活性和实用性方面说明消化时间是其重要的影响因素。同时说明,该心肌细胞的培养方法能够应用于基础实验的研究。
应用本实验方法获取心肌细胞要注意以下几个方面:①选择有正常生育周期及哺乳周期的育龄期母鼠进行生育。因母鼠的状态会直接影响幼鼠的成活率和生长状态及心脏发育的状态;②心肌细胞培养的过程中要遵守无菌操作的规则,用到的器械及玻璃制品要进行高压灭菌。乳鼠也需要在75%乙醇中消毒2 次,取心脏时应快速,以使取出的心脏仍有搏动。此外,还要避免剪破腹腔,防止污染;③丢弃第1 次消化心肌组织的胶原酶,以去除组织中的血细胞及表面的纤维细胞;④37 ℃消化时应不断摇晃使消化液与组织充分混匀;⑤经过反复验证,在心肌细胞培养的最初24 h 内越少移动细胞,其生长状态越好。
[1] 张 凤,周广海,王 尧,等.心房钠尿肽与心肌肥大的关系[J].中华高血压杂志,2008,16(8):763-766.
[2] Harary I,Farley B.In vitro studies of single isolated beating heart cell[J].Science,1960,131(3414):1674-1675.
[3] 孙 月,徐 洪,徐丁洁,等.新生鼠肺成纤维细胞原代培养方法的比较与体外肌成纤维细胞分化模型的建立[J].医学研究生学报,2014,27(2):129-132.
[4] Fu JJ,Gao J,Pi RB,et al.An optimized protocol for culture of cardiomyocyte from neonatal rat[J].Cytotechnology,2005,49:109-116.
[5] 罗 淋,刘志琴,杨 龙,等.大鼠乳鼠原代心房肌细胞培养的方法及鉴定[J].国际心血管病杂志,2013,2:112-115.
[6] Golden HB,Gollapudi D,Gerilechaogetu F,et al.lsolation of cardiac myocytes and fibroblasts from neonatal rat pups[J].Methods Mol Bio1,2012,843:205-214.
[7] Tao J,Ma Y,Li X,An improved protocol for primary culture of cardiomyocyte from neonatal rat[J].Zhonghua Xin Xue Guan Bing Za Zhi,2013,1(42):53-56.
[8] Huang YC,Khait L,Birla RK.Contractile three dimensional bioengineered heart muscle for myocardial regeneration[J].J Biomed Mater Res A,2007,80(3):719.
[9] Wu LX,Gu XF,Zhu YC,et al.Protective effects of novel single compound,Hirsutine on hypoxic neonatal rat cardiomyocytes[J].Eur J Pharmacol,2011,650(1):290-297.
[10] Zhang ZY,Liu XH,Hu WC,et al.The calcineurin-myocyte enhancer factor 2c pathway mediates cardiac hypertrophy induced by endoplasmic reticulum stress in neonatal rat cardiomyocytes[J].Am J Physiol Heart Circ Physiol,2010,298(5):499-509.

